利用溶氧调控型启动子Pvgb构建产surfactin的重组枯草芽孢杆菌
2020-12-29周大袁林佳辉
周大袁,林佳辉,李 霜
(南京工业大学 生物与制药工程学院,江苏 南京 211800)
表面活性素(surfactin)是芽孢杆菌(Bacillus)分泌的一种脂肽类化合物,由亲水肽环与疏水脂肪酸链组成[1]。与化学合成的表面活性剂相比,surfactin具有低毒、可生物降解、可再生、优异的乳化活性与表面活性等优点,在石油开采、环境修复、医药卫生等行业具有广泛的应用前景[2-4]。
当前,采用诱变育种或培养基优化等技术可将产surfactin野生菌株的产量从100~600 mg/L提高到1 000 mg/L左右[5-6];采用基因工程手段,如改造surfactin合成模块的启动子强度和促进产物外排等,可将surfactin产量提升2~5倍[7-8]。在surfactin的发酵过程中,由于surfactin具有良好的表面活性和起泡性,在搅拌和曝气过程中会形成大量的泡沫,泡沫携带大量发酵液及菌体从生物反应器的排气口溢出,造成产物、营养物质和细胞的流失,并且伴随着高度污染风险。近年来,泡沫分离装置[9]、固定化发酵[10]以及厌氧发酵[11]等发酵装置和工艺相继出现,仍未有效解决产泡难题。
可溶性血红蛋白(VHb)是透明颤菌属(Vitreoscilla)菌株体内的一种可以高效摄取环境中氧分子的蛋白,它可以提升细菌在发酵液中的摄氧量,因而在各种好氧微生物中得到应用[12-13]。编码VHb蛋白的基因是vgb,其启动子Pvgb是溶氧调控型,可以在低氧含量的条件下被启动,增加VHb的含量,从而增加细菌的摄氧率。Wu等[14]用串联重复的Pvgb启动子调控Escherichiacoli中聚羟基丁酸酯(PHB)关键基因的表达,使得重组E.coli在微氧发酵条件下PHB产量提高了3.5倍,达到4.86 g/L。而Pvgb启动子在枯草芽孢杆菌中的活性及溶氧诱导转录强度等研究尚未有研究报道。
Surfactin是由非核糖体肽合成酶(NRPS)催化合成的模式化合物,NRPS负责识别和催化不同的氨基酸底物,进行surfactin的肽端模块组装,而4′-磷酸泛酰巯基乙胺转移酶(Sfp功能蛋白)则是起着“激活”NRPS中功能结构域的作用[15]。因为Bacillussubtilis168菌株中编码Sfp功能蛋白的基因sfp发生移码突变,导致它无法合成surfactin;将sfp基因回补到168菌株后,重组168菌株可以合成surfactin[16]。
本文中,笔者考察溶氧诱导型启动子Pvgb及其串联多拷贝启动子在枯草芽孢杆菌168菌株中的转录水平,利用溶氧诱导型启动子Pvgb调控Sfp蛋白的表达,考察不同溶氧条件下重组168菌株合成surfactin的能力,以期为微氧发酵surfactin工程菌的构建提供研究基础。
1 材料与方法
1.1 材料
1.1.1 菌株及质粒
枯草芽孢杆菌B.subtilis168(简称Bs168)、surfactin高产菌株枯草芽孢杆菌B.subtilisBS-37、大肠杆菌E.coliDH5α、质粒载体pHY300PLK与带有绿色荧光蛋白基因质粒(pJN-gfp),保存于笔者所在实验室;带有8个串联重复Pvgb启动子质粒(pBHR-P8vgb)由清华大学陈国强教授馈赠。
1.1.2 仪器设备
ZQZY-70BS型双层恒温振荡培养箱,上海知楚仪器有限公司;DGP3600-SD型高效液相色谱仪,美国赛默飞世尔科技公司;Spectra Max M3型多功能酶标仪,上海寰熙医疗器械有限公司;紫外分光光度计,上海第三分析仪器厂。
1.1.3 工具酶及试剂
限制性内切酶(XbaⅠ、SmaⅠ)、PCR高保真酶Prime STAR Mix与质粒T4连接酶,TaKaRa公司;引物合成及测序由苏州金唯智公司完成;其余试剂为进口或国产市售分析纯。
1.1.4 培养基及培养条件
大肠杆菌与芽孢杆菌均用LB培养基(g/L):胰蛋白胨 10.0、酵母粉 5.0、NaCl 10.0。培养基调pH为7.0,0.1 MPa灭菌20 min。
抗生素(μg/mL):氨苄青霉素50、四环素20。
产surfactin发酵培养基(g/L):蔗糖 20.0、蛋白胨 20.0、KH2PO410.0、K2HPO43.0、MgSO40.5、FeSO40.02。
种子培养液培养条件:37 ℃、200 r/min培养12 h;发酵培养基接种量为2%(体积分数),37 ℃发酵培养24 h。
不同溶氧控制方法:高溶氧培养条件是250 mL带挡板的锥形瓶中装入50 mL发酵液,8层纱布封口,转速为200 r/min;低氧培养条件是250 mL锥形瓶中装入100 mL发酵液,16层纱布封口,转速为100 r/min。
1.1.5 引物
本实验所用引物如表1所示。

表1 本实验所用引物Table 1 Primers used in this experiment
1.2 方法
1.2.1 不同基因片段的重叠PCR
重叠PCR分两步进行。第一步:分别以Bs168、B.subtilisBS-37、pBHR-P8vgb和pNJ-gfp为模板,用表1中的引物,反应体系为模板1 μL,上下游引物各1 μL,Prime STAR Mix 25 μL,重蒸水 22 μL。PCR条件为94 ℃预变性5 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸(每1 000 bp衍生1 min),30个循环,PCR结束后进行胶回收。第二步:以胶回收好的基因片段为模板,反应体系为需要重叠的2个片段各1 μL,2个片段的上下游引物各1 μL(需要重叠在一起的片段中,5′引物为上游引物,3′为下游引物),Prime STAR Mix 25 μL,重蒸水 21 μL;PCR条件不变,结束后胶回收。
1.2.2 重组质粒构建
经过重叠PCR的基因产物与大肠杆菌-枯草芽孢杆菌穿梭质粒pHY300PLK,分别用限制性内切酶XbaⅠ、SmaⅠ酶切4 h后,经过胶回收,再用T4连接酶过夜连接,获得不同的重组质粒,转入到大肠杆菌E.coliDH5α中,用四环素与氨苄青霉素抗性平板筛选,挑选单克隆,再经菌落PCR验证。
1.2.3 重组质粒转化到枯草芽孢杆菌
重组质粒转化到枯草芽孢杆菌中的转化方法参照文献[17]进行,最后提取质粒PCR验证。
1.2.4 发酵液中surfactin含量测定
取发酵液1 mL,在12 000 r/min条件下离心5 min;取300 μL上清液,用1 200 μL色谱级无水乙醇稀释混匀,12 000 r/min条件下离心5 min后,用0.22 μm的有机膜过滤,记为待测样品。Surfactin的检测利用高效液相色谱(戴安P680),色谱柱为Amethyst C18-P column(4.6 mm×250 mm,5 μm)。液相条件为流动相为90% 的甲醇与10%的水(含有0.05%的三氟乙酸),进样量40 μL,流速0.8 mL/min,柱温35 ℃;采用紫外检测器检测,波长为214 nm。以surfactin标准品(Sigma公司)为参照进行定量定性。
1.2.5 菌体荧光性检测
取1 mL发酵液,8 000 r/min离心10 min后,用无菌水悬浮清洗3次后,将菌体浓度稀释成同一浓度,取200 μL待测菌液至96孔酶标板上,设置出发菌作为对照,用Spectra Max M3多功能酶标仪检测,选择激发滤光片为485 nm、发射滤光片为525 nm。用HT Soft软件分析所得数据,并重复3次。
2 结果与讨论
2.1 重组表达质粒pHY300-Pvgb-gfp、pHY300-P43-gfp构建及验证
以质粒pJN-gfp为模板,用表1中的引物克隆出gfp基因,并与已获得启动子P43或单个Pvgb重叠PCR,获得的克隆片段P43-gfp、Pvgb-gfp与质粒pHY300都经过XbaⅠ与SmaⅠ的限制性酶切后,用T4连接酶过夜连接,获得重组质粒,转入大肠杆菌E.coliDH5α中,挑取单菌落进行PCR验证,结果如图1所示。
由图1可知,酶切基因gfp片段长度约为727 bp,表明重组质粒pHY300-Pvgb-gfp、pHY300-P43-gfp构建成功。
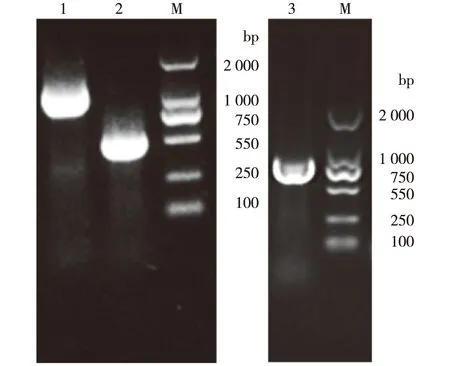
1—P43 gfp验证;2—P43验证;3—Pvgb gfp验证;M—DNA标准品图1 重组质粒pHY300-P43-gfp与pHY300- Pvgb-gfp的PCR验证Fig.1 PCR profile of recombinant plasmid pHY300- P43-gfp and pHY300-Pvgb-gfp
2.2 多拷贝启动子Pvgb及表达质粒pHY300-Pnvgb-gfp构建
Wu等[14]证明在大肠杆菌中Pvgb启动子的转录强度受到其串联重复拷贝数量的影响,Pvgb启动子拷贝数为1~8时,转录强度具有正相关性。但在枯草芽孢杆菌中,Pvgb启动子的转录活性及强度还未见报道,因此本实验中使用绿色荧光蛋白GFP为标记蛋白,考察1~3个重叠启动子Pvgb的启动强度,构建了1~3个重叠的Pvgb启动子(图2),以gfp为报告基因,构建表达质粒pHY300-Pnvgb-gfp,并导入大肠杆菌E.coliDH5α中,挑取单菌落进行PCR验证。
由图2可知,PCR验证结果出现明显的两条或三条带,这是因为Pvgb启动子重叠了2个或3个。由此可推断重组质粒pHY300-Pnvgb-gfp构建成功。

M—DNA标准品;1—Pvgb验证;2—Pvgb-gfp验证;3—P2vgb验证;4—P2vgb-gfp验证;5—P3vgb验证;6—P3vgb-gfp验证图2 重组质粒pHY300-Pnvgb-gfp的PCR验证Fig.2 Colony PCR profile of recombinant plasmid pHY300-Pnvgb-gfp
2.3 重组表达质粒pHY300-Pvgb-sfp、pHY300-P43-sfp构建及验证
以Bs168为模板克隆P43启动子序列,以高产surfactin菌株B.subtilisBS-37[10]为模板克隆具有功能的sfp基因,再以质粒pBHR-P8vgb为模板,克隆出单个Pvgb启动子,并用重叠PCR获得Pvgb-sfp与P43-sfp片段。将获得的克隆片段与质粒pHY300经过XbaⅠ与SmaⅠ的限制性酶切后,用T4连接酶连接过夜,获得重组质粒,并转入大肠杆菌E.coliDH5α中,挑取单菌落进行PCR验证,结果如图3所示。

M—DNA标准品;1—P43验证;2—P43-sfp验证;3—Pvgb验证;4—Pvgb-sfp验证图3 重组质粒pHY300-P43-sfp与pHY300- Pvgb-sfp的PCR验证Fig.3 Colony PCR profile of recombinant plasmid pHY300-P43-sfp and pHY300-Pvgb-sfp
由图3可知,启动子P43长度是387 bp,基因sfp长度是675 bp,启动子Pvgb长度是135 bp,表明重组质粒pHY300-Pvgb-sfp、pHY300-P43-sfp构建成功。
2.4 单个启动子Pvgb与多拷贝启动子Pvgb在枯草芽孢杆菌中启动活性测定
利用GFP蛋白编码基因为报告基因,考察单个启动子(Pvgb)、2个启动子(P2vgb)以及3个启动子串联(P3vgb)在Bs168中的表达水平,结果如图4所示。

培养条件:1—50 mL发酵液(250 mL摇瓶),8层纱布,37 ℃、200 r/min;*—100 mL发酵液(250 mL摇瓶),16层纱布,37 ℃、100 r/min图4 不同溶氧条件下不同启动子的荧光强度比较Fig.4 Comparison of fluorescence intensities of different promoters under different dissolved oxygen conditions
由图4可知,随着Pvgb拷贝数增加,GFP的表达水平有一定增强,P3vgb启动的表达量可以提高1倍,这也与Wu等[14]在大肠杆菌中的研究结果相同;但溶氧水平对单个和多拷贝的Pvgb启动子的表达水平没有特别显著的影响,在低溶氧水平下,P3vgb的表达量仅比高溶氧水平的对照组提高了不到20%。同时,与枯草芽孢杆菌中常用的强启动子P43相比,单个及多拷贝Pvgb的表达强度远远低于前者,表明在枯草芽孢杆菌中Pvgb具有一定的启动活性,但强度很低。
2.5 重组菌株的surfactin发酵结果
2.5.1 重组菌株B.subtilis168-P43-sfp与B.subtilis168-Pvgb-sfp的surfactin发酵验证
宿主Bs168菌株因sfp基因的移码突变,无法合成surfactin,将具有活性功能的sfp基因构建到重组质粒pHY300-P43-sfp和pHY300-Pvgb-sfp中,通过化学转化方法导入宿主Bs168中,获得了重组菌株Bs168-P43-sfp与Bs168-Pvgb-sfp,结果见图5。
由图5可知,重组枯草芽孢杆菌在LB培养基中好氧发酵24 h后,用高效液相色谱(HPLC)检测surfactin的产量(结果证明野生菌株Bs168无法合成surfactin),而导入有活性的Sfp蛋白后,重组Bs168菌株可以生产surfactin,与Ongena等[18]研究结果相同。
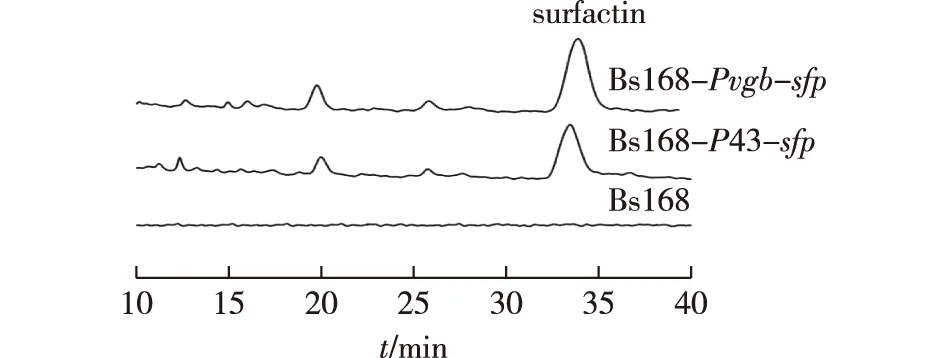
图5 Surfactin的高效液相色谱Fig.5 HPLC chromatography of surfactin
利用168菌株构建产surfactin工程菌,可以选用不同来源的Sfp功能蛋白。将本研究中所表达的Sfp功能蛋白与刘丽霞等[16]所使用的Sfp功能蛋白比较后发现,其同源性为72%,表明Bs168菌株的NRPS系统对Sfp功能蛋白具有较好的适配性。
2.5.2 重组菌株在不同溶氧条件下的surfactin发酵
将携带P43-sfp以及不同拷贝Pnvgb-sfp(n=1~3)的重组质粒转化到Bs168菌株中,考察4个重组菌株在不同溶氧条件下的surfactin发酵水平,结果如图6所示。
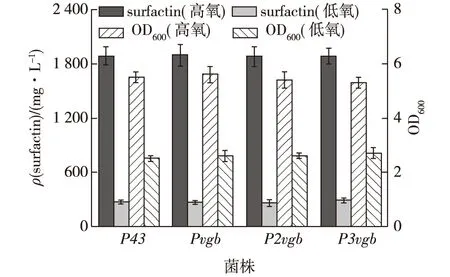
图6 不同发酵条件下重组菌株Bs168的surfactin产量Fig.6 Surfactin yield of recombinant Bs168 strains under different fermentation conditions
由图6可知:不同溶氧条件下重组菌株的surfactin产量差异巨大,在高氧条件下,4个重组菌株的surfactin产量差异不显著,均可以达到1 800 mg/L,单位菌体密度(1 OD)的生产水平为380 mg;但在低氧条件下,surfactin产量均只有200 mg/L,单位菌体密度的生产水平为80 mg。
上述结果表明:Sfp功能蛋白的表达水平并不是决定surfactin合成能力的关键因素,高溶氧条件才是surfactin高效合成的重要因素;即使细胞中Sfp功能蛋白的数量差异达百倍,对surfactin的合成能力并无显著影响。影响surfactin合成的因素包括srfA的表达水平[7]以及合成前体如中长链β-羟基酯酰CoA和重要氨基酸前体(如,L-Leu、L-Glu和L-Asp等)的供给水平[19]。王大威等[20]在产脂肽的枯草芽孢杆菌ZW-3中表达了透明颤菌血红蛋白基因VHb,结果发现脂肽产量提高了31.8%,达111.6 mg/L。用于合成surfactin的NRPS是一个多酶复合物,由srfA基因簇上的4个基因(srfAA、srfAB、srfAC和srfAD)编码,在Bs168菌株中srfA基因簇的启动子PsrfA是一个诱导型强启动子[20]。因此,进一步强化Bs168菌株在低溶氧下合成surfactin的能力需要从两个方面开展:①提高细胞的溶解氧摄取能力和强化低溶氧下srfA的表达水平;②在surfactin生产菌株中进行外源VHb基因的强化表达将有助于提高菌株对溶解氧的摄取能力,提升菌株在低溶氧条件下的surfactin发酵水平。
3 结论
将来源于透明颤菌血红蛋白VHb的溶氧调控型启动子Pvgb在枯草芽孢杆菌168菌株中进行了功能验证,发现Pvgb在168菌株中为弱启动子,具有较弱的低溶氧诱导作用和“剂量效应”。通过比较弱启动子Pvgb与强启动子P43对Sfp功能蛋白的表达以及溶氧水平对surfactin发酵的影响,发现枯草芽孢杆菌168菌株中决定surfactin合成能力的关键因素是溶氧水平而不是Sfp功能蛋白的表达量。因此,强化表达提高溶氧摄取能力的VHb功能基因将有助于促进菌株在低溶氧水平下的surfactin合成能力。
