葡萄霜霉病菌环介导等温扩增检测体系的建立
2020-12-29闫思远王小利杜娟顾沛雯
闫思远, 王小利, 杜娟, 顾沛雯
(宁夏大学农学院,宁夏 银川,750021)
葡萄霜霉病是由葡萄生单轴霉(Plasmoparaviticola)引起的一种世界性病害[1]。该病是一种典型的流行性病害,病菌从侵入到发病仅需要3 ~ 5 d[2]。在条件适宜时,从田间出现中心病株到全田普发,仅需10 ~ 15 d[3]。葡萄霜霉病菌是一种活体营养专性寄生菌,无法人工培养,这在一定程度上影响了对该菌的早期诊断、监测、群体遗传分化等方面的深入研究[4]。传统的病原菌分离鉴定方法比较繁琐,无法实现早期快速准确诊断,给病害监测和防控工作带来一定困难[5]。因此,建立简便、快捷和准确的早期监测技术尤为重要。
环介导等温扩增(loop-mediated isothermal amplification,LAMP)技术是由Notomi在2000年开发出的一种新型的在恒温条件下快速完成靶标基因扩增的新方法[6]。该方法利用1对内引物FIP/BIP和1对外引物F3/B3,在具有链置换活性的Bst DNA 聚合酶的作用下,于恒温条件下催化新链的合成,从而实现高效扩增的目的[7]。LAMP反应过程包括3个阶段,分别为哑铃状模板合成阶段、循环扩增阶段、延伸和再循环阶段,最终形成大小不一的茎环结构和多环花椰菜结构的DNA片段混合物,使得产物在琼脂糖凝胶电泳上呈现梯形条带[8]。LAMP技术自发明以来,就被广泛应用于细菌、真菌、病毒和线虫等病原体的检测[9]。黄雯等[10]建立了青枯菌(Ralstoniasolanacearum)LAMP体系,并对反应条件进行了优化,为青枯病在田间的快速精准诊断、植物繁殖材料带菌检测以及病害的防控效果评价提供技术支撑。曾丹丹等[11]建立了水稻拟轮枝镰孢(Fusariumverticillioides)的LAMP检测体系,用于江苏南京和镇江地区疑似水稻恶苗病的快速诊断。FERRARA等[12]利用LAMP技术检测能够产生伏马毒素的黑曲霉(Asperigillusniger)和(A.welwitschiae),为有效减少玉米中曲霉毒素的污染提供了依据。本研究根据葡萄霜霉病菌ITS的全长基因序列设计合成特异性引物,通过优化扩增体系和反应条件,鉴定方法的特异性、灵敏性和实用性,构建葡萄霜霉病菌LAMP检测技术体系,以期为葡萄霜霉病菌的早期诊断和预测预报提供一种切实可行的方法。
1 材料与方法
1.1 材料
14种葡萄及其他作物病原菌(表1)经过形态学观察和rDNA-ITS序列分析进行菌株鉴定,保存于宁夏大学农学院植物病理实验室。

表1 供试菌株
1.2 主要仪器与试剂
Simpli Nano超微量分光光度计(GE Healthcare公司,美国);Sigma 3K 15通用台式冷冻离心机(Sigma公司,美国);T 100TM Thermal Cycler PCR仪(Bio Rad公司,美国);电泳仪(北京六一厂);Azure c200凝胶成像系统(Azure Biosystems公司,美国);Blook蓝光透照仪(Genedirex台湾德怡科技有限公司);Mettler-toledo LE204E电子分析天平(Mettler-toledo公司,瑞士)。
真菌DNA提取试剂盒(Biospin®Fungus Genomic DNA Extraction Kit,BioFlux公司,日本);植物DNA提取试剂盒(E.Z.N.A.®HP Plant DNA Mini Kit,Omega Bio-tek公司,美国);Bst DNA polymerase(New England Biolabs公司,美国);Betaine(上海生工生物工程有限公司);SYBR Green I(上海瑞楚生物公司);100 bp DNA Ladder(北京全式金公司);dNTP Mixture(BBI生命科学有限公司)。
1.3 引物设计与合成
使用Primer Premier 6.0,根据GenBank中葡萄霜霉病菌(登录号:DQ665668和登录号DQ665666)、葡萄白粉菌(登录号:LC028995和登录号:KJ539202)和葡萄灰霉菌(登录号:KX443701)的rDNA-ITS的序列信息,进行序列比对。以葡萄霜霉菌rDNA-ITS(登录号:DQ665668)全长序列(2 337 bp),采用Primer Explore V4设计LAMP引物,根据引物长度、引物自由能及GC含量等筛选,获得7对LAMP引物,序列如表2所示,由生工生物工程(上海)有限公司合成。
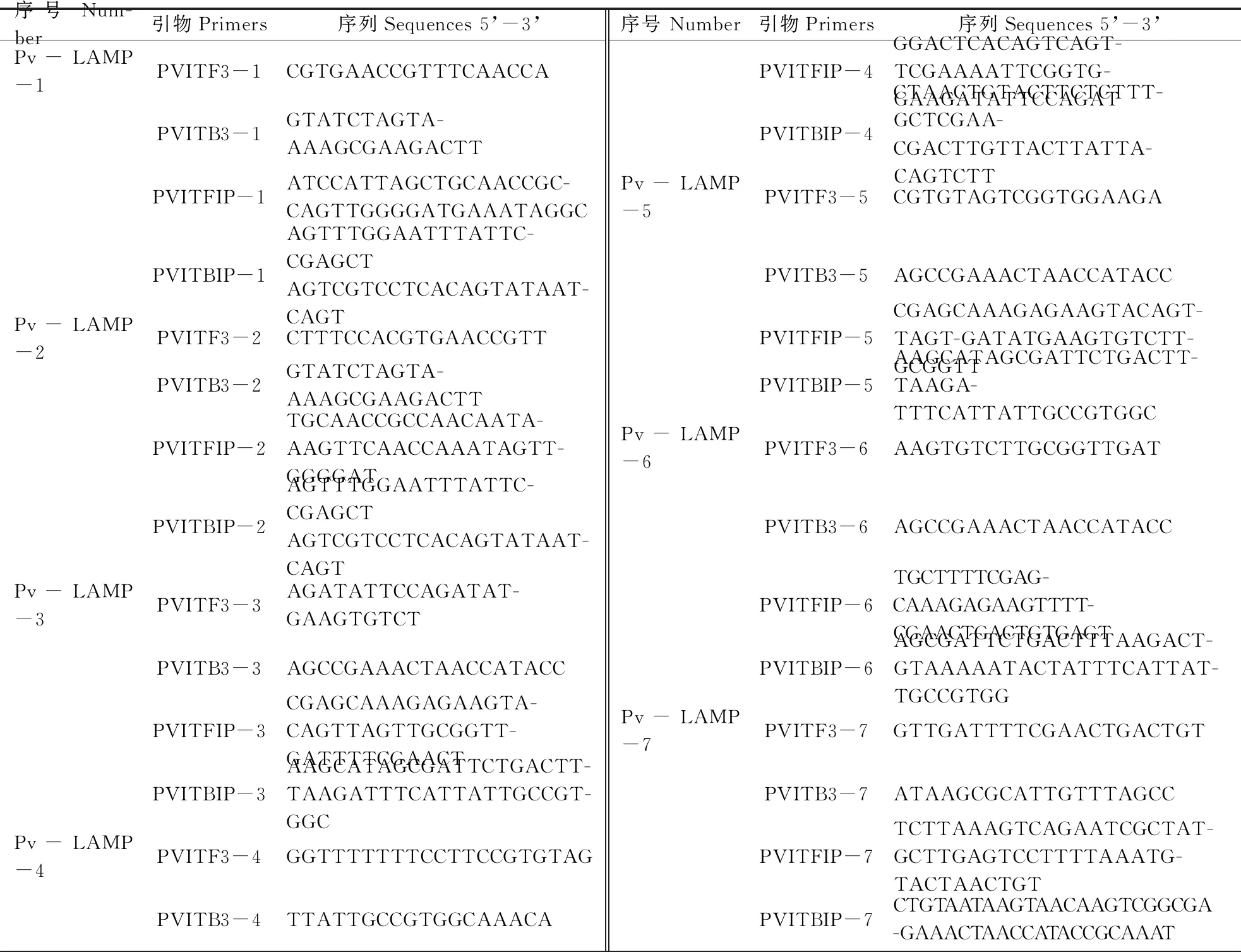
表2 本研究所用的LAMP引物
1.4 样品DNA提取
使用Biospin®Fungus Genomic DNA Extraction Kit提取14种真菌菌丝体DNA(表1)。使用3®HP Plant DNA Mini Kit提取葡萄叶片DNA,分别于-80 ℃保存,备用。
1.5 LAMP引物初筛
参照KONG等[13]的方法建立LAMP反应体系,并略作调整。1 μL DNA模板,10×ThermoPol Buffer 2.5 μL,10 mmol·L-1的MgCl26 μL;8 U·μL-1Bst DNA polymerase 1 μL;5 mol·L-1甜菜碱5 μL;10 mmol·L-1dNTPs 2.5 μL;50 μmol·L-1FIP/BIP 0.7 μL;20 μmol·L-1F3/B3 0.25 μL,ddH2O补充至25 μL。反应条件为:65 ℃恒温扩增60 min。利用上述反应体系以葡萄霜霉病菌DNA为模板,进行LAMP扩增,对7对引物进行筛选。反应结果通过1.5%的琼脂糖凝胶电泳法检测。
1.6 LAMP引物特异性检查
使用筛选出的引物对上述(表1)提取的14种真菌DNA进行LAMP扩增,以ddH2O为空白对照,以健康葡萄叶片DNA为阴性对照,检测引物特异性。反应结果通过1.5%的琼脂糖凝胶电泳法检测。
1.7 LAMP反应体系的优化
按照1.4的方法,分别考察Bst DNA聚合酶含量(终含量变化为0.192~0.512 U·μL-1),反应温度(反应温度变化范围为58~66 ℃),反应时间(30~75 min)对LAMP的影响,以ddH2O为空白对照。反应结果通过1.5%的琼脂糖凝胶电泳法检测。
1.8 LAMP体系灵敏度测定
将葡萄霜霉菌DNA质量浓度分别稀释为1.0、0.9、0.8、0.7、0.6、0.5、0.4、0.3、0.2、0.1 ng·μL-1。使用优化后的环介导等温扩增体系进行扩增,评价所建立的体系对于葡萄霜霉病菌DNA检测的灵敏度。反应结果通过1.5%的琼脂糖凝胶电泳法检测或加入SYBR Green I荧光染液在自然光和蓝光仪观察颜色变化(嫩绿色、有荧光为阳性;橙红色、无荧光为阴性)。
1.9 田间葡萄霜霉病样品检测
2019-08-15,在宁夏新惠彬酒庄、贺兰神酒庄、酩悦轩尼诗夏桐(宁夏)酒庄、张裕摩塞尔十五世酒庄等4个酒庄葡萄园采集病叶,以葡萄无菌组培苗为对照。按照1.4的方法提取葡萄叶片总DNA,使用优化后的LAMP体系进行扩增,反应结果通过1.5%的琼脂糖凝胶电泳法检测或加入SYBR Green I荧光染液在自然光和蓝光仪观察颜色变化。
2 结果与分析
2.1 引物初筛
以葡萄霜霉病菌DNA为模板,对7对引物进行筛选,如图1所示,只有引物Pv-LAMP-1和Pv-LAMP-2能够扩增出梯状条带,其他引物均无条带出现。
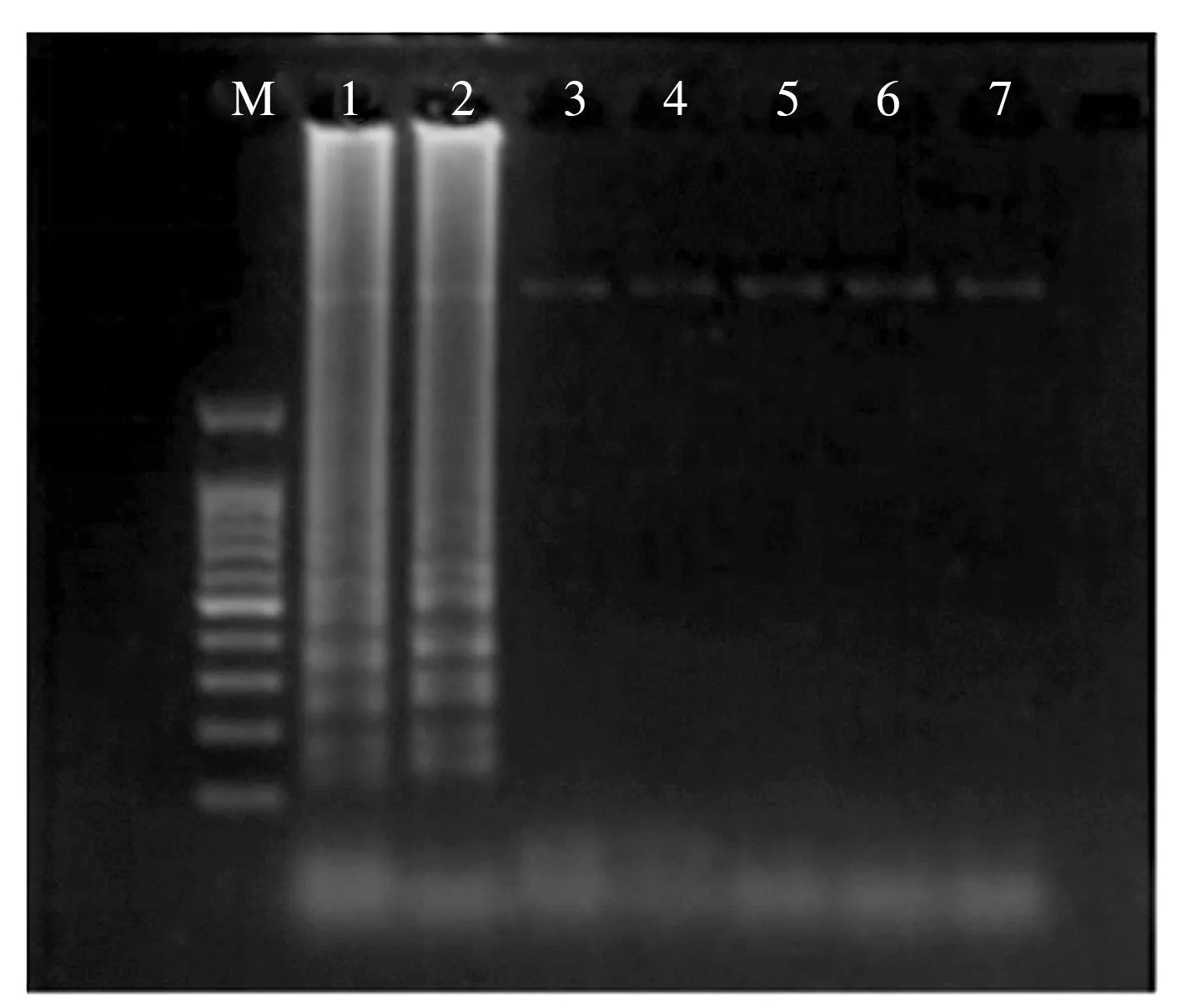
M:Marker;1~7:引物Pv-LAMP-1~Pv-LAMP-7。
2.2 引物特异性检测
使用LAMP引物Pv-LAMP-1和Pv-LAMP-2分别对葡萄霜霉病菌、辣椒炭疽病菌和葡萄灰霉病菌等14种植物病原真菌基因组DNA进行扩增。如图2所示,引物Pv-LAMP-1能够检测来源于鲜食葡萄(红地球)和酿酒葡萄(霞多丽)的葡萄霜霉病菌,而其他供试菌DNA,健康葡萄叶片DNA以及清水对照均不能扩增出梯状条带。引物Pv-LAMP-2能够扩增出葡萄霜霉病菌、葡萄白粉病菌和西葫芦白粉病菌,对葡萄霜霉病菌没有特异性。因此,选择引物Pv-LAMP-1进行后续试验。
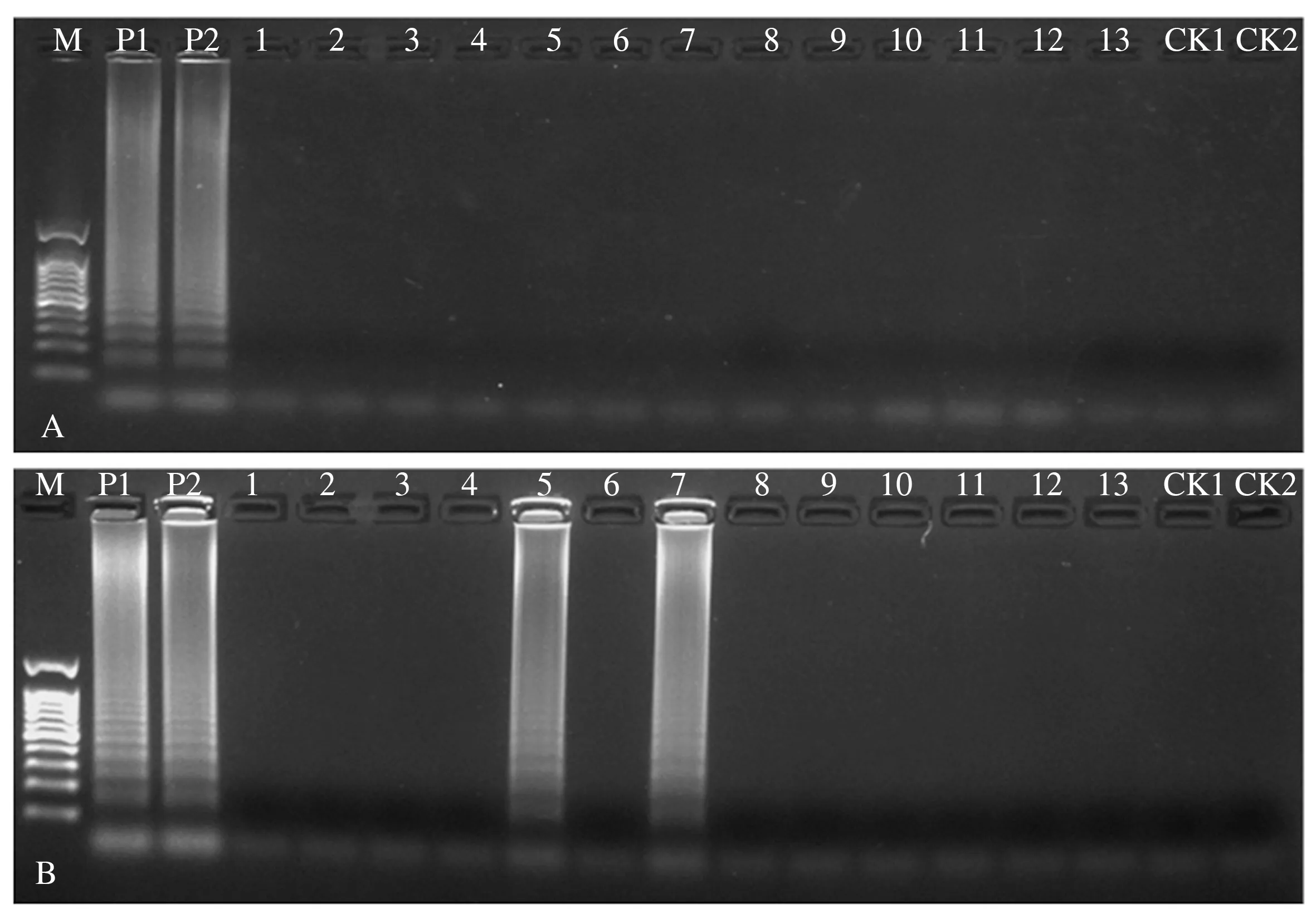
A:Pv-LAMP-1;B:Pv-LAMP-2。
2.3 LAMP反应条件优化
对LAMP反应条件如Bst DNA聚合酶含量、反应温度、反应时间进行了优化。
当体系中Bst DNA聚合酶含量为0.32 U·μL-1时梯状条带最清晰,而在其他含量的时候亮度虽高,但清晰度较差,因此反应体系中Bst DNA聚合酶最佳含量为0.32 U·μL-1(图3-A)。
当温度为58 ℃的时候,无条带出现,当反应温度为60 ~ 66 ℃时均可扩增出梯状条带。当温度高于62 ℃时,随着温度的升高,条带亮度增强而清晰度减弱。因此,选取62 ℃为LAMP的最佳反应温度(图3-B)。
如图3-C所示,当反应时间为30 min时无条带出现,即30 min不足以产生电泳能够检测到的目的条带;当反应时间为45 min时有条带显现但条带亮度较差;当反应时间为75 min时,有条带显现但条带亮度较高,清晰度较差;当反应时间为60 min时,条带的亮度与清晰度均为最佳。因此,LAMP检测最佳反应时间为60 min。
A:Bst DNA聚合酶对LAMP检测的影响(M:Marker;1:0.192 U·μL-1;2:0.256 U·μL-1;3:0.320 U·μL-1;4:0.384 U·μL-1;5:0.448 U·μL-1;6:0.512 U·μL-1);B:反应温度对LAMP检测的影响(M:Marker;1:58 ℃;2:60 ℃;3:62 ℃;4:64 ℃;5:66 ℃);C:反应时间对LAMP检测的影响(M:Marker;1:30 min;2:45 min;3:60 min;4:75 min)。
2.4 LAMP灵敏度检测
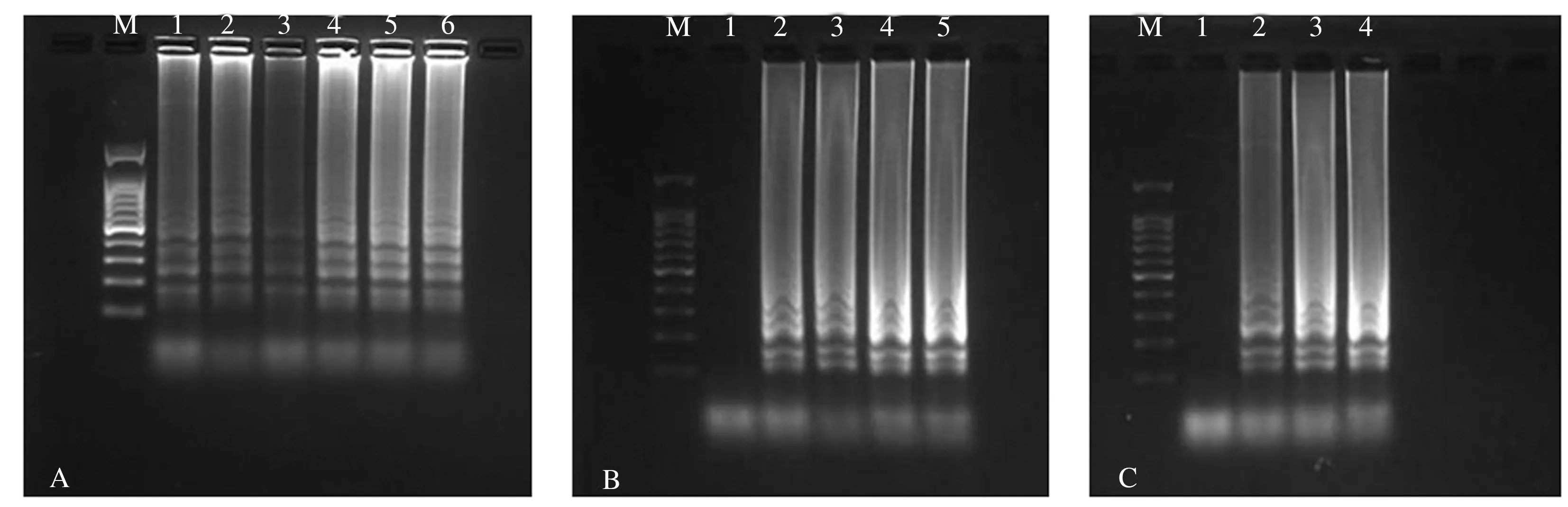
对优化后的LAMP体系进行灵敏度检测,结果表明优化后的LAMP体系的检测灵敏度为0.3 ng·μL-1(图4-A)。通过SYBR Green Ι荧光染液染色,当模板质量浓度低于0.3 ng·μL-1时,加入染色剂,反应底物颜色为橙红色,当模板质量浓度大于0.3 ng·μL-1时,随着DNA模板浓度的增加,绿色的深度逐渐递增,在蓝光仪下的荧光强度也逐渐增强(图4-B、C)。
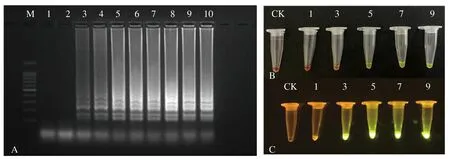
A:LAMP灵敏度检测;B:自然光下SYBR Green Ⅰ荧光染液检测;C:蓝光下SYBR Green Ⅰ荧光染液检测。
2.5 田间葡萄霜霉病的LAMP检测
从宁夏新惠彬酒庄、贺兰神酒庄、酩悦轩尼诗夏桐(宁夏)酒庄、张裕摩塞尔十五世酒庄采集病叶,提取叶片DNA,进行LAMP扩增。结果如图5所示,不同来源的葡萄霜霉病叶均能使用所建立的LAMP体系扩增出梯状条带,准确率高达100%。使用SYBR Green Ι荧光染液对反应产物进行染色,呈现出与电泳相同的结果。
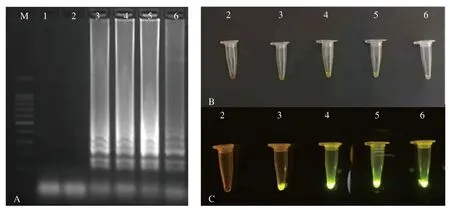
A:LAMP检测;B:自然光下SYBR Green Ⅰ荧光染液检测;C:蓝光下SYBR Green Ⅰ荧光染液检测。
3 结论与讨论
预测预报技术是准确防控葡萄霜霉病、减少农药使用和精准施用的关键。因此,开展葡萄霜霉病预测预报研究,对于科学防治葡萄霜霉病具有重要意义[14-15]。分子检测技术是作为预测预报的重要手段,可为精准的预测预报提供了分子技术方案。目前,关于葡萄霜霉病菌的快速分子检测方法的报道很少。秦文韬等[16]利用葡萄霜霉病菌细胞色素C氧化酶亚型2(cytochromecoxidase Ⅱ,Cox2),设计了1对特异性检测引物F-Pv/R-Pv,建立了葡萄霜霉病菌常规PCR检测体系,并对78份国内不同产区的葡萄霜霉病样品进行检测,准确率高达100%。李文学等[17]利用Cox2基因序列设计了1对特异性引物F-cox-Pv/R-Pv,建立了实时荧光定量PCR反应体系,并对人工接种葡萄霜霉病菌的潜伏期叶片内病原菌DNA进行RT-PCR检测。常规PCR检测和实时荧光定量检测,除了需要设计特异性引物,检测必须在特定的仪器、程序和扩增条件下完成,耗时、耗力且检测成本高。LAMP技术依赖4条特异引物(包括正向外引物、正向内引物、反向外引物和反向内引物)和一种具有链置换特性的DNA聚合酶,在等温条件下快速、高效、高特异、高灵敏的扩增序列[18]。该方法操作简单,恒温条件下,一步扩增就可以完成样品检测,使检测周期大幅度缩短,降低检测成本[19]。
国内有关葡萄霜霉病的LAMP检测体系的建立文献较少,仅秦文韬[15]利用1对内引物FIP/BIP和1对外引物F3/B3外加1条环引物LB建立了葡萄霜霉病的检测体系,用于鲜食葡萄霜霉病的检测鉴定。笔者前期使用秦文韬设计的引物用于检测酿酒葡萄霜霉病,未扩增出目的条带。本研究根据葡萄霜霉病ITS序列设计了1对内引物和1对外引物建立了葡萄霜霉病菌LAMP检测体系,能分别检测到被葡萄霜霉病菌感染的酿酒葡萄和鲜食葡萄样品;此外,相对于秦文韬建立的检测体系减少了1~2条环引物的设计,而灵敏度几乎一致,从而降低了引物合成成本,简化了试验步骤。
Bst DNA聚合酶是一种链置换的DNA聚合酶[18],不同来源的Bst DNA聚合酶都有其最适量、最适宜反应温度和反应时间的组合,需要针对不同DNA样品、LAMP引物和反应条件进行筛选和优化。本研究最终获得LAMP最佳反应条件为以PVITF3-1/PVITB3-1外引物,PVITFIP-1/PVITBIP-1为内引物,反应体系中Bst DNA聚合酶含量为0.32 U·μL-1,在62 ℃反应60 min,一步扩增完成,灵敏度为0.3 ng·μL-1,适合于鲜食葡萄和糖度较高的酿酒葡萄样品检测,且反应稳定。甚至在缺少PCR仪的情况下,利用金属浴等恒温设备也可以完成反应。此外,检测扩增产物除采用电泳外,染色剂染色也可以确定待测样品是否感染葡萄霜霉病菌,具有易操作、快速、灵敏、高度特异性等特点,适于葡萄产区、企业等基层技术部门进行葡萄霜霉病菌的快速检测,具有实用性和推广价值。
