超声波联合酶法提取燕麦麸皮β-葡聚糖的工艺优化
2020-12-29李密转路文秀李名立李秋萍
李密转, 路文秀, 李名立, 李秋萍
(遵义医科大学 公共卫生学院, 贵州 遵义 563003)
燕麦是世界各地广泛种植的禾本科燕麦属草本植物,有皮燕麦和裸燕麦2种品种。我国是世界燕麦主产国之一,以裸燕麦为主,燕麦种植面积在70万hm2左右,每年产量平均约85万t,呈逐年上升趋势[1]。燕麦主要用作饲料,虽然其产量呈逐年增加趋势,但在食品行业中的应用较少。世界大约73%的燕麦作为家畜的饲料和饲草,12%的燕麦加工成营养食品,15%的燕麦作为种子和其他工业用途[2]。其中12%的燕麦加工产品随着燕麦资源的深入开发呈现多样化,其产品包括燕麦米、燕麦粉、燕麦片、燕麦饮料、燕麦醋、燕麦啤酒、燕麦多肽、燕麦蛋白粉、燕麦方便面和燕麦面包等[3]。
β-葡聚糖是谷物胚乳和糊粉层细胞壁的一种水溶性膳食纤维,是由D-葡萄糖以连续的β-(1→4)糖苷键和单个的β-(1→3)糖苷键连接而成的线性多糖[4],具有降低胆固醇、降低血糖、调节免疫、降低肠癌风险等特殊生理功能的营养成分[5-7],其主要存在于大麦和燕麦中,燕麦中β-葡聚糖主要存在于燕麦外层部分,即燕麦加工的副产品——燕麦麸[8]。燕麦麸中β-葡聚糖含量为5%~13%,略高于其他谷物中β-葡聚糖的含量,从燕麦麸中提取β-葡聚糖,一方面可提高燕麦资源的利用率,另一方面可获得具有特殊生理功能的高含量的β-葡聚糖。以燕麦麸为原料提取β-葡聚糖可实现燕麦资源的高值化利用,带动其他产业发展,提高经济效益[9-11]。因此,开展燕麦麸皮中β-葡聚糖的提取研究具有十分重要的意义。
目前,β-葡聚糖的提取方法有物理法、化学法和生物法。物理法包括超声提取法、微波提取法、超高压提取法等。化学法包括溶剂提取法、碱提法、酸提法等。生物法主要为酶法提取。这些方法因只采用1种方式或方法来提取,其提取率较低。随着联合提取技术的发展,物理与物理、物理与化学、物理与生物等提取方法相结合的方式越来越受到人们的关注。即采用溶剂与超声辅助提取、溶剂与微波辅助提取、碱与超高压辅助提取等联合的提取方式可克服传统提取方法提取率低、耗时长等缺点,从实现联合协同作用的角度提高待分离产物的提取率。王冲[12]等采用超高压与超声波结合的方式提取藜麦中β-葡聚糖,相比于单独提取,超声法提取率为1.16%,超高压法提取率为1.34%,超高压联合超声波提取法其提取率可高达到1.66%。联合提取具有提取率高、节省时间、节约能源等特点。单一的超声提取法是利用空化效应分离物质的物理法[13-15],单一的酶提法是利用酶的特异性使杂质分解去除的生物法。而研究超声与酶法结合的提取法较少,采用超声联合酶法提取燕麦麸皮中的β-葡聚糖能够从空化效应和酶解协同作用2个方面,实现β-葡聚糖的高效提取。因此,采用超声波联合生物酶法提取燕麦麸皮中的β-葡聚糖,通过单因素及正交试验探究超声波联合酶法提取燕麦麸皮中β-葡聚糖的最佳提取工艺,以提高β-葡聚糖的提取率,以期为燕麦资源的开发利用提供参考。
1 材料与方法
1.1 材料
燕麦麸皮:甘肃省白银市会宁县大沟镇生产;耐热α-淀粉酶、刚果红溶液、β-葡聚糖标准品:(≥95%,HPLC级,sigma公司);95%乙醇、浓盐酸、磷酸钠缓冲液等均为分析纯。
仪器设备: FA2004N型电子天平,上海德兴仪器有限责任公司;B220型恒温水浴锅,上海亚荣生化仪器生产厂;759S紫外分光光度计,上海德兴科技仪器有限责任公司;HH-6数显恒温水浴锅,上海上登实验设备有限责任公司;PHS-3C型pH计,上海大普仪器有限公司;JP-100S型超声波机,深圳市洁盟设备有限公司;烧杯、量筒、容量瓶、锥形瓶、移液管等。
1.2 方法
1.2.1 超声波联合酶法提取燕麦麸皮β-葡聚糖 提取工艺流程:燕麦麸→粉碎过筛→水溶加热处理→超声波提取→离心分离→上清液→淀粉酶水解除淀粉→灭酶→去除蛋白质→离心分离→沉淀→干燥→β-葡聚糖操作要点:秤取10~12 g燕麦麸皮,过0.5 mm筛,按比例添加蒸馏水,混匀,经过水浴一定温度和时间加热后,经一定条件的超声处理,6 000 r/min离心20min后取上清液,采用高温耐热的α-淀粉酶水解淀粉,将溶液水溶加热温度调至95℃,pH调至6.5,加热30 min后水解去除提取液中的淀粉,之后选取高温灭酶法去除淀粉酶。在快速搅拌条件下,将溶液的pH通过质量分数为20%盐酸缓慢调节至4.5,6 000 r/min离心20 min通过等电沉淀法去除燕麦麸皮中的蛋白质,然后6 000 r/min离心20 min离心取上清液,加95%乙醇醇沉,在4℃温度下静止过夜12 h后,收集沉淀,冷冻干燥后得β-葡聚糖粗品。
1.2.2β-葡聚糖标准曲线的绘制β-葡聚糖标准溶液的配制:准确称取0.010 gβ-葡聚糖,加少量的去离子水,70℃水浴助溶,冷却至室温后定容至10 mL。冰箱贮存备用,使用前稀释10倍配成0.1 mg/mL的溶液。
刚果红溶液的配制:准确称取0.020 g刚果红溶解于0.1 mol/L、pH 8.0的磷酸缓冲液中,定容至200 mL。
标准曲线的制备:取6组10 mL的比色管,除0号为1支外,其余均为3支平行管。每组分别加入0 mg/mL、0.2 mg/mL、0.4 mg/mL、0.6 mg/mL、0.8 mg/mL和1.0 mg/mLβ-葡聚糖标准溶液后,用去离子水补足至2.0 mL,再在以上各试管中分别加入4.0 mL刚果红溶液,摇匀使其在一定条件下充分反应后测定吸光值并绘制标准曲线。吸光度与β-葡聚糖含量的相关性方程为y=0.003 3x+0.020 8,相关系数为0.995 7,表现出良好的相关性。
1.2.3β-葡聚糖含量测定及得率计算 刚果红法测定β-葡聚糖具有操作简单、容易等特点[16-17],故选择刚果红分光光度法测定β-葡聚糖。将冻干的β-葡聚糖复溶于50 mL蒸馏水中,取5 mLβ-葡聚糖水溶液,定容于50 mL容量瓶中,量取样液1 mL,用蒸馏水稀释10倍,量取上述稀释样液0.2 mL,加蒸馏水1 mL,加入刚果红溶液2.0 mL,20℃准确反应10 min,以蒸馏水作空白对照,在545 nm的可见光波长的条件下,测定样品的吸光度值A。由标准曲线计算出样液中β-葡聚糖含量,并计算β-葡聚糖的提取率。
β-葡聚糖的提取率=(m/M)×100%
式中,m为测定的燕麦麸皮中β-葡聚糖的质量(g);M为燕麦麸皮质量(g)。
1.2.4 单因素试验 分别在不同料液比(g∶mL,下同)、温度、加热时间、超声波功率、超声波温度、超声时间、耐热ɑ-淀粉酶添加量和酶解时间的条件下提取燕麦麸皮中的β-葡聚糖,并检测其提取率,研究不同因素对β-葡聚糖提取率的影响。
1) 料液比。在料液比分别为1∶6、1∶8、1∶10、1∶12、1∶14,水溶加热温度75℃、水溶加热时间4 h、耐热α-淀粉酶的添加量1.5%、酶解时间30 min、超声功率400 W、超声波提取温度50℃、超声波提取时间30 min的条件下,进行提取。
2) 水溶温度。分别在水溶温度60℃、65℃、70℃、75℃和80℃,料液比1∶10、水溶加热时间4 h、耐热α-淀粉酶添加量1.5%、酶解时间30 min、超声功率400 W、超声波提取温度50℃、超声波提取时间30 min的条件下进行提取。
3) 水溶加热时间。分别在水溶加热时间1 h、2 h、3 h、4 h和5 h,料液比1∶10、水溶加热温度75℃、耐热α-淀粉酶添加量1.5%、酶解时间30 min、超声功率为400 W、超声波提取温度50℃、超声波提取时间30 min的条件下进行提取。
4) 耐热α-淀粉酶添加量。分别在耐热α-淀粉酶添加量0.5%、1%、1.5%、2%和2.5%,料液比1∶10、水溶加热温度75℃、水溶加热时间4 h、酶解时间30 min、超声功率400 W、超声波提取温度50℃、超声波提取时间30 min的条件下进行提取。
5) 耐热α-淀粉酶酶解时间。分别在耐热α-淀粉酶酶解时间10 min、20 min、30 min、40 min和50 min,料液比1∶10、水溶加热温度75℃、水溶加热时间4 h、耐热α-淀粉酶添加量1.5%、超声功率400 W、超声波提取温度50℃、超声波提取时间30 min的条件下进行提取。
6) 超声功率。分别在超声功率100 W、200 W、300 W、400 W和500 W,料液比1∶10、水溶加热温度75℃、水溶加热时间4 h、耐热α-淀粉酶添加量1.5%、淀粉酶酶解时间30 min、超声提取温度50℃、超声提取时间30 min的条件下进行提取。
7) 超声温度。分别在超声温度40℃、50℃、60℃、70℃和80℃,料液比1∶10、水溶加热温度75℃、水溶加热时间4 h、耐热α-淀粉酶添加量1.5%、淀粉酶酶解时间30 min、超声功率400 W、超声提取时间30 min的条件下进行提取。
8) 超声时间。分别在超声时间20 min、25 min、30 min、35 min和40 min,料液比1∶10、水溶加热温度75℃、水溶加热时间4 h、耐热α-淀粉酶添加量1.5%、淀粉酶酶解时间30 min、超声功率400 W、超声提取温度50℃的条件下进行提取。
1.2.5 正交试验 在单因素试验的基础上,选择4个影响较大的因素并各取3个水平,采用L9(34)正交试验对β-葡聚糖的提取工艺进行优化,其因素与水平见表1。
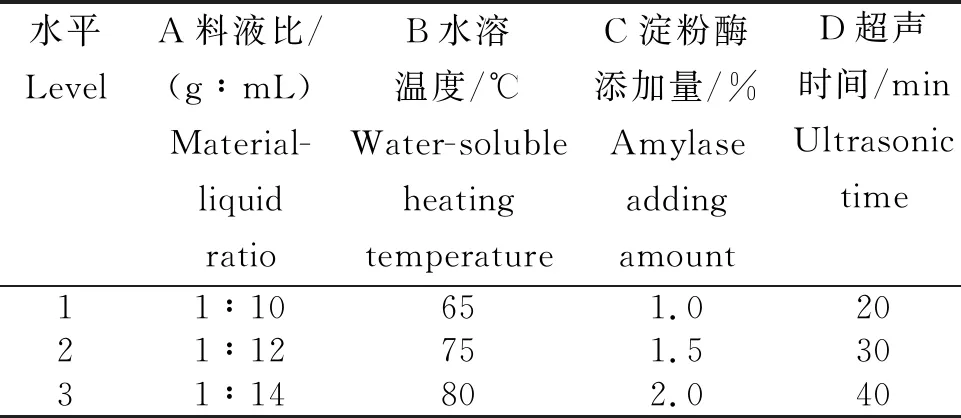
表1 超声波联合酶法提取燕麦麸皮β-葡聚糖的正交试验因素及水平
2 结果与分析
2.1 不同因素对燕麦麸皮β-葡聚糖提取率的影响
从图1可知,不同料液比、水溶温度、水溶加热时间、耐热ɑ-淀粉酶添加量、酶解时间、超声功率、超声温度和超声时间下燕麦麸皮β-葡聚糖提取率的变化。
2.1.1 料液比 随着料液比的增加,β-葡聚糖的提取率逐渐增加,当料液比为1∶10时,提取率最高,之后随着溶剂的增加提取率降低,这是由于β-葡聚糖溶出并溶解于水的溶解度是一定的,提取率达到最大值。而进一步提高料液比,会导致多糖分子的析出。因此料液比为1∶10时较好。
2.1.2 水溶温度 随着水溶温度的升高,β-葡聚糖的提取率逐渐增加,当温度达75℃时,提取率最高,之后随着温度的升高提取率降低,这可能是由于水溶液的温度升高,导致分子粘度减小,提取率降低。在一定的温度范围内分子运动加快,β-葡聚糖溶出完全,因此温度以75℃为宜。
2.1.3 水溶加热时间 随着加热时间的延长,β-葡聚糖的提取率逐渐增加,当加热时间为4 h时,提取率最高,之后随时间的延长提取率降低。这是由于β-葡聚糖溶出并溶解于水中需要一定的时间,而当物料中的β-葡聚糖和水中β-葡聚糖含量达到该条件下的平衡状态后,提取率达最大值,进一步延长水提时间会导致多糖分子的降解,从而使β-葡聚糖提取率降低[18]。因此选择水溶加热时间4 h为宜。
2.1.4 耐热α-淀粉酶添加量 随着淀粉酶添加量的增加,β-葡聚糖的提取率逐渐增大,当淀粉酶添加量为1.5%时提取率最高,之后随着淀粉酶添加量的增加提取率降低,这是由于在一定浓度时,酶促反应达到反应平衡,酶催化的效率最高,提取率最大,之后酶逐渐失活,催化效率逐渐降低,提取率降低。因此淀粉酶添加量以1.5%为宜。
2.1.5 酶解时间 随着淀粉酶酶解时间的延长,β-葡聚糖的提取率逐渐提高,当到淀粉酶酶解时间为30 min时,提取率最高,之后随酶解时间的延长提取率降低,这是因为当酶量一定时,酶解时间越长,酶解越充分,α-淀粉酶逐渐失活。因此,在提取过程中淀粉酶酶解时间以30 min为宜。
2.1.6 超声功率 随着超声功率的升高,β-葡聚糖的提取率逐渐升高,这是由于超声功率较小时,超声波的空化作用随着功率的加大而增强,有利于原料组织破碎。超声功率的增加加速了溶液的水循环,使得β-葡聚糖更容易溶出和扩散到溶液中。当超声功率为400 W时,提取率最高。之后随着功率的增加提取率又逐渐降低,这是由于当超声波功率过大时,燕麦麸皮中的非糖类杂质溶出和β-葡聚糖的降解程度变大,使其得率降低[19]。因此在提取过程中超声功率以400 W为宜。
2.1.7 超声温度 随着超声温度的升高,β-葡聚糖的提取率逐渐升高,当超声波提取温度为50℃,提取率最高,之后随着温度升高提取率降低,这可能是由于温度升高后β-葡聚糖的降解程度加大,导致β-葡聚糖得率下降,因此在提取过程中选择超声波温度为50℃最为适宜。
2.1.8 超声时间 随着超声时间的延长,β-葡聚糖的提取率逐渐升高,当超声波时间为30 min时,提取率最高,之后随着超声时间的延长提取率降低,这是因为在一定的超声时间内,超声时间的延长使溶液的振动时间延长,有利于β-葡聚糖的溶出。但超声时间过长会增大超声波作用强度,使β-葡聚糖的降解程度加大,导致β-葡聚糖得率下降[20]。因此在提取过程中超声时间以30 min为适宜。
2.2 β-葡聚糖最佳提取工艺条件的确定
从表2可知,不同因素对燕麦麸皮β-葡聚糖提取率的影响依次为水溶温度(B)>淀粉酶添加量(C)>超声提取时间(D)>料液比(A)。由极差的直观分析得到最优的工艺条件为A1B2C2D2,即料液比为1∶10、水溶温度75℃、淀粉酶添加量1.5%、超声时间为30 min,在该条件下燕麦麸皮中β-葡聚糖的提取率为5.09%。
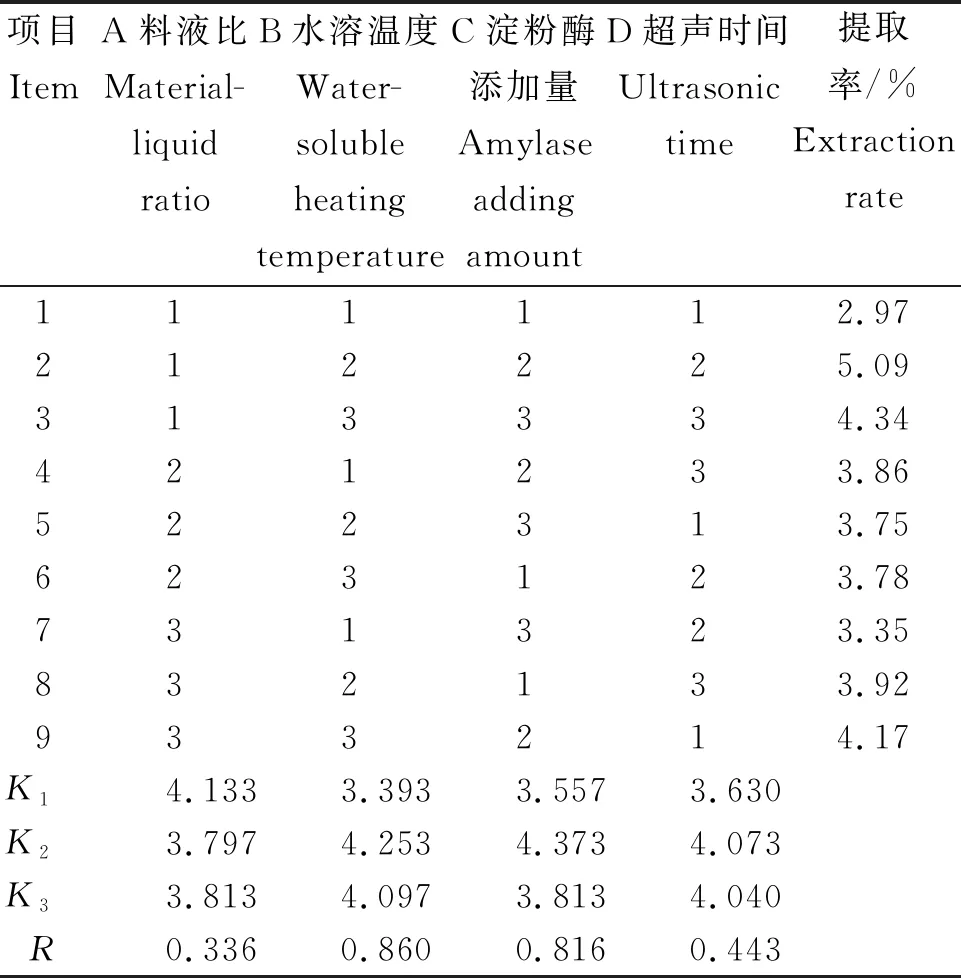
表2 超声波联合酶法提取燕麦麸皮β-葡聚糖的正交试验结果
3 结论
研究结果表明,超声波联合酶法提取燕麦麸β-葡聚糖的最佳工艺条件为料液比1∶10、水溶加热温度75℃、水溶加热时间4 h、耐热α-淀粉酶含量1.5%、淀粉酶酶解时间30 min、超声温度50℃、超声功率400 W、超声波时间30 min,在该工艺条件下,β-葡聚糖的提取率为5.09%。
