贵州不同海拔地区光叶紫花苕DNA甲基化多态性分析
2020-12-29王子苑舒健虹王小利尚以顺
王子苑, 舒健虹, 王小利, 尚以顺
(贵州省农业科学院 草业研究所, 贵州 贵阳 550006)
光叶紫花苕(ViciavillosaRothvar.glabresensKoch)又名光叶紫花苕子、稀毛苕子等,为越年生或一年生双子叶植物纲豆科巢菜属植物,其具有适应性广、生物量大、耐寒、耐旱、耐贫瘠等特点。我国于20世纪40年代引入江苏,而后在河南、山东、安徽、湖北、云南、四川、贵州、新疆等省市推广栽培。光叶紫花苕作为豆科绿肥,有特殊的生物固氮能力,能增加土壤肥力,在贫瘠土地上连续种植2~3季,土壤肥力能得到明显提升[1]。同时,光叶紫花苕适口性好,柔嫩多汁,蛋白质含量高,碳水化合物、维生素和矿物质含量丰富,是冬春季节畜禽主要的青绿饲草来源。徐然等[2]分析表明,初花期光叶紫花苕干物质含量28.08%,粗蛋白含量25.01%,中性洗涤纤维含量为43.1%,酸性洗涤纤维含量为30.8%。目前,关于光叶紫花苕研究主要集中在栽培管理技术[3-6]、种质资源评价[7-8]和饲料利用[9-10]等方面,而在分子生物学层面对光叶紫花苕遗传多样性的研究甚少。
DNA甲基化是表观遗传修饰的主要方式之一,能对生物体内或外界环境的刺激作出响应,在不改变DNA一级结构前提下参与基因的表达调控,从而影响生物体的表型可塑性和环境适应性[11],在植物生长发育过程中起重要作用。施江等[12]研究表明,遮荫显著诱导半夏基因组甲基化水平的提升;SHELDON等[13]研究发现,拟南芥在开花过程中由于DNA甲基化水平的降低,导致开花基因表达下调而延迟开花;陈家慧等[14]对不同甘蔗品种DNA甲基化水平分析发现,DNA甲基化在甘蔗生长过程中(伸长期和成熟期)频繁发生,并且不同品种之间甲基化模式也存在差异。笔者等利用甲基化敏感扩增多态性(Methylation Sensitive Amplification Polymorphism,MSAP)技术,对贵州境内海拔差异较大的2个地区光叶紫花苕种子进行基因组甲基化多态性检测,旨在研究不同海拔高度对其DNA甲基化水平的影响,为光叶紫花苕在环境适应性方面的表观遗传机制研究奠定基础。
1 材料与方法
1.1 试验材料
供试的光叶紫花苕种子2020年5月18日分别采集于贵州省大方县和兴义市市。大方县海拔1 256 m,E105°42′54″,N27°3′21″;兴义市海拔1 523 m,E104°47′36″,N25°7′29″。
1.2 基因组DNA提取与MSAP分析
采用改良CTAB法[15]对光叶紫花苕种子进行基因组DNA提取,MSAP分析参照王子苑等[16]的方法实施。试验所用接头和引物序列信息见表1。

表1 接头和引物序列
1.3 数据处理
PCR扩增产物的电泳位置在凝胶的某个相同迁移率位置上有DNA条带记为1,无DNA条带记为0,获得01矩阵,最终得到24对引物的01数据并进行甲基化分析。
2 结果与分析
2.1 DNA提取
琼脂糖电泳检测提取的基因组DNA(图1)主带清晰,基本没有降解,可以进行后续试验。
2.2 预扩增电泳检测
所提取DNA通过1.0%琼脂糖凝胶电泳检测表明(图2),预扩产物符合MSAP选扩模板要求。
2.3 不同海拔地区光叶紫花苕甲基化分析
根据2种同裂酶HpaⅡ (H)和MspⅠ(M)识别CCGG序列上甲基化胞嘧啶的敏感性不同,将其与内切酶EcoRⅠ(E)组合对基因组DNA进行双酶切,酶切后的MSAP带型分为4类。 Ⅱ 类是非甲基化位点,E+H和E+M都有带,说明CCGG位点未发生甲基化; Ⅱ 类是半甲基化位点,E+H有带,E+M无带,说明位点发生单链DNA外甲基化; Ⅲ类是全甲基化位点,E+H无带,E+M有带,说明位点发生双链DNA内甲基化; Ⅳ类是超甲基化位点,E+H和E+M无带,不计入甲基化范围。
利用随机的24对选择性扩增引物对酶切后的光叶紫花苕样本进行扩增,共扩增产生1 832个位点,部分MSAP扩增图谱见图3。根据光叶紫花苕MSAP条带类型分析结果(表2),在所有扩增位点中检测出总甲基化位点大方为1 304个,兴义为1 240个,总甲基化率分别为84.90%和80.73%。其中全甲基化条带数分别为403条和393条,全甲基化率分别为67.32%和65.23%。半甲基化条带数分别为270条和238条,半甲基化率为17.58%和15.49%。表明,大方地区光叶紫花苕DNA甲基化水平较高,且不同类型的条带总数为Ⅳ> Ⅲ> Ⅱ >Ⅰ,说明不同海拔地区的甲基化均以内侧胞嘧啶双链甲基化为主。
2.4 不同海拔地区光叶紫花苕甲基化模式变化
按照引物在酶切扩增泳道上是否扩增出条带,将甲基化模式分为A、B、C、D 4大类,即,有扩增带计为“1”,无扩增带计为“0”。如表3所示,A类包含3个亚类,为甲基化位点无变化。兴义与大方光叶紫花苕相比,未发生甲基化变化的位点占总甲基化扩增位点数的9.90%;B类包含5个亚类,表现为甲基化程度降低,即去甲基化,兴义与大方相比有42.58%的位点发生了去甲基化;C类包含5个亚类,表现为甲基化程度升高,兴义与大方相比,44.73%的位点发生了甲基化;此外,还有一种较为复杂的“未知模式”将其归为D类,变化率不超过总甲基化扩增位点的3%。说明,与兴义地区的光叶紫花苕相比,大方地区去甲基化模式和甲基化模式并存,但以甲基化模式变化为主。

表2 不同海拔地区光叶紫花苕MSAP条带类型
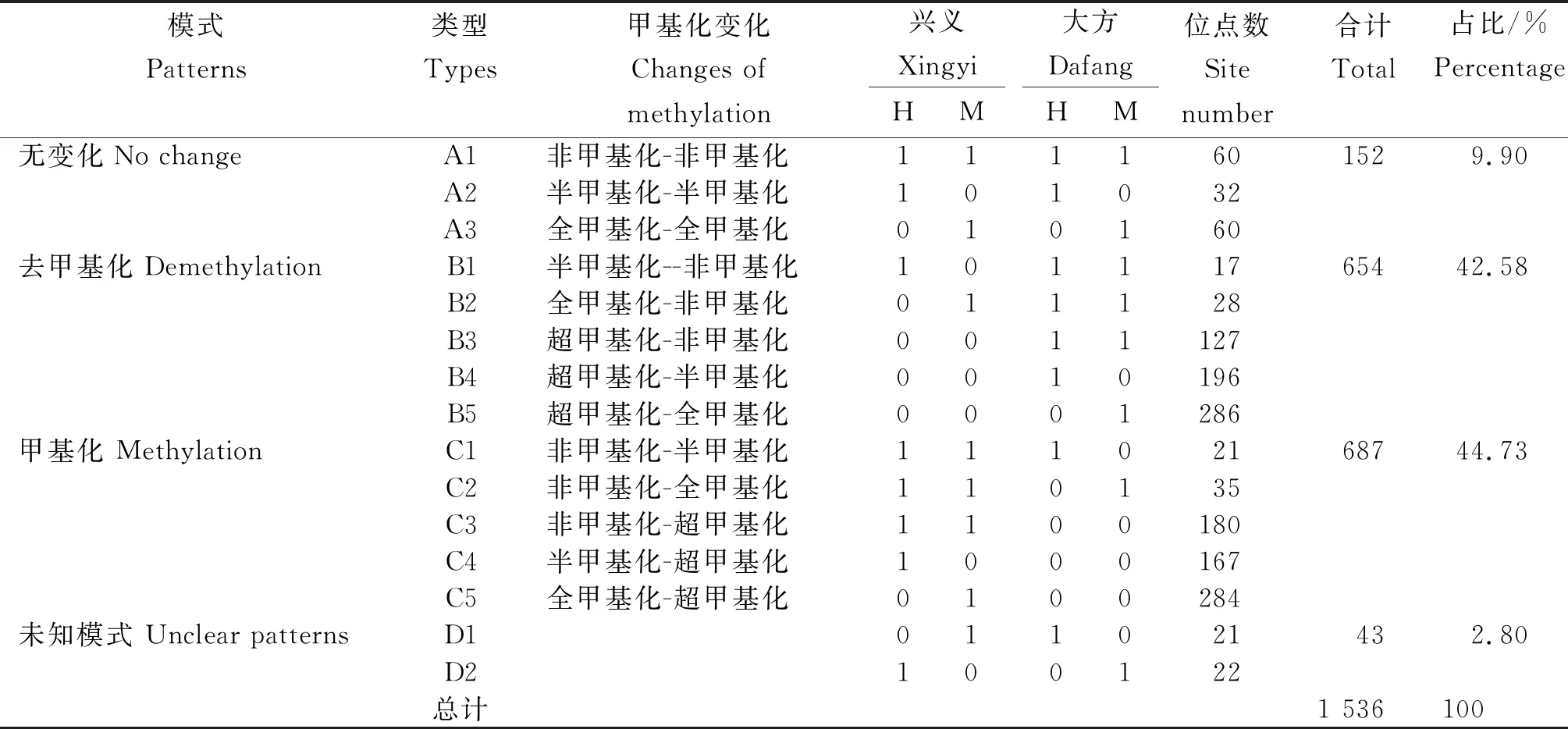
表3 不同海拔地区光叶紫花苕DNA甲基化模式
3 结论与讨论
DNA甲基化是一种重要的表观遗传机制,不仅提供了基因表达的开关,而且一旦形成稳定的表型可以延续若干个世代[17-18],BOYKO等[19]认为这种表观遗传改变可能引起胁迫诱导的基因进化。在众多甲基化类型中,5-甲基胞嘧啶是真核生物体中最重要的一种甲基化存在形式,通过将S-腺苷甲硫氨酸提供的甲基在DNA甲基转移酶的催化下,转移到脱氧胞嘧啶上形成5-甲基胞嘧啶[20]。简单地说,DNA甲基化是一种在DNA序列的胞嘧啶核苷酸的特定位置上共价加减甲基基团的一种基因修饰方式[21]。根据检测目的不同,DNA甲基化检测技术可分为基因组整体甲基化水平检测和特定位点甲基化检测,前者的典型检测方法有高效液相色谱(HPLC)、毛细管电泳(CE)等[22],研究表明,采用的MSAP技术能特定识别CCGG位点,具有操作简便、灵敏度高、成本低等优点,在植物DNA甲基化检测中较为广泛地应用。
环境温度的改变是影响植株生长发育和新陈代谢的重要因素之一。研究发现,藜麦叶片的叶绿素、可溶性蛋白以及抗坏血酸过氧化酶(APX)含量随海拔的升高而降低,而超氧化物歧化酶(SOD)、过氧化氢酶(CAT)等抗氧化酶活性与海拔高度负相关,说明高海拔条件下太阳辐射强度增大,温度降低,藜麦植株为了能正常生长发育对高海拔胁迫作出了相应的生理响应[23]。STEWARD等[24]研究玉米幼苗在冷应激(4℃)条件下的甲基化变化发现,其根部组织的基因组发生了低甲基化,并且只有在冷应激条件下转录的ZmMI1基因也发生了去甲基化,即便是经过7 d恢复,低甲基化水平也没有恢复到正常水平。王芳等[25]研究表明,超低温保存导致马铃薯基因组DNA发生了甲基化现象,其中以去甲基化变化为主。通常来说,DNA发生甲基化与基因的沉默有关,而DNA发生去甲基化会开启基因表达。本研究采集来自不同海拔高度的光叶紫花苕样本,对甲基化分析后发现,海拔较低的大方地区总甲基化率和半甲基化率分别低于高海拔兴义地区4.17%和2.09%,说明低海拔地区DNA发生去甲基化现象高,与前人研究结果类似[26-27],这种变化趋势可能是植物通过改变甲基化水平和模式来调控环境应答基因网络,并且这种甲基化的改变能延续给后代,从而增强当代或者后代的环境适应性。
