肝癌干细胞抗原致敏的DC-CTL 对肝癌的抑制作用探讨
2020-12-29黄岚
黄岚
(武汉平安好医医学检验实验室 湖北 武汉 430000)
在中国,原发性肝细胞癌的发生率较高。其特点为容易转移、复发、发病隐匿、预后差等等。相关文献指出[1],癌瘤的发生发展和疾病耐药、复发、转移主要因素为病患体内有癌瘤干细胞(CSCs)。虽然说这种细胞数目极少,但难以全面消灭。结合实际情况,本文全面探究肝癌细胞抗原致敏DC-CTL 针对于肝癌抑制作用情况,现将具体结果报告如下。
1.资料与方法
1.1 试验主要试剂以及仪器设备
实验使用人AB 血清(Gibco 公司生产)、DMEM 细胞培养基、GTT-551、细胞因子白细胞介素、肿瘤坏死因子(美国Peprotech公司生产)、抗人CD3 单克隆抗体、CD8 单克隆抗体、CD133-PE(美国BD 公司生产)、流式细胞仪(美国贝克曼公司生产)、自动化磁性细胞设备(德国Miltenyi 公司生产)、磁性细胞分选设备、BABL/c 实验小鼠30 只(由上海斯莱克动物实验有限公司提供),动物周龄为4.0 ~5.0 周,体重为18.0 ~20.0g。
1.2 实验方法
实施CSCs 分选工作。取用经诊断明确为肝细胞癌者的肝脏组织,样本来源以及时间为2018 年1 月—5 月来我院就诊的50例肝癌疾病患者。利用0.9%氯化钠溶液加入剂量为100U/ml 庆大霉素完成清洗。针对于组织切块处理。在此其中加入胰蛋白酶液体。将其放到孵化箱中完成孵化。消化,时间为4h。过滤。制备成单细胞悬液。加入0.9%氯化钠溶液离心处理。使用高糖培养基加入AB 血清,将其接种到孔板内。就此完成了细胞分选工作,就此制备出了单细胞悬液。其能够和CD133 抗体磁珠实现交联,在此之后分选。收集好相关细胞,制备成为单细胞悬液,等待使用。使用相关设备对CSCs 开展测定工作。取得CSCs 和肝癌细胞抗原。有效培养CSCs 以及肝癌细胞抗原致敏的DC-CTL。将30 只小鼠分为CSCs 抗原致敏小组、肝癌细胞抗原致敏组以及0.9%氯化钠溶液组。每组10 只。分析结果。
1.3 观察指标
抑瘤率=(对照组肿瘤重量均值-实验组肿瘤质量均值)/对照组肿瘤重量均值×100.00%。
1.4 统计学方法
本实验使用SPSS20.0 专业统计学软件,对数据内的相关数据进行t检验以及单因素方差分析。当P<0.05为差异有统计学意义。
2.结果
2.1 抗原致敏DC-CTL 针对于实验裸鼠肝癌抑制效果
和0.9%氯化钠溶液组相较而言,CSCs 抗原致敏小组以及肝癌细胞抗原致敏组针对于肿瘤抑制效用显著。CSCs 抗原致敏小组癌瘤抑制率比肝癌细胞抗原致敏组高,P<0.05,详细见表1。
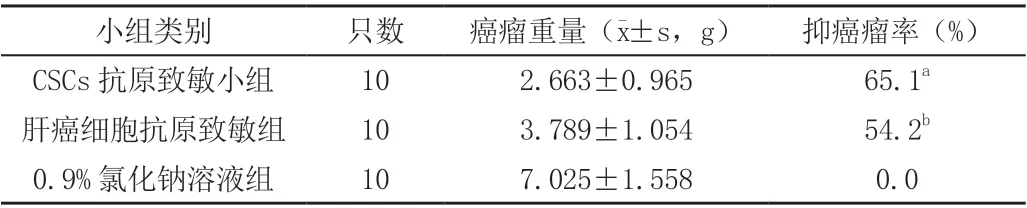
表1 抗原致敏DC-CTL 针对于实验裸鼠肝癌抑制效果
2.2 抗原致敏DC 培养情况
当DC 培养到9d 时,于显微镜下完成观察。DC 表现为贴壁生长,且呈现为圆形。外表存在树突状表现,使用相关设备,对于DC 表面标记物情况进行测定,用于表明该物质为成熟的化树突状细胞。
2.3 流式细胞设备测定CSCs
经检测,CD133 表达率为85%。证明分选成功。
2.4 CIK 培养工作
在开展扩增以前,实验样本的CD3+/CD8+水平具体为48.0%。当诱导扩增到9d 时,CIK 内的CD3+/CD8+达85.0%。细胞数目随着诱导时间增加呈现出扩增势态。
3.讨论
在机体对抗肿瘤机制中,细胞免疫必不可少。细胞免疫为T细胞介导下,细胞免疫中的CD3+/CD8+T 细胞[2]。发挥识别以及消除癌瘤细胞效用。而DC 则为机体中能力最高的是抗原递呈细胞,这种细胞可以体现出激活T 细胞的作用。利用此法针对具有抗原特异性的CTL 加以诱导处理,在这种情况下,机体拥有了抗肿瘤的免疫能力。在对抗原进行致敏处理之后,DC 细胞增殖活性和与抗原识别能力均有所增加[3]。和CTL 一并培养之后,细胞间相互作用能够推进上述两者增殖成熟,可令CTL 抗瘤效用增加,加大输注细胞与共刺激分子呈递抗原特异性,加速树突细胞分泌IL-2 水平量。CD133 属于CSCs 的经典式标记物质。本文中,利用科学有效的方式筛选出了人CSCs,成功获取抗原物质。并在病患外周血中对单体核细胞完成了分离、扩增和诱导,形成CSCs 抗原致敏DC 和CIK[4]。同时把CSCs 看做是靶标。经开展MTT实验的方式,有效观察自身靶向性,有效消除CSCs[5]。在CIL 内含有高水平CTL。
本次实验研究结果证实:DC-CTL 针对于肝脏恶性肿瘤细胞能够发挥出杀伤效用,CSCs 抗原致敏CSCs 清除治疗,意义重大。
