小麦光腥黑粉菌转化子最适固体培养基的筛选
2020-12-28李丹丹何婷王梦可
李丹丹 何婷 王梦可


摘要 为了筛选小麦光腥黑粉菌转化子最适培养基,以提高小麦光腥黑粉菌转化子生长速度,选取了3个菌落形态不同的转化子(ZHZ-1, ZHZ-2, ZHZ-3)进行培养试验。用6 mm打孔器打取菌饼,将菌饼置于9种培养基上16℃避光培养。观察、测量小麦光腥黑粉菌转化子的菌丝生长情况、菌落直径等主要指标,结果表明,9种培养基中,3种转化子都是在完全培养基(complete medium,CM)上生长状况最好,菌丝生长速度最快。ZHZ-1转化子在CM培养基上菌落圆形,有褶皱,产生大量白色菌丝,生长速度快。ZHZ-2转化子菌落圆形,产生大量白色菌丝,生长速度快。ZHZ-3转化子菌落云纹状,有褶皱,产生大量白色菌丝,生长速度快。
关键词 小麦光腥黑粉菌; 转化子; 菌落直径; 培养基
中图分类号: S 435.121.4
文献标识码: A
DOI: 10.16688/j.zwbh.2019444
Abstract In order to screen the optimum medium for transformants of Tilletia foetida, to increase the growth rate of transformants of T.foetida, three transformants with different colony morphology, namely ZHZ-1, ZHZ-2 and ZHZ-3, were selected for culture experiment. The 6 mm colony was obtained with a puncher, and was cultured on nine kinds of media at 16℃in the dark. The mycelial growth of the transformants was determined with the colony diameter as the main indicator. The results showed that the three transformants have better mycelium growth rate on complete medium (complete medium, CM) than on the other eight media. Growth pattern of ZHZ-1 transformant on CM medium was as follows: the colony is round and wrinkled, producing a large number of white hyphae, and ZHZ-1 grows fast. The colony of ZHZ-2 transformant is round, producing a large number of white hyphae, and ZHZ-2 grows fast. The ZHZ-3 transformant colonies are irregular, cloud-like and wrinkled, producing a large number of white hyphae, and ZHZ-3 grows fast.
Key words Tilletia foetida; transformant; colony diameter; medium
小麦光腥黑粉菌Tilletia foetida(Wall.)Liro.引起的小麦光腥黑穗病 (common bunt of wheat)是一种全球性、毁灭性的麦类病害[1]。该病害危害严重、分布广泛、流行性强,对小麦的安全生产有破坏性的影响[2-4]。受T.foetida侵染的小麥,在抽穗之前无明显的症状,在小麦生长后期,颖壳向外张开,感病麦粒小且硬,里面充满黑粉状的厚垣孢子,感染T.foetida的小麦麦粒散发臭鱼腥味,并且释放出有毒的三甲胺类物质[5-6]。小麦品质降低,产量遭受巨大损失[7-9]。
在南非、美洲和阿富汗等小麦产区,小麦光腥黑穗病的发生对小麦品质造成严重影响[10-11]。20世纪50年代初,小麦光腥黑穗病在我国各地都有发生,主要集中在华北和西南部分冬小麦产区,西北和东北地区的春小麦区域[12-13]。小麦光腥黑粉菌属于担子菌门Basidiomycotina,冬孢菌纲Teliomycetes,黑粉菌目Ustilaginales,腥黑粉菌科Tilletiaceae,腥黑粉菌属Tilletia[14]。T.foetida的冬孢子呈褐色,球形或近球形,在土壤中能够存活多年,一旦条件适宜并遇到大面积的适宜寄主,便会引起发病[15]。国内外主要集中研究小麦光腥黑穗病的病原菌检测[16-19],对其致病机制研究较少,该菌自身特性限制了对该菌的研究。
本实验室前期已获得58个小麦光腥黑粉菌转化子,但是由于该菌自身的特性,菌丝生长速度较慢,不利于后续研究。本文随机挑选3个不同形态的转化子ZHZ-1, ZHZ-2, ZHZ-3(图1),分别在9种不同培养基上培养,以筛选出最适合转化子生长的培养基。
1 材料与方法
1.1 供试材料
本研究采用植物病虫害生物学国家重点实验室植物保护研究所保存的小麦光腥黑粉菌3个转化子ZHZ-1, ZHZ-2, ZHZ-3,均为前期通过农杆菌介导的遗传转化(Agrobacterium tumefaciens-mediated transformation,ATMT)获得的小麦光腥黑粉菌转化子。
固体培养基:水琼脂(water agar, WA),琼脂20 g,加蒸馏水定容至1 000 mL。察氏培养基(Czapek-Dox medium, CDA),NaNO3 3 g,K2HPO4 1 g,MgSO4·7H2O 0.5 g,KCl 0.5 g,FeSO40.01 g,蔗糖30 g,琼脂20 g,加蒸馏水定容至1 000 mL。麦芽糖琼脂培养基(malt extract agar, MEA),麦芽浸膏30 g,大豆蛋白胨3 g,琼脂15 g,加蒸馏水定容至1 000 mL。马铃薯葡萄糖琼脂培养基(potato dextrose agar, PDA),马铃薯200 g,葡萄糖20 g,琼脂20 g,加蒸馏水定容至1 000 mL。玉米粉琼脂培养基(corn meal agar, CMA),玉米粉30 g,琼脂15 g,加蒸馏水定容至1 000 mL。基本培养基(minimal medium, MM),NH4NO3 1.0 g,KH2PO4 0.5 g,Na2HPO4 1.5 g,NaCl 1.0 g,MgSO4·7H2O 0.2 g,加蒸馏水定容至1 000 mL。YEPSA培养基,酵母提取物10 g,胰蛋白胨4 g,蔗糖4 g,琼脂20 g,加蒸馏水定容至1 000 mL。综合马铃薯葡萄糖琼脂培养基(comprehensive potato glucose agar medium, CPDA),马铃薯200 g,葡萄糖20 g,KH2PO4 5.0 g,MgSO4 ·7H2O 3.0 g,VB1 0.1 g,加蒸馏水定容至1 000 mL。完全培养基(complete medium,CM),酵母浸粉1 g,酶水解干酪素0.5 g, 酸水解干酪素0.5 g,葡萄糖10 g,Ca(NO3)2·4H2O 1 g,KH2PO40.2 g,MgSO4·7H2O 0.25 g,NaCl 0.15 g,琼脂18 g,加蒸馏水定容至1 000 mL。以上培养基均在121℃高压灭菌30 min。
1.2 试验方法
转化子培养6个月后,将3种转化子菌种用6 mm的打孔器打取菌饼,将菌饼放到9种不同的固体培养基上,为了防止产生杂菌,并筛选出含有潮霉素抗性的转化子,培养基中加入300 mg/mL青霉素-链霉素双抗和100 μg/mL潮霉素B,置于16℃培养箱中避光培养,每种培养基设置3个重复,每隔一天测量1次菌落直径,每5 d记录1次菌落生长情况。
2 结果与分析
2.1 3种转化子在CM培养基上培养6个月的菌落形态
由于转化子形态各异,所以3种转化子采用不同的转接方式,ZHZ-1用打取菌饼的方式转接,ZHZ-2,ZHZ-3采用划线的方式转接,3种转化子形态如图1所示。ZHZ-1转化子菌落圆形,菌落内层有褶皱,菌落分3层,内层白色,外层浅灰色,菌丝白色。ZHZ-2菌落圆形,菌丝白色,毛状。ZHZ-3菌落圆形,菌落外层有浅棕色晕圈,菌丝白色。
2.2 3种转化子在9种培养基上的生长情况
2.2.1 3种转化子在9种培养基上的长势
试验结果表明:不同培养基对转化子菌丝生物量有较大影响。3种转化子在9种培养基上的生长情况差异明显,但均在CM培养基上长势最好,菌丝生长速度最快。ZHZ-1转化子在WA、CDA、MEA、PDA、CMA和MM培养基上生长速度极慢,只长出少量菌丝,相比之下,在YEPSA、CPDA和CM培养基上生长速度较快。ZHZ-2转化子在WA、CDA培养基上生长出少量白色菌丝,但是,在MEA、PDA、CMA培养基上菌丝几乎不生长,在MM培养基上生长出少量稀疏的菌丝,与其他6种培养基相比,在YEPSA、CPDA、CM培养基上生长速度较快,菌落圆形,菌丝白色。ZHZ-3转化子在WA、CDA、MEA培养基上几乎不生长,且在CDA培养基上菌落呈褐色,在PDA、CMA、MM培养基上生长出少量白色菌丝,与其他两个转化子相同的是在YEPSA、CPDA、CM培养基上生长速度较快。3个转化子生长形态如图2a~c。
2.2.2 3种转化子在9种培养基上生长速度
以菌落直径为指标,明显看出3种转化子在9种培养基上生长速度差异很大,共同点为3种转化子在CM培养基上生长速度最快,明显快于其他8种培养基,ZHZ-1转化子在CMA上菌落直径没有增长。 ZHZ-2 转化子在WA、CDA、MEA、PDA、CMA、MM培养基上生长曲线较平滑,生长速度缓慢。ZHZ-3转化子在WA、CDA、MEA、PDA、CMA、MM培养基上生长30 d后,菌落直径相差不多(图3a~c)。
2.3 3种转化子在9种不同培养基上菌落性状
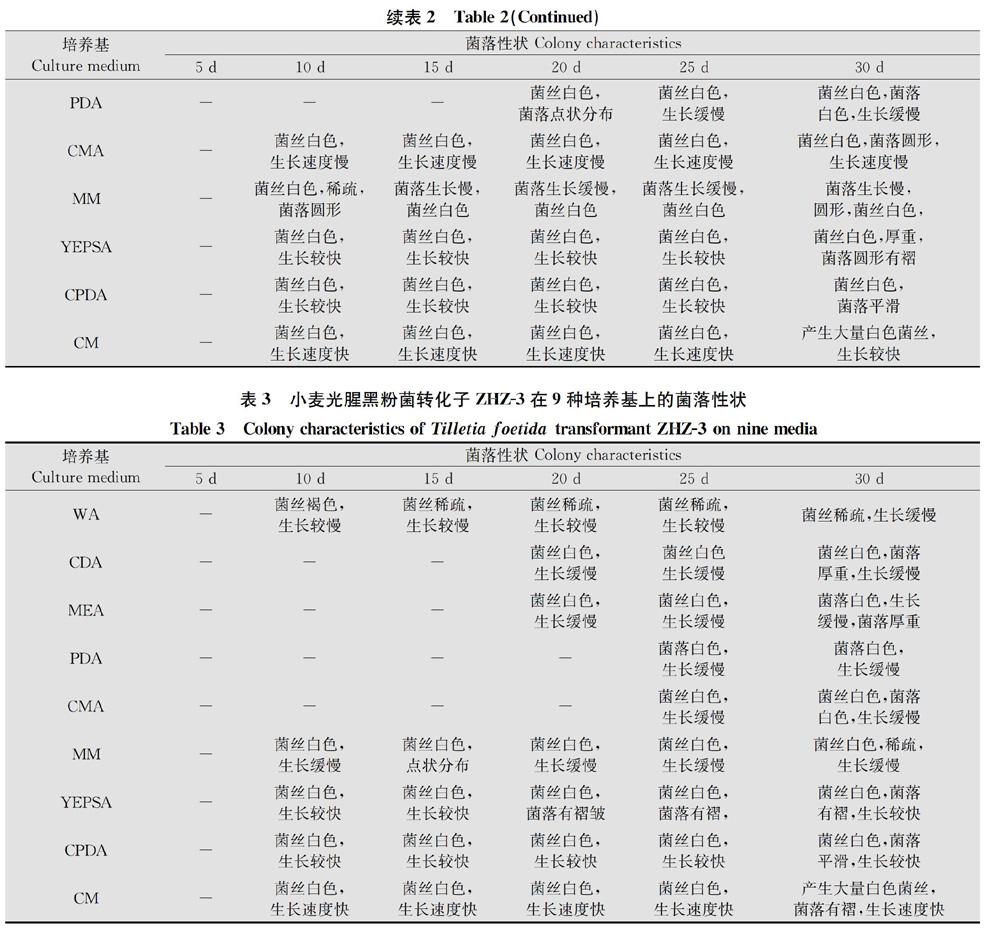
ZHZ-1在CDA培养基上生长15 d后菌落没有扩展,在MEA、PDA、CMA培养基上,ZHZ-1转化子生长30 d没有明显变化,与其他9种培养基相比,在CM培养基上生长速度最快(表1)。ZHZ-2在PDA培养基上15 d以后才出现明显的生长,在其他8种培养基上,5 d以后就出现明显的增长(表2)。ZHZ-3在PDA、CMA培养基上20 d后有明顯的增长,在CDA、MEA培养基上15 d有明显增长,在其他5种培养基上5 d后菌落直径开始扩大(表3)。
生长缓慢菌落生长缓慢菌落生长缓慢菌丝褐色,菌落褐色圆形,生长缓慢MEA-菌丝白色,生长缓慢菌丝白色,生长缓慢菌丝白色,生长缓慢菌丝白色,生长缓慢菌丝白色,生长速度慢
PDA---菌丝白色,菌落点状分布菌丝白色,生长缓慢菌丝白色,菌落白色,生长缓慢CMA-菌丝白色,生长速度慢菌丝白色,生长速度慢菌丝白色,生长速度慢菌丝白色,生长速度慢菌丝白色,菌落圆形,生长速度慢MM-菌丝白色,稀疏,菌落圆形菌落生长慢,菌丝白色菌落生长缓慢,菌丝白色菌落生长缓慢,菌丝白色菌落生长慢,圆形,菌丝白色,YEPSA-菌丝白色,生长较快菌丝白色,生长较快菌丝白色,生长较快菌丝白色,生长较快菌丝白色,厚重,菌落圆形有褶CPDA-菌丝白色,生长较快菌丝白色,生长较快菌丝白色,生长较快菌丝白色,生长较快菌丝白色,菌落平滑CM-菌丝白色,生长速度快菌丝白色,生长速度快菌丝白色,生长速度快菌丝白色,生长速度快产生大量白色菌丝,生长较快WA-菌丝褐色,生长较慢菌丝稀疏,生长较慢菌丝稀疏,生长较慢菌丝稀疏,生长较慢菌丝稀疏,生长缓慢CDA---菌丝白色,生长缓慢菌丝白色生长缓慢菌丝白色,菌落厚重,生长缓慢MEA---菌丝白色,生长缓慢菌丝白色,生长缓慢菌落白色,生长缓慢,菌落厚重PDA----菌落白色,生长缓慢菌落白色,生长缓慢CMA----菌丝白色,生长缓慢菌丝白色,菌落白色,生长缓慢MM-菌丝白色,生长缓慢菌丝白色,点状分布菌丝白色,生长缓慢菌丝白色,生长缓慢菌丝白色,稀疏,生长缓慢YEPSA-菌丝白色,生长较快菌丝白色,生长较快菌丝白色,菌落有褶皱菌丝白色,菌落有褶,菌丝白色,菌落有褶,生长较快CPDA-菌丝白色,生长较快菌丝白色,生长较快菌丝白色,生长较快菌丝白色,生长较快菌丝白色,菌落平滑,生长较快CM-菌丝白色,生长速度快菌丝白色,生长速度快菌丝白色,生长速度快菌丝白色,生长速度快产生大量白色菌丝,菌落有褶,生长速度快
3 讨论
研究表明,3种转化子在CM培养基上的生长速度明显高于在PDA上的生长速度,用不同培养基培养30 d,ZHZ-1在CM培养基上菌落直径增长了2.07 cm,在PDA培养基上直径增长了0.06 cm, ZHZ-2在CM培养基上菌落直径增长了3 cm,在PDA培养基上直径增长了0.2 cm。ZHZ-3在CM培养基上菌落直径增长了2.45 cm,在PDA培养基上直径增长了0.33 cm。
本试验研究了小麦光腥黑粉菌3种转化子在9种培养基上的培养性状和生长速度,结果表明,小麦光腥黑粉菌3种转化子在CM培养基上生长速度最快,菌丝生长较好。该培养基最适宜3个转化子的生长,且CM培养基成分价格便宜,来源广泛,容易获得,因而是较为理想的培养基,在扩大培养时可以考虑作为首选培养基,以获得高质量和高数量的小麦光腥黑粉菌转化子,为后续对该菌致病机制的研究奠定了坚实的基础。
参考文献
[1] 何春雨, 杜久元, 张礼军,等. 小麦腥黑穗病研究进展[J]. 麦类作物学报, 2012,32(3):589-593.
[2] 翟德绪. 认真防治小麦腥黑穗病[J]. 新农业,1991(1):21.
[3] ZHANG Min, CHEN Wanquan, LIU Dan, et al. Identification of a specific SCAR marker for detection of Tilletia foetida(Wall.) Liro. pathogen of wheat [J]. Russian Journal of Genetics, 2012, 48(6):663-666.
[4] 刘丹. 小麦光腥黑粉菌(Tilletia foetida)AFLP分析及其种的特异性SCAR标记的发掘[D].成都: 四川农业大学, 2005.
[5] MAMLUK O F, Bunts and smuts of wheat in North Africa and the Near East [J]. Euphytica, 1998, 100:45-50.
[6] MOURAD A M I, SALLAM A, BELAMKAR V, et al. Genetic architecture of common bunt resistance in winter wheat using genome-wide association study [J/OL]. BMC Plant Biology, 2018, 18:280. DOI:10.1186/s12870-018-1435-x.
[7] YONG P A. A new variety of Tilletia tritici in Monana [J]. Phytopathology, 1935, 25:40.
[8] 王海光,祝慧云,馬占鸿,等. 小麦矮腥黑穗病研究进展与展望[J]. 中国农业科技导报, 2005, 7(4): 21-28.
[9] 王永锋, 裴桂英, 马赛飞, 等. 如何识别小麦腥黑穗病和散黑穗病[J]. 河南农业,2001(5):18.
[10]DURAN R, FISCHER G W. The genus Tilletia [M]. USA:Washington State University Press, 1957:215-240.
[11]GOATES B J. HOFFMANN J A. Nuclear behavior during teliospores germination and sporidial development in Tilletia caries,T.foetida, and T.controversa [J]. Canadian Journal of Botany, 1987, 65(3):512-517.
[12]刘丹, 刘太国, 张敏, 等. 小麦光腥黑粉菌(Tilletia foetida)AFLP分析及其种的特异性SCAR 标记[D]. 成都:四川农业大学,2006.
[13]梁宏, 彭友良, 张国珍, 等. 腥黑粉菌属3种检疫性真菌rDNA-IGS区的扩增及其序列分析[J]. 植物病理学报,2006, 36(5):407-412.
[14]HOFFMANN J A. Bunt of wheat [J]. Plant Disease, 1982, 66(11):979-986.
[15]WIESE M V. Compendium of wheat diseases [J]. Soil Science, 1978, 126(3):190.
[16]WILLIAMS P C. Incidence of stinking smut (Tilletia spp.) on commercial wheat samples in northern Syria [J]. Rachis, 1983, 2:21.
[17]MULDER D. Plant diseases of economic importance in northern region, United Arab Republic [J]. FAO Plant Protection Bulletin, 1958, 7:1-5.
[18]陈万权, 刘建华. 小麦矮腥黑穗病菌(TCK)DNA多态性分析及其特异性SCAR标记的发掘[C]∥中国植物病理学会第六届青年学术研讨会. 沈阳, 2003.
[19]祝慧云. 小麦矮腥黑穗病在中国的适生区评估[D]. 北京: 中国农业大学, 2005.
(责任编辑:杨明丽)
