泰安樱桃根癌病致病菌分离及生物型鉴定魏艳丽 RYDERMaarten
2020-12-28李红梅
李红梅


摘要 由致病性土壤杆菌侵染引起的根癌病严重影响了樱桃树的生长。利用选择性培养基,以阿糖醇和赤藓糖醇作为不同碳源,从山东泰安食用樱桃根部瘤状组织和感病根际土壤中分离到土壤杆菌100余株,通过胡萝卜切片法和番茄茎部针刺接种法从中筛选到31株有致瘤活性的菌株。经16S rDNA和recA基因序列分析,结合生物型检测鉴定出96%以上的致病菌属原生物Ⅱ型(Agrobacterium rhizogenes),只有1株致病菌为原生物Ⅰ型(A.tumefaciens)。根据Ti质粒上致病相关基因保守序列设计3对引物,12株有致瘤活性菌株中11株PCR扩增到目的条带。经分子生物学测定和高压纸电泳检测,所有致病菌株的质粒均为胭脂碱型。建立了致病型土壤杆菌的分子生物学快速鉴定方法,为定向选择生防菌株提供基础。
关键词 樱桃; 根癌病; 致病菌; 生物型鉴定
中图分类号: S 436.62
文献标识码: A
DOI: 10.16688/j.zwbh.2020124
Abstract The crown gall disease caused by infection of the pathogenic Agrobacterium seriously affected the growth of cherry trees. More than 100 bacterial strains were isolated from the tumor tissues and rhizosphere soil of edible cherry trees in Taian, Shandong province, using selective media with arabinitol or erythritol as the carbon sources. Pathogenicity tests on carrot disks and tomato stems showed that 31 of the 40 strains were virulent. Based on the 16S rDNA and recA gene sequence analysis combined with identification of biovars, more than 96% of pathogenic bacteria were biovar Ⅱ (A.rhizogenes) and only one pathogenic bacteria was biovar I (A.tumefaciens). Three pairs of primers were designed based on the conserved sequences of disease-causing genes on the Ti plasmid, and the target bands were amplified from 11 of 12 virulent strains by PCR. All strains investigated harbored nopaline-type of Ti plasmid based on molecular biology and high voltage paper electrophoresis. A rapid molecular identification method for the pathogenic Agrobacterium was established, which can provide a basis for the selection of biocontrol strains.
Key words cherry tree; crown gall disease; pathogenic agrobacterium; biovar type
由致病性土壤桿菌Agrobacterium spp.侵染植物引起的根癌病,是严重的细菌性病害之一,其寄主范围达百余科上千种植物。在核果类、浆果类、坚果类果树和其他观赏植物中最易发生[1]。主要危害植物根茎、侧根和枝干部位,典型症状是在受害植株的根部、根茎处甚至茎上形成大小不一的瘤状组织使植株发育受阻,影响果树苗木的生长。
土壤杆菌Agrobacterium spp.,属于细菌域,细菌界,变形细菌门,α变形菌纲,根细菌目,根瘤菌科,土壤杆菌属;是革兰氏阴性细菌。对于它的分类,目前存在以致病性和以生理生化特性为依据的两种不同方案。现在普遍接受的是分为4个致病型种类和1个非致病型:原生物Ⅰ型根癌土壤杆菌A.tumefaciens、原生物Ⅱ型发根土壤杆菌A.rhizogenes、原生物Ⅲ型葡萄土壤杆菌A.vitis和悬钩子土壤杆菌A.rubi,以及非致病性的放射土壤杆菌A.radiobacter [2]。根据侵染植株形成肿瘤中冠瘿碱的种类,土壤杆菌又可分为章鱼碱型(octopine)、胭脂碱型(nopaline)、农杆碱型(agropine)、琥珀碱型或农杆菌素碱型(agrocinopine)等[3],其中以章鱼碱型和胭脂碱型最为常见。
目前国内外对土壤杆菌的致病机理[4]研究较多,对根癌病的防治以生物防治为主,并且已筛选到多株生防菌。生防菌株对病原菌携带的Ti质粒类型具有选择性,如菌株K84只选择性地抑制含胭脂碱型Ti质粒的原生物Ⅰ型和Ⅱ型土壤杆菌[5],E26只对原生物Ⅲ型土壤杆菌引起的葡萄根癌病具有防治效果[6]等。如何快速准确地鉴定出致病菌和致病菌的类型,对于种苗检疫、病害预测预报和制订防治对策都具有重要意义。
食用樱桃Cerasus pseudocerasus是山东泰安地区的主栽果树之一,近几年根癌病对其生长造成严重的影响,部分苗圃的发病率接近90%。本研究旨在研究该地区樱桃根癌病病原细菌的分类地位,明确其生物分型,为生产上有针对性地防病治病提供理论依据。
1 材料与方法
1.1 主要培养基
YMA培养基:K2HPO4 0.5 g,CaCl2 0.2 g,NaCl 0.2 g,MgSO4·7H2O 0.2 g,酵母浸粉 1 g,甘露醇 10 g,微量元素(1 000×)2 mL,蒸馏水定容至1 000 mL,pH 7.2~7.4,琼脂 15 g,121℃灭菌 20 min后备用。其中微量元素(1 000×)的配方为:FeCl3 5 g/L,MnCl2 0.1 g/L,ZnCl2 0.5 g/L。
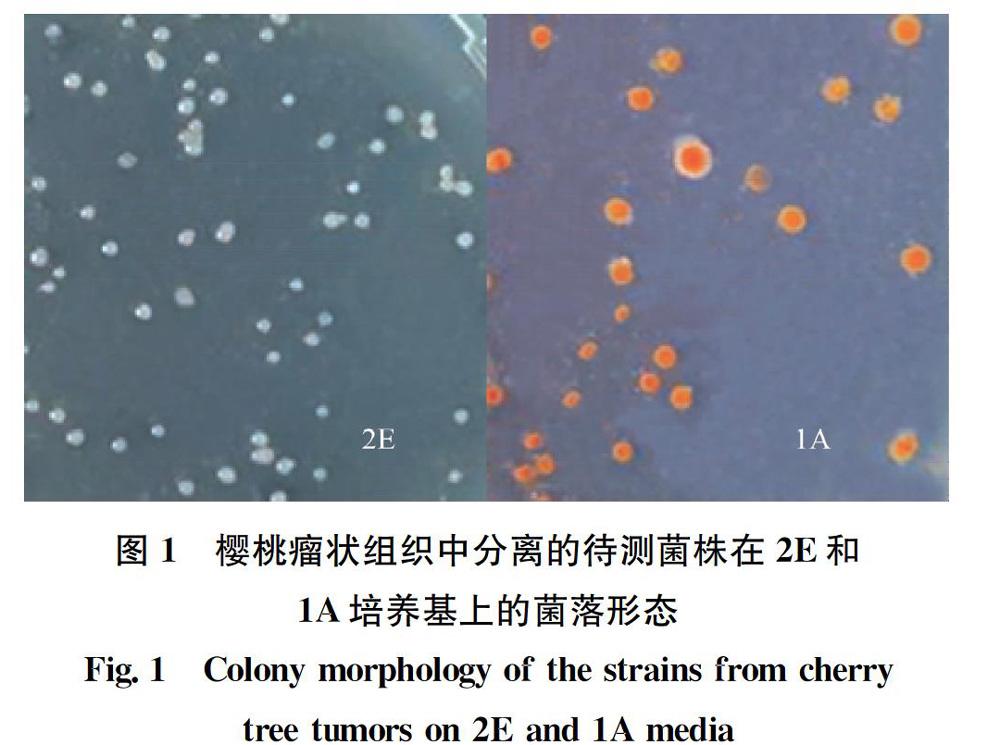
1A培养基[7]:阿糖醇 3.04 g,NH4NO3 0.16 g,KH2PO4 0.54 g,K2HPO4 1.04 g,MgSO4·7H2O 0.25 g,牛磺胆酸钠0.29 g,0.1%结晶紫溶液2 mL。蒸馏水定容至1 000 mL,pH 7.2~7.4,琼脂 15 g,121℃灭菌 20 min。平板倾倒前每升加入2%放线菌酮10 mL,1%Na2SeO3·5H2O 10 mL。
2E培养基[7]:赤藓糖醇3.05 g,NH4NO3 016 g,KH2PO4 0.54 g,K2HPO4 1.04 g,MgSO4·7H2O 0.25 g,牛磺胆酸钠0.29 g,1%酵母提取物溶液 1 mL,0.1%孔雀绿溶液5 mL。蒸馏水定容至1 000 mL,pH 7.2~7.4,琼脂 15 g,121℃灭菌 20 min。平板倾倒前每升加入2%放线菌酮10 mL,1%Na2SeO3·5H2O 10 mL。
1.2 对照菌株
A. tumefaciens K354,含质粒pTi58,为产胭脂碱和农杆菌素碱A的生物Ⅰ型致病性土壤杆菌;菌株A.rhizogenes K1026属非致病性土壤杆菌;以上菌株均由澳大利亚阿德莱德大学Ryder Maarten教授提供。
1.3 感病土壤及樱桃根癌组织取样地点
取样地点位于山东泰安岱岳区夏张镇尹家庄村金旺大樱桃专业合作社的樱桃种植基地,土壤类型为棕壤,pH 6.34,经检测土壤中总氮、磷、钾和有机质的含量分别为1.35、1.24、1.9 g/kg和22.4 g/kg。试验地块有连续5年的中国樱桃育苗史,冠瘿病发病4年,部分地块发病严重。
取样时,小心完整地挖出感病植株根部,取部分根际土置于冰盒中。然后清水清洗根部,用锋利的刀子取下瘤状组织,置于冰盒中带回实验室。
1.4 根癌病原菌分离
根部瘤状组织上病原菌分离采用常规分离法,选取根系上幼嫩瘤状组织用无菌水清洗干净,刮去表皮老化部分,切取10 g瘤状组织,先用无菌水冲洗,放入0.52%的次氯酸钠溶液浸泡 5 min,然后浸入75%乙醇30 s,再用无菌水冲洗3次。将组织捣碎后加入90 mL无菌水振荡,即为10-1浸提液,依次梯度稀释至10-6,每个稀释度取100 μL分别涂布1A和2E培养基,设3个重复,放于26℃培养箱内培养2~4 d,挑取不同形态菌株在YMA培养基上划线接种,直至纯化,保存。
根际土中病原菌的分离采取梯度稀释法,稀释至10-5后,分别涂布1A和2E培养基,26℃培养2~4 d后,挑取不同形态菌株在YMA培养基上划线接种,直至纯化,保存。
1.5 分離病原菌的鉴定
1.5.1 致病性鉴定
采用胡萝卜切片法和番茄茎部针刺接种法[8]检测分离菌株的致病性。供试胡萝卜根茎购买自菜市场,品种为‘春红二号;供试番茄品种为‘佳粉15号。
选择新鲜、无损伤的胡萝卜根茎,自来水清洗干净,用70%乙醇擦洗后火焰干燥,横切成5 mm厚的圆片,用干净的手术刀片切除胡萝卜圆片外周部分,放在铺有水琼脂的培养皿内,靠近根端的一面朝上。挑取在YMA培养基上生长24 h的待测菌株,用无菌水制备成A600=0.3左右的菌悬液,各吸取30 μL涂于胡萝卜圆片上。每个菌株重复接种2~3个胡萝卜片,同时设无菌水对照,25℃培养2周左右观察结果。
取生长50 d左右的健康番茄植株,每株番茄各取3个不同的枝条进行处理。先用75%乙醇表面消毒,再用无菌注射针头轻刺并注射菌悬液10 μL左右,以无菌水为阴性对照,2~3周后调查创伤处瘤状组织的产生情况。
1.5.2 生理生化指标鉴定
参照Schaad等[9]的方法检测待测菌株的3-酮基乳糖产生及对K2TeO3的耐受程度等。
1.5.2.1 3-酮基乳糖检测
将分离纯化的病原菌接种至培养基上,置于26℃培养箱内培养至有明显菌落形成时,向平板上倒入Benedict试剂,室温放置30 min以上,如果菌落四周出现黄色则为阳性,判断为原生物Ⅰ型。
培养基组分:乳糖10 g,酵母膏1 g,琼脂粉15 g,蒸馏水1 L,pH 7.0~7.2。
Benedict试剂:CuSO4·H2O 17.3 g,Na2CO3 100 g,柠檬酸钠173 g,蒸馏水1 L。
1.5.2.2 对K2TeO3的耐受程度[10]
将分离纯化的病原菌接种至含不同浓度K2TeO3的YMA培养基中,26℃培养48 h以上观察待测菌株对K2TeO3的耐受程度,一般原生物Ⅱ型的耐受程度高。
1.5.3 致病菌的分子生物学鉴定
挑取在YMA培养基上生长24 h的待测菌株,接种至YM液体培养基中,26℃摇床培养36 h(菌量约108 cfu/mL),采用细菌DNA提取试剂盒(Omiga D3350),按照说明书的方法提取基因组DNA。通过凝胶电泳检测DNA的质量并稀释至浓度为10~20 ng/μL,分装并储存于-20℃用于进一步分析。
2.5 菌株致病性相關基因的分子检测
分别以K354和K1026作为阳性和阴性对照菌株,采用普通PCR法扩增12株病原菌的致病相关基因。结果显示:除菌株C11-34和阴性对照菌株K1026外,12株待测菌中的11株均可扩增得到与3个目的基因virD2、tms2 和ipt大小一致的特异片段(图6),3个基因之间的检测结果一致性为100%。
2.6 致病土壤杆菌Ti质粒的生物碱类型分子检测
分别用扩增章鱼碱型和胭脂碱型土壤杆菌Ti质粒上iaaH基因的引物进行PCR扩增12株病原菌均扩增获得420 bp的片段;用nos引物扩增,所有菌株(含胭脂碱型对照菌株K354)均扩增到206 bp的片段;而用ocs引物扩增,12株检测菌均未获得目的片段(表3)。表明分离的致病菌均为胭脂碱型土壤杆菌。
2.7 致病菌质粒生物碱类型化学检测
检测了原生物Ⅰ型和原生物Ⅱ型中5株致病菌接种胡萝卜切片后,产生的瘤状组织生物碱的类型,结果发现5株致病菌产生的冠瘿碱类型全部为胭脂碱型(图7),未检测到章鱼碱类的生物碱,由此认为分离的致病性土壤杆菌质粒类型均为胭脂碱型。
3 讨论
以樱桃根部瘤状组织和感病土壤为研究对象,利用选择性培养基发现瘤状组织中原生物Ⅱ型土壤杆菌达到108 cfu/g的数量级,原生物Ⅰ型菌数仅占1%~5%;根际土壤中原生物Ⅱ型根癌农杆菌为105 cfu/g,李茜等[16]研究认为当土壤带菌量达到103 cfu/g时,可导致桃树根癌病的发生,本研究选择的地块中樱桃根癌病发生严重,90%以上植株根部产生瘤状组织。
在致病性土壤杆菌的分类鉴定中,表型特征是一类重要的指标。利用α-乳糖产生3-酮基乳糖是原生物Ⅰ型土壤杆菌的独有特征,本研究中1A培养基对原生物Ⅰ型土壤杆菌选择性不强,分离的2株菌的3-酮基乳糖产生试验中仅有1株为阳性。2E培养基对原生物Ⅱ型表现出高度的选择性,这与Brisbane等[7]对澳大利亚农田土壤的分析结果是一致的。对亚碲酸盐的敏感性也可作为土壤杆菌生物分型的依据之一[10],一般情况下原生物Ⅱ型对亚碲酸盐的耐受程度较高,可耐受1 000 μg/mL的浓度;而生物Ⅰ型只能在低于300 μg/mL的浓度下生长,本研究的C31-32只可耐受80 μg/mL的浓度,与3-酮基乳糖结果一致。
在本研究中土壤杆菌的致病性采用胡萝卜切片和番茄植株针刺接种,所有对胡萝卜致病的菌株都可使番茄茎部产生瘤状组织。在试验过程中,为了不把瘤状组织与胡萝卜正常愈伤组织相混淆,只使用了基底面,因为正常愈伤组织总是生长在离体培养2周或2周以上的胡萝卜片的顶端表面。在胡萝卜切片的基底面检测土壤杆菌的致病性是一种比接种植株更严格的致病性检测方法[17]。本研究分别选择了20株原生物Ⅰ型和Ⅱ型的菌株进行致病性检测,结果发现Ⅱ型病原菌90%以上具有致病性,而原生物Ⅰ型仅有10%有致病性,说明引起该地区冠瘿病的主要病原菌是原生物Ⅱ型。
在细菌鉴定及系统发育地位研究方面,16S rDNA是最常用的分子工具,通常认为同源性大于97.5%的细菌可视为同种[18],然而在土壤杆菌庞大的分支系统中,许多亲缘关系较远的菌株同源性大于98%,已不能准确地确定菌株的系统分类学地位。recA基因是广泛存在于细菌中重要的持家基因,在DNA重组和DNA损伤修复过程中起关键作用,常用于包括土壤杆菌属、紫色色杆菌属等多种细菌的分型,越来越多地作为系统分类学研究工具[19]。本研究基于recA基因序列构建的系统发育树,分析出生物Ⅰ型菌株C31-32与K354菌株处于一个分支,亲缘关系更近,表明recA 基因比16S rDNA 具有更好的辨别能力,可作为土壤杆菌属分型鉴定的依据。
采用胡萝卜切片法和番茄茎部针刺接种法鉴定根癌土壤杆菌的致病性,需要2~3周的时间,而分子检测因其快速、简便,得到广泛的研究及应用[20-21]。根癌土壤杆菌的致病性与Ti 质粒的Vir区和T-DNA区密切相关,其中Vir 区与病原菌的附着、T-DNA加工和转移相关,T-DNA区为致瘤区,二者在决定病原菌的致病性时缺一不可。利用分子方法检测致病性,至少需要Vir区与T-DNA区各一对引物相结合才能确定病原菌的致病性。本研究选用T-DNA 上ipt基因,Ti质粒Vir 区的VirD2和tms2保守序列,12株菌株中有11株PCR扩增为阳性,与胡萝卜切片和番茄植株活体接种一致。
植物根癌病的生物防治与病原菌携带的Ti质粒类型密切相关[7],明确致病菌在侵染植物形成瘤状组织时产生的生物碱的类型,对筛选有效的生防菌至关重要。如放射性土壤杆菌HLB-2[22]可利用章鱼碱和胭脂碱作为氮源,抑制由葡萄土壤杆菌引起的冠瘿病;菌株E26可抑制由胭脂碱型、章鱼碱型、农杆菌碱型引起的冠瘿病[6];工程生防菌K1026可抑制胭脂碱型土壤杆菌引起的冠瘿病[8]。本研究利用PCR方法检测的12株致病菌均为胭脂碱型,与利用传统的高压纸电泳法鉴定结果一致。
本研究分析表明,引起山东泰安大樱桃根癌病的主要致病菌为原生物Ⅱ型的土壤杆菌A.rhizogenes,产生的生物碱类型为胭脂碱型,可选用K1026作为生防菌进行防治,这与本文作者前期的田间试验结果[8]相一致。采用分子生物学方法确定病原菌的分类特征,可缩短鉴定时间,有助于病害早期诊断,为有针对性地开展生物防治提供理论基础。
参考文献
[1] PULAWSKA J. Crown gall of stone fruits and nuts, economic significance and diversity of its causal agents: Tumorigenic Agrobacterium spp. [J]. Journal of Plant Pathology, 2010, 92(1): S87-S98.
[2] 王金生. 植物病原细菌学[M]. 北京: 中国农业出版社, 2000: 81-87.
[3] LINDSTRM K, YOUNG J P W. International committee on systematics of prokaryotes subcommittee on the taxonomy of Agrobacterium and Rhizobium [J]. International Journal of Systematic and Evolutionary Microbiology, 2011, 61(12): 3089-3093.
[4] LEE H, HUMANN J L, PITRAK J S, et al. Translation start sequences affect the efficiency of silencing of Agrobacterium tumefaciens T-DNA oncogenes [J]. Plant Physiology, 2003, 133(3): 966-977.
[5] KERR A. Biological control of crown gall [J]. Australasian Plant Pathology, 2016, 45(1): 15-18.
[6] 梁亚杰, 赵家英, 马德钦, 等. 应用生物3型放射土壤杆菌防治葡萄冠瘿瘤形成的研究[J]. 微生物学报, 1990, 30(3): 165-171.
[7] BRISBANE P G, KERR A. Selective media for three biovars of Agrobacterium [J]. Journal of Applied Microbiology, 2008, 54(3): 425-431.
[8] 魏艳丽, RYDER M, 李纪顺, 等. 土壤杆菌K1026对樱桃冠瘿病病原菌的抑制作用及田间防治效果[J]. 植物保护, 2017, 43(5): 52-56.
[9] SCHAAD W. 植物病原细菌鉴定实验指南[M]. 张克勤,译. 贵阳: 贵州人民出版社, 1986: 28-40.
[10]MOUGEL C, COURNOYER B, NESME X. Novel tellurite-amended media and specific chromosomal and Ti plasmid probes for direct analysis of soil populations of Agrobacterium biovars 1 and 2 [J]. Applied and Environmental Microbiology, 2001, 67(1): 65-74.
[11]HAAS J H, MOORE L W, REAM W, et al. Universal PCR primers for detection of phytopathogenic Agrobacterium strains [J]. Applied and Environmental Microbiology, 1995, 61(8): 2879-2884.
[12]PULAWSKA J, SOBICZEWSKI P. Development of a seminested PCR based method for sensitive detection of tumorigenic Agrobacterium in soil [J]. Journal of Applied Microbiology, 2005, 98(3): 710-721.
[13]VLADIMIROV I A, MATVEEVA T V, LUTOVA L A. Opine biosynthesis and catabolism genes of Agrobacterium tumefaciens and Agrobacterium rhizogenes [J]. Russian Journal of Genetics, 2015, 51(2): 121-129.
[14]TAN B S, YABUKI J, MATSUMOTO S, et al. PCR primers for identification of opine types of Agrobacterium tumefaciens in Japan [J]. Journal of General Plant Pathology, 2003, 69(4): 258-266.
[15]虞剑平, 蒋兴邨, 邵启全. Ti质粒基因在单子叶植物石蒜和金针菜中的表达[J]. 遗传学报, 1989,16(3): 174-177.
[16]李茜, 刘伟, 郭荣君, 等. 毛桃种子表面根癌土壤杆菌的荧光定量PCR检测[J]. 果树学报, 2014(3): 501-507.
[17]RYDER M H, TATE M E, KERR A. Virulence properties of strains of Agrobacterium on the apical and basal surfaces of carrot root discs [J]. Plant Physiology, 1985, 77: 215-221.
[18]蹇文婴, 东秀珠. 定向进化同源基因在细菌系统进化研究中的应用[J]. 微生物学通报, 2000, 27(5): 377-381.
[19]THOMPSON C C, THOMPSON K, VANDEMEULEBROECKE K, et al. Use of recA as an alternative phylogenetic marker in the family Vibrionaceae [J]. International Journal of Systematic and Evolutionary Microbiology, 2004, 54: 919-924.
[20]YAKABE L E, MACCREE M M, SUDARSHANA P, et al. Novel PCR primers for detection of genetically diverse virulent Agrobacterium tumefaciens biovar 1 strains [J]. Journal of General Plant Pathology, 2012, 78(2): 121-126.
[21]YANG Wei, JI Lei, TAN Lirong, et al. Sensitive and specific detection of Agrobacterium tumefaciens in soil using a rapid polymerase chain reaction (PCR) [J]. African Journal of Microbiology Research, 2011, 5(6): 708-713.
[22]游積峰, 谢学梅, 陈培民, 等. 放射土壤杆菌HLB-2菌株防治葡萄根癌病的研究[J]. 生物防治通报, 1990, 6(1): 35-37.
(责任编辑:田 喆)
