姜黄素和姜黄素联氨基抗肝癌作用比较及机制研究
2020-12-28赵冀安崔丽敏董梁聂文佳刘文聪李增宁
赵冀安 崔丽敏 董梁 聂文佳 刘文聪 李增宁
摘 要 目的:比較姜黄素(CUR)和其衍生物联氨基姜黄素(HZC)的体内外抗肝癌作用及机制。方法:采用MTT法检测CUR或HZC(2.5、5、10、20、40、80 μmol/L)对人肝癌HepG2细胞增殖的影响;采用流式细胞术检测CUR或HZC(10、20、40 μmol/L)对HepG2细胞周期分布和凋亡情况的影响;采用Western blotting法检测CUR或HZC(10、20、40 μmol/L)对HepG2细胞凋亡相关蛋白表达的影响。将雄性SD大鼠随机分为正常对照组(n=10)、CUR对照组(n=10)、HZC对照组(n=10)、肝癌模型组(n=30)、CUR防护组(n=30)、HZC防护组(n=30)。CUR对照组和HZC对照组大鼠分别腹腔注射CUR或HZC(剂量均为80 mg/kg);模型组、CUR防护组和HZC防护组大鼠均腹腔注射对二乙基亚硝胺(50 mg/kg)建立肝癌模型,同时2种药物防护组大鼠分别腹腔注射CUR或HZC(剂量均为80 mg/kg),每周2次,连续给药12周。给药期间,记录大鼠体质量变化和死亡情况;24周后,计算大鼠肝脏指数并观察其外观,统计肝癌结节数;采用苏木精-伊红染色法观察大鼠肝组织病理学变化并计算肝癌细胞核分裂指数;采用免疫组化法检测大鼠肝组织增殖细胞核抗原(PCNA)指数。结果:CUR和HZC均能显著升高HepG2细胞的增殖抑制率、G0/G1期细胞周期百分比和凋亡率(P<0.05);均能显著降低细胞中磷酸化蛋白酪氨酸激酶2(p-JAK2)、磷酸化信号转导及转录激活蛋白3(p-STAT3)、B淋巴细胞瘤2(Bcl-2)、Bcl-xl蛋白的表达水平,显著升高Bcl-2相关X蛋白(Bax)、细胞色素C(Cyt-c)、胱天蛋白酶9(Caspase-9)、Caspase-3、聚腺苷二磷酸核糖聚合酶(PAPR)蛋白的表达水平(P<0.05);且HZC的上述作用均显著强于CUR(P<0.05)。动物实验结果显示,3个对照组大鼠无死亡,未发生肝脏癌变,肝脏外观和组织切片未见病理变化;体质量及增量、肝脏指数、癌细胞核分裂指数、肝组织PCNA指数组间比较差异均均无统计学意义(P>0.05)。与肝癌模型组比较,CUR防护组和HZC防护组大鼠的存活率均显著升高,肝癌发生率和癌结节数均显著降低(P<0.05);体质量及增量均显著升高,肝脏指数、癌细胞核分裂指数、肝组织PCNA指数均显著降低(P<0.05);肝脏外观和组织切片均有一定程度病变,可见癌灶伴局灶性坏死或伴大斑片状坏死;但2种药物防护组上述指标的改善程度差异均无统计学意义(P>0.05)。结论:HZC能通过抑制JAK2/STAT3信号通路和调节线粒体内源性通路的活化,发挥抑制HepG2细胞增殖、诱导其凋亡的作用,且比CUR具有更强的体外抗肝癌活性;但与CUR比较,HZC对肝癌模型大鼠各项抗肝癌指标的改善未见显著差异。
关键词 肝癌;姜黄素;联氨基姜黄素;蛋白酪氨酸激酶2/信号转导及转录激活蛋白3信号通路;HepG2细胞;大鼠;核分裂指数;增殖细胞核抗原指数
中图分类号 R735.7;R979.1 文献标志码 A 文章编号 1001-0408(2020)22-2741-10
DOI 10.6039/j.issn.1001-0408.2020.22.10
ABSTRACT OBJECTIVE: To compare the anti-hepatocarcinoma effects of curcumin(CUR) and its derivative hydrazincurcumin(HZC), and to explore the mechanism. METHODS: MTT assay was used to detect the effects of CUR or HZC (2.5, 5, 10, 20, 40, 80 μmol/L) on the proliferation of HepG2 cells. Flow cytometry was used to detect the effects of CUR or HZC (10, 20, 40 μmol/L) on cell cycle distribution and apoptosis of HepG2 cells. Western blotting assay was used to detect the effects of CUR or HZC (10, 20, 40 μmol/L) on the expression of apoptosis-related protein in HepG2 cells. The male SD rats were randomly divided into normal control group (n=10), CUR control group (n=10), HZC control group (n=10), model group (n=30), CUR protection group (n=30) and HZC protection group (n=30). CUR control group and HZC control group were given CUR or HZC (80 mg/kg) intraperitoneally. Model group, CUR protection group and HZC protection group were given diethylnitrosamine (50 mg/kg)intraperitoneally to establish hepatocarcinoma model; at the same time, 2 protection groups were given CUR or HZC (80 mg/kg) intraperitoneally, twice a day, for consecutive 12 weeks. During medication, the change of body weight and death of rats were recorded. Twenty four weeks later, liver index of rats was calculated and appearance was observed; the number of cancer nodules was counted; HE staining was used to observe the pathological changes of liver tissue and calculate the nuclear division index of hepatocarcinoma; the proliferating cell nuclear antigen (PCNA) index was detected by immunohistochemistry. RESULTS: CUR and HZC could increase the inhibitory rate of HepG2 cells (P<0.05), and increased the percentage at G0/G1 phase and apoptotic rate of HepG2 cells (P<0.05). CUR and HZC could significantly decrease the protein expression of p-JAK2, p-STAT3, Bcl-2 and Bcl-xl, while increased the protein expression of Bax, Cyt-c, Caspase-9, Caspase-3 and PAPR (P<0.05). Above effects of HZC were significantly better than those of CUR (P<0.05). The results of animal experiment showed that there was no death, no liver canceration and no pathological changes in liver appearance and tissue section of the three control groups; there was no statistical significance in body weight and its increased weight, liver index, nuclear division index of carcinoma or PCNA index (P>0.05). Compared with model group, survival rate of rats were increased significantly in CUR protection group and HZC protection group, while hepatocarcinoma incidence and the number of cancer nodules were decreased significantly (P<0.05); body weight and its increased weight were increased significantly, while liver index, nuclear division index of carcinoma and PCNA index were decreased significantly (P<0.05). There were some pathological changes in liver appearance and tissue section; cancerous lesions with focal necrosis or cancerous lesions with patchy necrosis were observed. There was no statistical significance in the improvement of above indexes in 2 protection groups (P>0.05). CONCLUSIONS: HZC could inhibit the proliferation and induce apoptosis of HepG2 cells by inhibiting JAK2/STAT3 signaling pathway and regulating the activation of mitochondrial endogenous pathway, which shows stronger anti-hepatocarcinoma effect in vitro than CUR. On the other hand, there was no significant difference in the improvement of liver caner indexes in hepatic cancer model rats between HZC and CUR.
KEYWORDS Hepatocarcinoma;Curcumin;Hydrazinocurcumin;JAK2/STAT3 signaling pathway; HepG2 cells; Rats; Nuclear division index; PCNA index
肝細胞癌(HCC)是世界上导致癌症死亡性相关疾病的第三大主要原因,每年约有70万新诊断病例,并有超过25万例死亡[1]。在肝癌早期,可以通过手术切除、射频消融(RFA)和经导管动脉化疗栓塞(TACE)等方法进行治疗,可能提供治愈的机会,但这只能在肿瘤病灶小、远离大血管且没有转移到肝外器官的特定患者中进行[2]。过去常用的全身化疗已被相关研究证实对肝癌患者的治疗效果有限,且在临床对照试验中发现,其对正常细胞有害且容易使肿瘤细胞产生耐药性[3]。
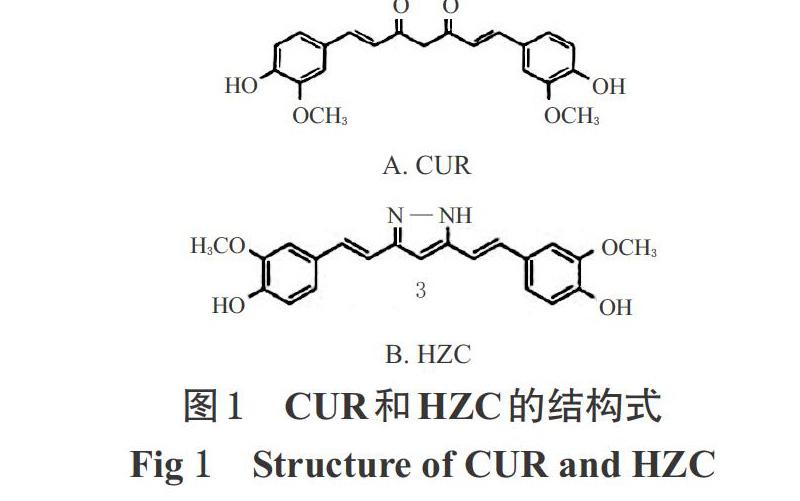
大量体外研究证明,姜黄素(Curcumin,CUR)在许多肝癌细胞系中可以阻滞细胞周期,发挥细胞毒性作用,并参与抑制细胞增殖和诱导细胞凋亡[4]。虽然,CUR具有很好的抗癌活性且无明显毒性,但临床前和临床研究均表明,其在生理学条件下不稳定、生物利用度较差,故使得其在抗癌治疗中的应用受到了限制[5]。有研究指出,对CUR进行结构类似物的合成改造是解决其生物利用度差并保留或进一步提高其药效作用的一种方法[6]。联氨基姜黄素(Hydrazinocurcumin,HZC)是CUR的吡唑类衍生物(两者结构式见图1),与CUR相比,HZC具有更好的水溶性和稳定性,且具有较高的细胞通透性、抗肿瘤活性、生物利用度以及良好的肠道通透性[7];其对多种肿瘤细胞系都具有毒性,尤其是对人肝癌HepG2细胞,在所有姜黄素类似物中,HZC的半数有效浓度最低[8];此外,HZC能更有效地抑制信号转导及转录激活蛋白3(STAT3)磷酸化、下调STAT3蛋白表达,从而抑制肿瘤细胞增殖、集落形成、迁移和侵袭并诱导其凋亡[9]。基于此,本研究通过考察HZC和CUR对人肝癌HepG2细胞增殖、凋亡及相关蛋白表达的影响,以及对二乙基亚硝胺(DEN)诱导的大鼠肝肿瘤的抑制作用,比较两者的体内外抗肝癌作用,旨在为姜黄素类衍生物应用于肝癌的临床治疗提供实验基础。
1 材料
1.1 仪器
SW-CJ-2F型超净工作台(上海苏净实业有限公司);TC2323型CO2细胞培养箱(美国SHELLAB 公司);30RF型低温高速离心机(德国Hettich公司);TC20型细胞计数仪(美国Bio-Rad公司);AE31倒置相差显微镜及照相系统(德国Motic公司);Accuri C6型流式细胞仪(美国BD公司);ELX800型酶标仪(美国Bio Tek公司);DYCZ-24DN型垂直电泳仪(北京市六一仪器厂);BOX型成像分析系统(英国Syngene公司);BS210S型电子天平(德国Sartorius公司)。
1.2 药品和试剂
CUR原料药(批号:78246,纯度:99.5%)、DEN(批号:93861,纯度:>99.0%)、DMEM培养基、MTT试剂均购自美国Sigma公司;HZC原料药(河北科技大学化学与制药工程学院刘守信教授合成并鉴定,纯度:>99.5%);兔源增殖细胞核抗原(PCNA)抗体、兔抗人磷酸化蛋白酪氨酸激酶2(p-JAK2)、磷酸化STAT3(p-STAT3)、B淋巴细胞瘤2(Bcl-2)、Bcl-xl、Bcl-2相关X蛋白(Bax)、细胞色素C(Cyt-c)、胱天蛋白酶9(Caspase-9)、Caspase-3、聚腺苷二磷酸核糖聚合酶(PAPR)、β-肌动蛋白(β-actin)多克隆抗体以及辣根过氧化物酶标记的山羊抗兔IgG二抗(美国Santa Cruz公司,批号:sc-71858、sc- 16566、sc-293059、sc-130307、sc-8392、sc-65532、sc- 33371、sc-81663、sc-65496、sc-74470、sc-8432、sc-2025);胎牛血清(美国Gibco公司);山羊血清(上海碧云天生物技术有限公司);BCA蛋白定量试剂盒(英国Abcam公司,批号:ab102536);异硫氰酸荧光素标记的膜联素V/碘化丙啶(Annexin V/PI)细胞凋亡试剂盒(杭州联科生物技术有限公司);苏木精-伊红(HE)染色试剂盒(上海碧云天生物技术有限公司);ECL发光检测试剂盒(美国Millipore公司);二甲基亚砜(DMSO)等其余试剂均为分析纯或实验室常用规格,水为蒸馏水。
1.3 细胞
人肝癌HepG2细胞系购自中国科学院上海细胞生物研究所。
1.4 动物
健康清洁级SD大鼠120只,雄性,4周龄,体质量100~110 g,由河北医科大学动物中心提供,动物生产许可证号:SCXK(冀)2018-003。大鼠在温度23 ℃、相对湿度55%、12 h光/12 h暗循环、垫料干燥清洁的通风室中饲养,笼具等均经高压灭菌处理后使用;所有大鼠均自由摄取市售颗粒大鼠饲料与清洁饮用水,适应性饲养1周后用于实验。
2 方法
2.1 细胞培养和药物溶液配制
将人肝癌HepG2细胞解冻、复苏并接种至含有10%胎牛血清的DMEM培养基中,于37 ℃、5%CO2培养箱中培养(以下细胞培养条件相同),约3 d传代1次,取对数生长期的细胞进行后续试验。HZC和CUR均以0.1%DMSO溶液为溶剂配制成适当浓度的药液,用于细胞试验和动物实验;DEN以水为溶剂配制成适当浓度的药液,用于动物实验。
2.2 CUR和HZC对HepG2细胞增殖的影响考察
采用MTT法检测。取对数生长期的HepG2细胞,按5×105个/孔接种于96孔板中,培养过夜。将细胞随机分为不同浓度的CUR或HZC组以及对照组,每组设6个复孔。各给药组分别加入不同浓度的CUR或HZC药液(终浓度均为2.5、5、10、20、40、80 μmol/L,浓度根据前期预试验结果设置),对照组加入磷酸盐缓冲液(PBS,pH 7.4,下同),培养48 h。然后向各孔中加入5 mg/mL MTT试液20 μL,继续培养4 h。吸弃各孔MTT试液,加入0.1%DMSO溶液100 ?L,振荡10 min待充分溶解后,采用酶标仪在490 nm波长处测定各孔光密度(OD)值,并计算细胞增殖抑制率:抑制率=(1-给药组OD值/对照组OD值)×100%。以抑制率为纵坐标、药物浓度为横坐标绘制细胞增殖抑制曲线,并采用SPSS 13.0软件计算CUR和HZC的半数抑制浓度(IC50)。上述试验重复3次。
2.3 CUR和HZC对HepG2细胞周期和细胞凋亡的影响考察
采用流式细胞术检测。取对数生长期HepG2细胞,常规消化后,按5×105个/孔接种于6孔板中,培养24 h,将细胞随机分为不同浓度的CUR组或HZC组以及对照组,每组设6个复孔。各给药组分别加入相应CUR或HZC药液(终浓度均为10、20、40 μmol/L,浓度根据前期预试验结果设置),对照组均加入PBS,培养48 h。收集、洗涤细胞,先后加入5 μL的Annexin V-FITC和5 μL的PI染色试剂,混匀,在室温下避光反应15 min后,用流式细胞仪分别检测细胞周期分布和凋亡情况。上述试验重复3次。
2.4 CUR和HZC对HepG2细胞中凋亡相关蛋白表达的影响
采用Western blotting法检测。按“2.3”项下方法取HepG2细胞接种、培养,分为不同浓度的CUR组或HZC组以及对照组,每组设6个复孔。各给药组分别加入相应CUR或HZC药液(终浓度均为10、20、40 μmol/L,浓度根据前期预试验结果设置),对照组加入DMEM培养基,培养48 h。在各孔中加入含蛋白酶抑制剂的RIPA裂解液冰浴裂解25 min,收集细胞,在4 ℃条件下以15 000 r/min离心25 min。取上清,采用BCA法进行总蛋白定量。将蛋白变性处理后取适量,采用10%十二烷基硫酸鈉-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,转膜,以5%脱脂奶粉封闭2 h后,加入p-JAK2、p-STAT3、Bcl-2、Bcl-xl、Bax、Cyt-c、Caspase-9、Caspase-3、PAPR、β-actin抗体(稀释度均为1 ∶ 1 000),4 ℃孵育过夜;然后加入二抗(稀释度为1 ∶ 500),室温孵育2 h,以ECL发光检测试剂显色,在成像分析系统中采集图像。以β-actin为内参,采用Image J 5.0软件分析目标蛋白条带的相对灰度值,用来表示相应蛋白的表达水平。上述试验重复3次。
2.5 CUR和HZC对肝癌模型大鼠的抑瘤作用考察
2.5.1 分组与给药 取大鼠120只,随机分为正常对照组(CON组,n=10)、CUR对照组(CUR组,n=10)、HZC对照组(HZC组,n=10)、肝癌模型组(DEN组,n=30)、CUR防护组(DEN+CUR组,n=30)、HZC防护组(DEN+HZC组,n=30)。CON组大鼠腹腔注射生理盐水0.5 mL;CUR组和HZC组大鼠分别腹腔注射CUR或HZC(剂量为80 mg/kg)药液0.5 mL;DEN组、DEN+CUR组和DEN+HZC组大鼠均腹腔注射DEN(剂量为50 mg/kg)药液0.5 mL,同时DEN+CUR组和DEN+HZC组大鼠分别腹腔注射CUR或HZC(剂量为80 mg/kg)药液0.5 mL。生理盐水、DEN、CUR和HZC均每周给药2次(给药间隔2~3 d),12周后停药;剂量均根据预实验结果设置。
2.5.2 大鼠一般情况观察及肝脏指数计算 实验从给药起到第24周末时结束。给药期间观察大鼠的饮食、活动及死亡情况,并记录体质量。所有大鼠按照《中国实验动物学会学术道德规范实施细则》进行麻醉和处死后,测定最终体质量,并计算其与实验开始时体质量的差值作为体质量增量;然后立即切除肝脏,测定肝质量,并计算肝脏指数[肝脏指数=肝脏质量(g)/最终体质量(g)×100%]来间接反映肝肿瘤的生长情况。如果发生大鼠死亡,则即刻进行称量、解剖,按实验结束计算其体质量增量、肝脏指数,并进行后续指标检测。
2.5.3 大鼠肝脏外观及肝癌发生情况观察 肉眼观察大鼠肝脏大体形态、结节大小,判断肝癌发生情况并计算其发生率(由于大鼠肝癌多为弥散性癌结节,故根据文献规定以出现直径>6 mm的结节判断为发生肝癌[10]),同时对肝癌结节(直径>6 mm)进行计数。
2.5.4 大鼠肝组织病理学观察及癌细胞分裂指数计算 将大鼠肝组织进行常规固定,石蜡包埋,切片(4 μm),进行HE染色,置于显微镜下观察并寻找肝癌结节组织中癌细胞的核分裂象。随机统计20个高倍视野(HPF,×400倍)中肝癌细胞核分裂总数,换算成平均每10个HPF的核分裂数(个/10 HPF),作为大鼠肝癌细胞核分裂指数。
2.5.4 大鼠肝组织PCNA指数测定 采用免疫组化法检测。取大鼠肝组织石蜡切片,经脱蜡、脱水,消除内源性过氧化物酶的活性后,在0.01%枸橼酸盐缓冲液中进行抗原热修复。修复完毕后,滴加10%山羊血清封闭,再加入PCNA一抗(稀释度为1 ∶ 50),4 ℃孵育过夜;加入二抗(稀释度为1 ∶ 200),室温下孵育1 h;然后进行DAB显色、苏木精复染、脱水透明封片,置于显微镜下观察并拍照。镜下可见,肝癌组织的PCNA阳性染色呈棕黄色,定位于细胞核,呈现颗粒状或弥散性分布。PCNA阳性表达强度由染色强度积分(阴性:0分;弱:1分;中:2分;强:3分)和阳性细胞百分比积分(0%:0分;≤25%:1分;>25%~50%:2分;>50%:3分)相加后表示,最高为6分;评分≥3分则表示细胞为PCNA表达阳性。在显微镜下对10个视野内PCNA阳性表达细胞及所有肿瘤细胞进行计数,计算PCNA指数:PCNA指数=PCNA阳性表达细胞数/肿瘤细胞总数×100%[11]。
2.6 统计学方法
采用SPSS 13.0软件对数据进行统计分析。计数资料以用率表示,采用卡方检验进行组间比较;计量资料以x±s表示,若满足正态分布且方差齐性则采用方差分析进行组间比较。P<0.05为差异有统计学意义。
3 结果
3.1 CUR和HZC对HepG2细胞增殖的抑制作用
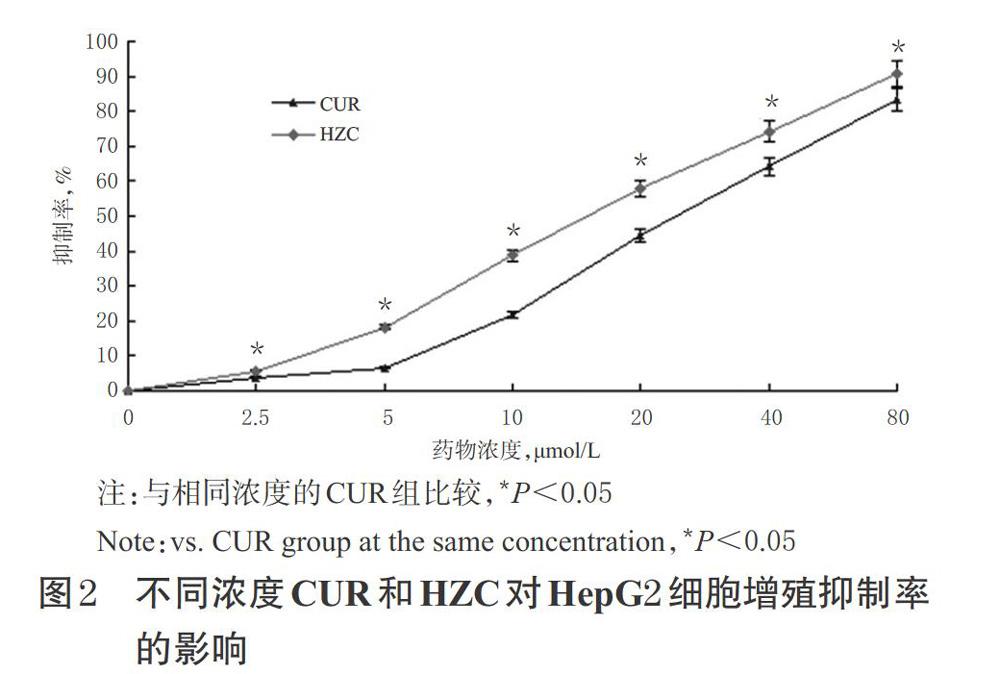
经不同浓度CUR(2.5~80 μmol/L)处理后,细胞增殖抑制率分别为(3.85±0.88)%、(6.59±0.39)%、(21.62±1.64)%、(44.36±2.27)%、(64.26±2.37)%、(83.34±2.43)%;经相应浓度HZC处理后,细胞增殖抑制率分别为(5.70±1.30)%、(18.28±1.25)%、(38.66±1.98)%、(57.81±2.32)%、(74.25±2.40)%、(90.78±3.45)%。结果表明,随着CUR和HZC浓度的升高,其对细胞增殖的抑制作用逐渐增强,且呈浓度依赖趋势,详见图2。经计算,CUR和HZC的IC50值分别为(25.43±2.86)、(15.84±0.97)μmol/L。两种药物对细胞的抑制率和IC50比较,差异均有统计学意义(P<0.05),表明相同浓度的HZC比CUR对HepG2细胞具有更强的抑制作用。
3.2 CUR和HZC对HepG2细胞周期分布和凋亡的影响
与对照组比较,随着药物浓度的升高,各给药组G0/G1期细胞百分比均显著升高、S期和G2/M期细胞百分比均显著降低(P<0.05),且相同药物的不同浓度组间比较差异均有统计学意义(P<0.05);与相同浓度的CUR组比较,相应HZC组G0/G1期细胞百分比均显著升高、S期细胞百分比均显著降低(P<0.05)。这表明,CUR和HZC均可将HepG2细胞阻滞在G0/G1期,并呈浓度依赖性,且HZC阻滞细胞周期的能力强于CUR。与对照组比较,随着药物浓度的升高,各给药组细胞凋亡率均显著升高(P<0.05),且相同药物的不同浓度组间比较差异均有统计学意义(P<0.05);与相同浓度的CUR组比较,相应HZC组细胞的凋亡率显著升高(P<0.05)。这表明,CUR和HZC均可诱导HepG2细胞发生凋亡,并呈浓度依赖性,且HZC诱导细胞凋亡的作用强于CUR。各组细胞周期分布和凋亡的流式细胞图见图3、图4,细胞周期分布百分比和凋亡率测定结果见表1。
3.3 CUR和HZC对HepG2细胞中凋亡相关蛋白表达的影响
与对照组比较,各给药组随着药物浓度的升高,细胞中p-JAK2、p-STAT3、Bcl-2、Bcl-xl蛋白的表達水平均显著降低(P<0.05),Bax、Cyt-c、Caspase-9、Caspase-3、PAPR蛋白的表达水平均显著升高(P<0.05),且相同药物不同浓度组间比较差异均有统计学意义(P<0.05);与相同浓度的CUR组比较,相应HZC组细胞中p-JAK2、p-STAT3、Bcl-2、Bcl-xl蛋白的表达水平均显著降低(P<0.05),Bax、Cyt-c、Caspase-3、Caspase-9、PAPR蛋白的表达水平均显著升高(P<0.05)。各组细胞中凋亡相关蛋白表达的电泳图见图5,蛋白表达水平的检测结果见表2。
3.4 CUR与HZC对肝癌模型大鼠的抑瘤作用
3.4.1 大鼠一般情况 给药期间,3个对照组大鼠进食饮水均良好,体质量正常增长,且实验结束时其体质量及增量、肝脏指数组间比较差异无统计学意义(P>0.05);DEN组、DEN+CUR组和DEN+HZC组大鼠饮水和进食逐渐减少,体质量及增量均显著低于CON组(P<0.01),肝脏指数均显著高于CON组(P<0.01);与DEN组比较,DEN+CUR组和DEN+HZC组大鼠上述症状均明显减轻,上述指标均显著改善(P<0.05或P<0.01)。实验结束时,3个对照组大鼠均未见死亡;DEN组、DEN+CUR组和DEN+HZC组均有大鼠死亡,其中DEN组大鼠存活率最低(仅60%),显著低于CON组(P<0.05);与DEN组比较,DEN+CUR组和DEN+HZC组大鼠存活率显著升高(P<0.05或P<0.01);与DEN+CUR组比较,DEN+HZC组大鼠存活率更高,但差异无统计学意义(P>0.05)。各组大鼠存活率、体质量及增量、肝脏指数的检测结果见表3。
3.4.2 大鼠肝脏外观及肝癌发生情况 3个对照组大鼠肝脏外观均正常,表面光滑,色泽红润,无增生结节或肝癌发生;DEN组大鼠肝脏边缘不整齐,色暗或淡,表面散在大小不一的灰白色癌结节,有的癌结节呈结节型和(或)融合在一起的巨块型,结节切面有坏死及出血,结节数显著多于CON组(P<0.05);DEN+CUR组和DEN+HZC组大鼠肝脏也可见白色癌结节,但与DEN组比较直径较小且数量较少,差异有统计学意义(P<0.05);DEN+CUR组和DEN+HZC组癌结节数量比较,差异无统计学意义(P>0.05)。各组大鼠肝脏外观见图6。
3个对照组大鼠均无肝癌发生;DEN组大鼠肝癌发生率为100%,显著高于CON组(P<0.01);DEN+CUR组和DEN+HZC组大鼠肝癌发生率分别为36.7%和20.0%,均显著低于DEN组(P<0.01);与DEN+CUR组比较,DEN+HZC组大鼠肝癌发生率更低,但差异无统计学意义(P>0.05)。各组大鼠肝癌结节数和肝癌发生率的检测结果见表4。
3.4.3 大鼠组织病理学改变及癌细胞核分裂象 CON组大鼠肝组织细胞结构完整,无变性坏死,细胞核清晰;肝索周围规整,且围绕中央静脉呈放射状排列。CUR组大鼠肝组织虽具有正常的小叶组织,但可见中度至重度的肝窦和静脉充血。HZC组大鼠肝组织可见中央静脉和肝血窦轻到中度的充血。DEN组大鼠肝组织细胞正常结构消失,细胞核大而深染;肝小叶结构严重紊乱,有大小不等的再生结节;肝细胞变性,结构消失,细胞呈多形性,核分裂象及胞质内分泌颗粒增多。DEN+CUR组大鼠肝组织可见与肝窦相邻的无序细胞,但与DEN组比较可见癌灶局灶性坏死和较少的核分裂象。DEN+HZC组大鼠肝组织失去了正常的肝小叶组织,可见癌灶的大斑片状坏死。与CON组比较,DEN组、DEN+CUR组和DEN+HZC组大鼠肝癌细胞的核分裂指数均显著升高(P<0.01);与DEN组比较,DEN+CUR组和DEN+HZC组大鼠肝癌细胞的核分裂指数均显著降低(P<0.01);与DEN+CUR组比较,DEN+HZC组大鼠肝癌细胞的核分裂指数虽有所降低,但差异无统计学意义(P>0.05)。各组大鼠肝组织病理学显微图见图7,肝癌细胞核分裂指数的检测结果见表5。
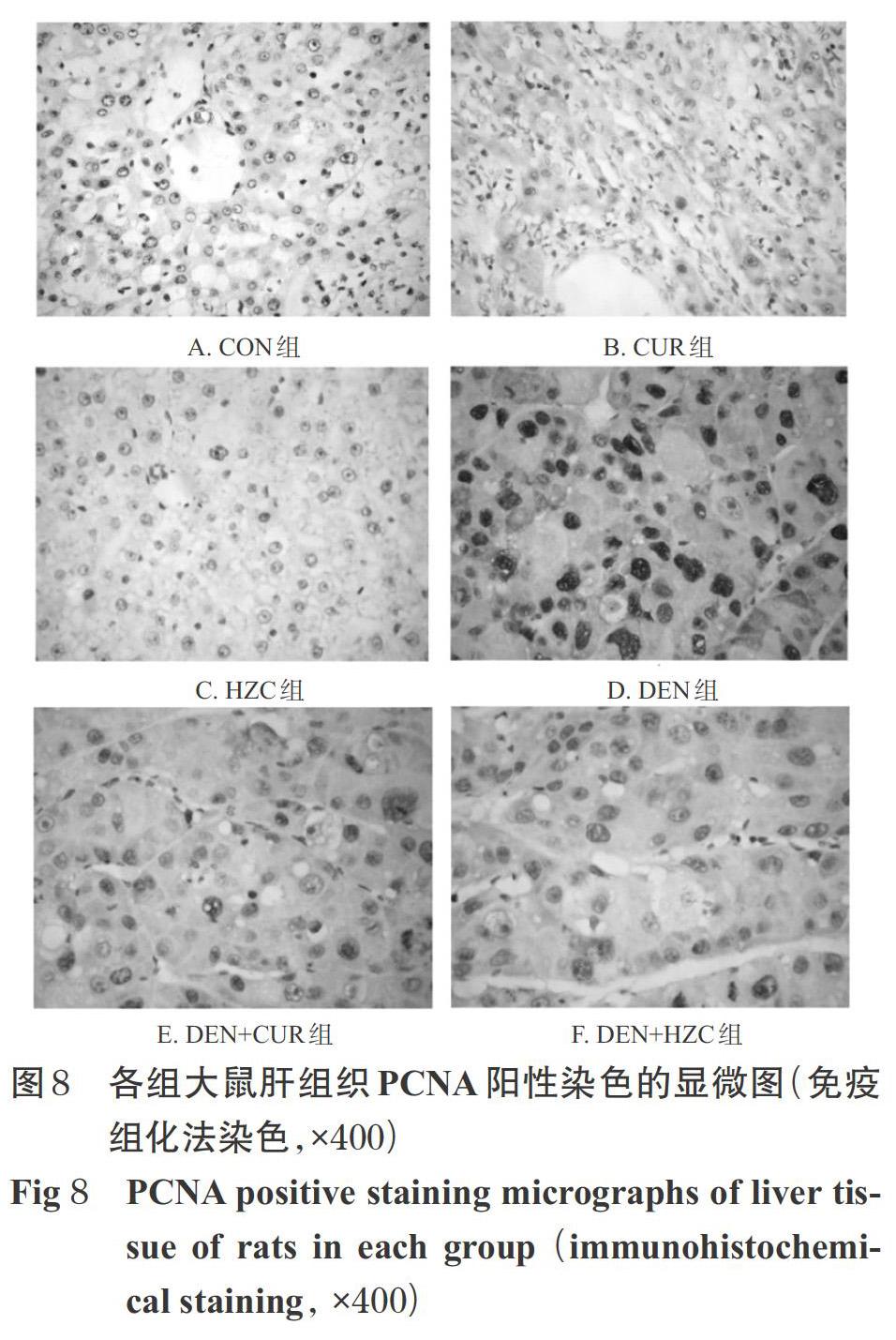
3.4.4 大鼠肝组织PCNA指数 3个对照组大鼠肝组织中没有或极少出现PCNA阳性细胞;DEN组大鼠肝组织细胞呈明显的PCNA阳性染色,核深染,提示细胞分裂和增殖旺盛;DEN+CUR组和DEN+HZC组大鼠肝组织PCNA阳性染色较DEN组显著减少。与CON组比较,DEN组、DEN+CUR组和DEN+HZC组大鼠肝组织PCNA指数均显著升高(P<0.01);与DEN组比较,DEN+CUR组和DEN+HZC组大鼠肝组织PCNA指数均显著降低(P<0.01);与DEN+CUR组比较,DEN+HZC组肝组织PCNA指数虽有所降低,但差异无统计学意义(P>0.05)。各组大鼠肝组织PCNA阳性染色显微图见图8,PCNA指数的检测结果见表5。
4 讨论
肝癌是一种恶性程度很高的肿瘤,目前认为其发生发展是多基因突变和多步骤演进的过程,有众多信号通路涉及其中[12]。CUR具有抗肝癌活性,但其在水中的溶解度和稳定性差,实际用于肝癌治疗的效果有限[13]。而CUR的吡唑类衍生物HZC具有高效价、高水溶性和递送性的优点[14]。已有研究发现,HZC可通过降低STAT3通路的一系列下游靶点的表达,在体外抑制乳腺癌细胞的增殖并诱导细胞凋亡[15]。基于这些发现,本研究通过体内外实验来进一步对CUR和HZC的抗肝癌作用进行比较。
本研究发现,CUR和HZC均可有效地抑制HepG2细胞的增殖,可使其阻滞于G0/G1期,并诱导细胞发生凋亡,其作用呈浓度依赖性,且HZC的上述作用均显著强于CUR。为了解其作用机制,本研究对细胞中凋亡相关蛋白(p-JAK2、p-STAT3、Bcl-2、Bcl-xl、Bax、Cyt-c、Caspase-9、Caspase-3、PAPR)的表达变化进行了检测。众所周知,JAK/STAT信号通路的失调可能导致免疫缺陷和癌症发生,活化的JAK2/STAT3信号通路已被广泛证实为治疗人类肿瘤的新型分子靶标[16]。活化的JAK2/STAT3信号通路可以调节涉及各种生理功能的靶因子的表达,包括抗凋亡蛋白(如Bcl?xl、Bcl?2)、促凋亡蛋白(如Bax)和线粒体凋亡途径相关蛋白(如Cyt-c、Caspase-9、Caspase-3、PAPR)[17]。很多药物对细胞的诱导凋亡作用是通过JAK2/STAT3信号通路和内源性线粒体通路实现的[18]。内源性线粒体通路是在Bcl-2家族(包括Bax和Bcl-2)的调节下在线粒体水平启动的[19]。线粒体通过激活细胞死亡起始因子Caspase-9介导的凋亡信号转导,激活的Caspase-9切割执行者Caspase-3使后者活化,活化的Caspase-3再裂解PARP(一种与程序性细胞死亡过程相关的核蛋白)使其活化[20]。本研究结果显示,经CUR和HZC作用后,细胞中p-JAK2、p-STAT3、Bcl-2和Bcl-xl蛋白的表达水平均显著降低,Bax、Cyt-c、Caspase-9、Caspase-3和PAPR蛋白的表达水平均升高,提示CUR和HZC的处理均可降低细胞JAK2和STAT3磷酸化水平,通过激活内源性线粒体通路Caspase家族蛋白诱导HepG2细胞凋亡,促使Cyt?c释放以及Caspase?9、Caspase?3、PARP活化,进而使得Bcl-2、Bcl-xl的蛋白表达水平均显著升高;而且,与相同浓度的CUR比较,HZC对上述蛋白表达的影响更显著(差异均有统计学意义)。这些结果表明,HZC可通过抑制JAK2/STAT3信号通路介导的内源性线粒体通路诱导HepG2细胞凋亡,发挥体外抗肿瘤作用,且作用强于CUR。
本研究进一步通过动物实验比较了CUR与HZC的抗肿瘤作用。DEN是一种强大的致癌物质,已知可诱发包括人类在内的所有动物物种的癌症[21]。该化合物可以通过改变DNA结构诱发肝癌,且其诱导大鼠肝脏细胞染色体突变形成肝癌的过程与人肝癌的发生过程相似[10]。HZC是一种新型的CUR衍生物,先前已被证明具有在纳米摩尔浓度(IC50=520 nmol/L)下抑制牛主动脉内皮细胞增殖而不引起细胞毒性的潜力[13]。Arif M等[22]研究发现,HZC减缓口腔癌裸鼠肿瘤生长的作用是由于其诱导细胞凋亡所致。本研究以DEN诱导建立大鼠肝癌模型,并比较了CUR和HZC的体内毒性和抗肝癌活性。结果显示,两者在大鼠体内几乎没有毒性;且给予CUR和HZC治疗后大鼠体质量及增量和存活率均较DEN组显著升高,肝脏指数、肝癌发生率和肝脏癌结节数均显著降低,组织病理学变化明显减轻,表明两者均有抗肝癌的作用;HZC的上述作用虽比CUR更强,但差异无统计学意义。
细胞核分裂象在肿瘤病理诊断中的作用十分重要,核分裂指数能够用于区别肿瘤良恶性、鉴别瘤样病变与恶性肿瘤、评估肿瘤恶性程度和患者预后等[23]。此外,PCNA作为反映细胞增殖状态和恶性程度的指标,一般认为其指数值越高,则肿瘤细胞的增殖能力越活跃、分化程度越低、恶性程度越高、越容易发生浸润和转移[24]。已有研究证实,PCNA在肝癌细胞核中的表达明显增强[25],故PCNA表达的显著增强表明肝组织细胞的异常增殖。本研究结果显示,DEN+CUR组和DEN+HZC组的肝癌细胞核分裂指数和PCNA指数均较DEN组显著降低,其中DEN+HZC组上述指标的下降程度虽较DEN+CUR组更明显,但差异无统计学意义。这表明,CUR和HZC干预均能减弱肝癌模型大鼠癌细胞的增殖及其恶性程度,但两者未表现出显著差异。
综上所述,与CUR比较,HZC在抑制HepG2细胞增殖和诱导其凋亡、抑制JAK2/STAT3信号通路和调节线粒体内源性通路活化方面具有更强的作用,其体外抗肝癌活性显著更优;但在肝癌模型大鼠体内,与CUR比较,HZC对各项肝癌指标的改善作用虽更明显,但差异无统计学意义。对此,笔者分析原因可能为:大鼠饲养密度偏高,使得其容易发生相互撕咬,影響自身抵抗力;采用腹腔注射可能存在将药物直接注射到肠管上的情况,导致药物无法被腹膜充分吸收入血,从而影响药效;大鼠样本量偏小,导致抽样误差偏大,不易发现实际存在的差异;实验时间偏短,使得CUR和HZC的体内抗肝癌作用未能充分发挥。后续,本课题组拟针对上述问题进一步优化实验设计进行深入研究,以明确HZC作为抗肝癌有效候选药物的疗效。
参考文献
[ 1 ] PALLIYAGURU DL,WU F. Global geographical overlap of aflatoxin and hepatitis C:controlling risk factors for li- ver cancer worldwide[J]. Food Addit Contams,2013,30(3):534-540.
[ 2 ] KUMADA T,NAKANO S,TAKEDA I,et al. Patterns of recurrence after initial treatment in patients with small hepatocellular carcinoma[J]. Hepatology,1997,25(1):87- 92.
[ 3 ] AGGARWAL BB,KUMAR A,BHARTI AC. Anticancer potential of curcumin:preclinical and clinical studies[J]. Anticancer Res,2003,23(1A):363-398.
[ 4 ] PRAKOBWONG S,GUPTA SC,KIM JH,et al. Curcumin suppresses proliferation and induces apoptosis in human biliary cancer cells through modulation of multiple cell signaling pathways[J]. Carcinogenesis,2011,32(9):1372-1380.
[ 5 ] ANAND P,KUNNUMAKKARA AB,NEWMAN RA,et al. Bioavailability of curcumin:problems and promi- ses[J]. Mol Pharm,2007,4(6):807-818.
[ 6 ] AGRAWAL DK,MISHRA PK. Curcumin and its analogues:potential anticancer agents[J]. Med Res Rev,2010,30(5):818-860.
[ 7 ] RATHORE R,JAIN JP,SRIVASTAVA A,et al. Simulta- neous determination of hydrazinocurcumin and phenol red in samples from rat intestinal permeability studies:HPLC method development and validation[J]. J Pharm Biomed Anal,2008,46(2):374-380.
[ 8 ] ISHIDA J,OHTSU H,TACHIBANA Y,et al. Antitumor agents:part 214:synthesis and evaluation of curcumin ana- logues as cytotoxic agents[J]. Bioorg Med Chem,2002,10(11):3481-3487.
[ 9 ] WANG X,ZHANG Y,ZHANG X,et al. The curcumin ana- logue hydrazinocurcumin exhibits potent suppressive activity on carcinogenicity of breast cancer cells via STAT3 inhibition[J]. Int J Oncol,2012,40(4):1189-1195.
[10] TARAS D,BLANC JF,RULLIER A,et al. Pravastatin reduces lung metastasis of rat hepatocellular carcinoma via a coordinated decrease of MMP expression and activity[J]. J Hepatol,2007,46(1):69-76.
[11] CLOSSET J,VAN DE STADT J,DELHAYE M,et al. Hepatocellcular carcinoma:surgical treatment and prognostic variables in 56 patients[J]. Hepatogastroenterology,1999,46(29):2914-2918.
[12] BRIVANLOU AH,DARNELL JE JR. Signal transduction and the control of gene expression[J]. Science,2002,295(5556):813-818.
[13] SHARMA RA,STEWARD WP,GESCHER AJ. Pharmacokinetics and pharmacodynamics of curcumin[J]. Adv Exp Med Biol,2007,20(5):453-470.
[14] SHIM JS,KIM DH,JUNG HJ,et al. Hydrazinocurcumin,a novel synthetic curcumin derivative,is a potent inhibitor of endothelial cell proliferation[J]. Bioorg Med Chem,2002,10(9):2987-2992.
[15] ZHANG XW,TIAN WX,CAI XZ,et al. Hydrazinocurcumin encapsuled nanoparticles “re-educate” tumor-associated macrophages and exhibit anti-tumor effects on breast cancer following STAT3 suppression[J]. PLoS One,2013. DOI:10.1371/journal.pone.0065896.
[16] TRACEY J,SUSAN J. Signal transducer and activator of transcription(STAT)signalling and T?cell lymphomas[J]. Immunology,2005,114(3):301-312.
[17] LIU YW,WANG LJ,WU YP,et al. Pterostilbene exerts antitumor activity against human osteosarcoma cells by inhibiting the JAK2/STAT3 signaling pathway[J]. Toxicology,2013,304(3):120-131.
[18] DU W,HONG J,WANG YC,et al. Inhibition of JAK2/STAT3 signalling induces colorectal cancer cell apoptosis via mitochondrial pathway[J]. J Cell Mol Med,2012,16(8):1878-1888.
[19] GROSS A,MCDONNELL JM,KORSMEYER SJ. Bcl-2 family members and the mitochondria in apoptosis[J]. Genes Dev,1999,13(4):1899-1911.
[20] WRSTLE ML,LAUSSMANN MA,REHM M. The central role of initiator caspase?9 in apoptosis signal transduction and the regulation of its activation and activity on the apoptosome[J]. Exp Cell Res,2012,318(11):1213-1220.
[21] PEREIRA MA,HERREN?FREUND SL,BRITT AL, et al. Effect of coadministration of phenobarbital sodium on N?nitrosodiethylamine?induced gamma-glutamyltransferase-positive foci and hepatocellular carcinoma in rats[J]. J Natl Cancer Inst,1984,72(7):741-744.
[22] ARIF M,VEDAMURTHY BM,CHOUDHARI R,et al. Nitric oxide-mediated histone hyperacetylation in oral cancer:target for a water-soluble HAT inhibitor,CTK7A[J]. Chem Biol,2010,17(8):903-913.
[23] EBELT J,NEID M,TANNAPFEL A,et al. Prognostic significance of proliferation markers in hepatocellular carcinoma(HCC)[J]. Zentralbl Chir,2000,125(7):597-601.
[24] KUWANO H,SUMIYOSHI K,NOZOE T,et al. The prognostic significance of the cytophotometric DNA content and its relationship with the argyrophilic nucleolar organizer regions(AgNOR) and proliferating cell nuclear antigen(PCNA)in oesophageal cancer[J]. Eur J Surg Oncol,1995,21(4):368-373.
[25] KELLOFF GJ,LIEBERMAN R,STEELE VE,et al. Chemoprevention of prostate cancer:concepts and strategies[J]. Eur Urol,1999,35(5/6):342-350.
(收稿日期:2020-06-14 修回日期:2020-10-17)
(编辑:段思怡)
