响应面法优化马克斯克鲁维酵母干燥保护剂的研究
2020-12-28王绍云陈祺琛陈新伟詹志春
周 樱,王绍云,陈祺琛,陈新伟,詹志春,吕 红
(1.复旦大学生命科学学院,上海 200433;2.武汉新华扬生物股份有限公司,湖北武汉 430206)
马克斯克鲁维酵母(Kluyveromyces marxianus)被认为是一种安全可食用的酵母,2013 年被批准为新食品原料。同时有大量研究表明,马克斯克鲁维酵母能改善肠道菌落环境,抑制有害菌生长(Nooraee 等,2010),提高机体免疫力(Kurtzman等,1997);其酵母细胞壁中的葡甘露聚糖具有吸附排除毒素的作用(Piotrowska 和Masek,2015);能消耗肠道中的乳糖,从而降低动物乳糖不耐症(Rubio,2006);提高动物对饲料中纤维素、脂质等营养物质的消化吸收(Hong 等,2007 ;Deive 等2003)。同时,马克斯克鲁维酵母还具备一般酵母菌不具有的独特优势,如其具有较快的 生 长 速 率(Groeneveld 等,2009 ;Fonseca 等,2008)和较高的生物量(Lane 等,2011),从而有利于降低生产成本;另外,其最高可在48℃的高温下正常生长(Flores 等,2000),而其他酵母菌(如酿酒酵母等)则难以耐受35℃以上的温度,这使得马克斯克鲁维酵母具有较强的适应能力,更适合于工业生产中的热风干燥,同时也更能抵抗饲料加工过程中的加热、干燥、挤压和振动而保持活性。因此,马克斯克鲁维酵母十分适合于用作饲料添加剂。
目前,关于马克斯克鲁维酵母的分子生物学、发酵工艺、应用开发等方面的研究都已有研究人员开展了相应研究,而关于其后处理制备工艺方面的研究基本没有。本研究主要对马克斯克鲁维酵母在热风干燥过程中的保护剂进行选择,采用响应面法对保护剂的组成进行优化,为以后的工业生产提供数据和参考。
1 材料与方法
1.1 材料
1.1.1 菌种 马克斯克鲁维酵母CGMCC 10621,保藏于中国微生物菌种保藏管理委员会普通微生物中心。
1.1.2 培养基及试剂
(1)YEPD 培养基:由酵母浸出物10 g,蛋白胨20 g,葡萄糖20 g,定容至1 L。固体培养基需添加20 g 琼脂。
(2)发酵培养基:每升培养基中含40 g 酵母粉和50 g 葡萄糖,pH 调为5.0。
所有培养基的灭菌条件为115 ℃下灭菌15 min。
(3)主要试剂:海藻糖购自河北林康生物科技有限公司,司盘60(Span 60)和吐温80(Tween 80)购自国药集团化学试剂有限公司。
1.1.3 试验仪器 IS-RDH1 卧式恒温振荡器,FUS30 发酵罐,XA2/500-UK 厢式压滤机,E50 单螺杆挤出机,XYT-3 流化制粒包衣机,AR2140精密分析天平,SPX-250B Ⅲ生化培养箱,YM100立式压力蒸汽灭菌器,SF-CF-1A 超净工作台。
1.2 试验方法
1.2.1 工艺流程 试管斜面菌种→三角瓶菌种→30 L 发酵罐→厢式压滤机→鲜酵母泥→加保护剂→制粒→流化床干燥
1.2.2 活菌数的测定 以YEPD 培养基为计数培养基,采用梯度稀释平板计数法进行测定。
1.2.3 Box-Behnken 优化试验设计 采响应面法优化由司盘60、吐温80 和海藻糖3 种保护剂组成的复合保护剂。以三者的添加量为试验因子,以干酵母活菌数为响应值,采用Design Expert 8.0.6 软件进行Box-Behnken 响应面试验设计和分析,试验因子水平及编码表如表1 所示,具体的试验设计如表2 所示。
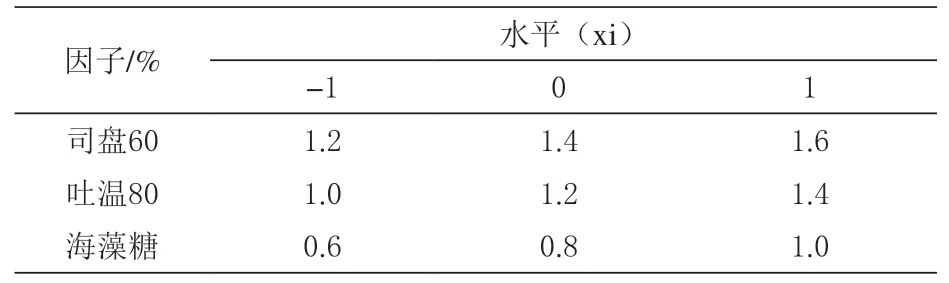
表1 Box-Behnken 设计试验因子水平及编码
1.2.4 数据统计及分析 试验数据采用Design Expert 8.0.6 软件进行响应面试验数据分析、回归模型建立及图形分析。
2 结果与分析
2.1 复合保护剂的响应面法优化酵母干燥过程中常见的保护剂主要有司盘60、吐温80 等乳化剂(Suryabhan 等,2019 ;Câmara 等,2018 ;周亚男等,2017 ;王华和贺金梅,2013 ;张建峰等,2011 ;陈毛清和赵华,2006),海藻糖、蔗糖等小分子糖类,抗坏血酸等抗氧化剂类,L-谷氨酸钠、L- 半胱胺盐酸盐等氨基酸类。经过文献对比分析和初步试验筛选,确定以司盘60、吐温80 和海藻糖为复合保护剂组分,采用响应面法对复合保护剂的配比进行优化。
以干酵母活菌数(Y)为响应值,以司盘60(A)、吐温80(B)和海藻糖(C)的添加量为试验因子,根据表2 中的试验设计方案进行试验,所得试验结果如表2 所示,相关的方差分析结果则见表3。

表2 马克斯克鲁维酵母复合保护剂的响应面优化试验设计方案及结果
根据表2 的数据进行分析,得到多元二次回归方程:Y=-1636.65+883.89A+1230.48B+1025.09C+21.88AB+160.00AC-511.88BC-349.00A2-347.13B2-252.75C2。
如表3 所示,回归模型的F 值为26.82,P 值=0.0001 <<0.01,而失拟项P=0.7721 >0.05,说明上述回归方程拟合良好,所建立的模型极显著,因此,可用其对响应值Y(干酵母活菌数)进行分析和预测。此外,该模型的决定系数R2=0.9718 表示此模型能在97.18% 程度上解释响应值Y 与各变量因子之间的关系;同时,调整决定系数R2adj=0.9356,与R2的值接近,且均接近于1,进一步说明两者相关性很好,模型拟合程度高。模型变异系数(coefficient of variation,CV)是衡量模型精密度和可靠性的重要评价指标,数值越小表示模型精密度越高(肖怀秋等,2017),本模型CV=3.73%,表明此模型的精密度和可靠性较高,可用于分析响应值的变化。综上可知,由该模型得到的预测值与实际值可保持较高的一致性。
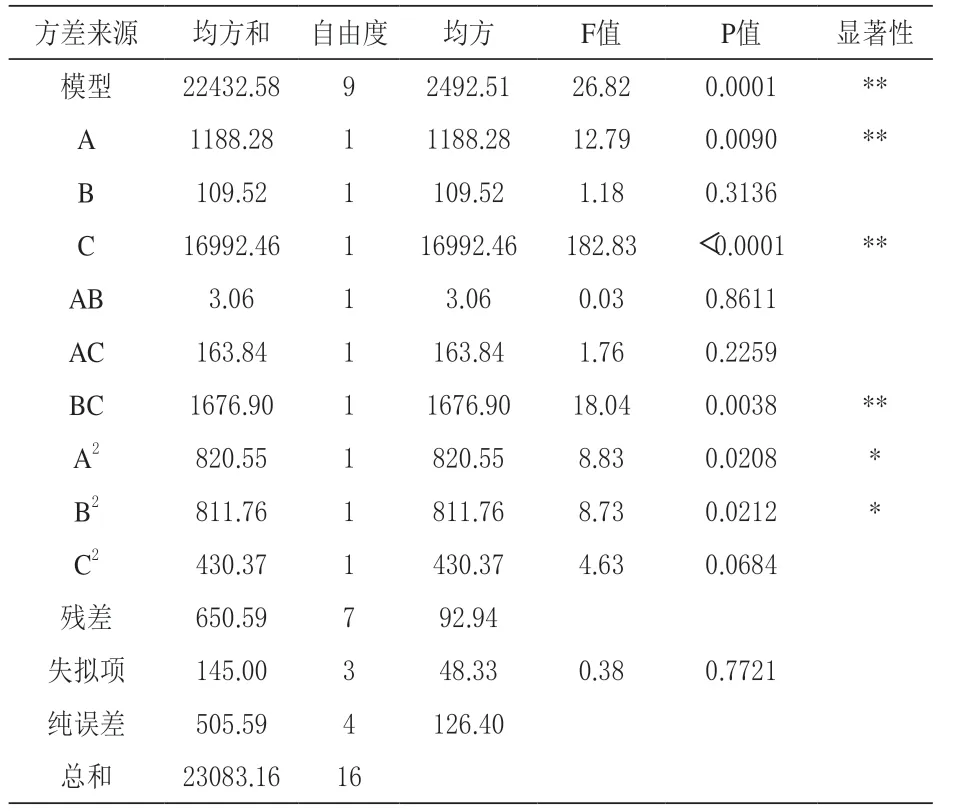
表3 马克斯克鲁维酵母复合保护剂的回归模型方差分析表
从P 值来看,模型中的一次项A、C、交互项BC 对干酵母活菌数的影响极显著(P <0.01);二次项A2、B2的影响显著(P <0.05);其他项的影响均不显著。同时,各试验因子的F 值反映了该试验因子对响应值的影响程度,若F 值较高,该试验因子对响应值的影响较大(Prabhu等,2017)。 由 表3 可 知,FA=12.79,FB=1.18,FC=182.83,因此,这3 个因素对干酵母中活菌数的影响大小顺序为:C >A >B,即海藻糖对马克斯克鲁维酵母干燥影响最大,其次为司盘60,吐温80 的影响最小。张建峰等(2011)在优选酿酒活性干酵母(AADY)生产中所用的干燥保护剂时发现,海藻糖的保护效果最佳,吐温80 和司盘60 其次。郭蓉(2013)采用单因素试验筛选低高级醇刺葡萄酒酵母菌的干燥保护剂时也获得了相同的试验结果。
根据得到的回归模型,利用Design-Expert 软件绘制出不同因子的响应曲面图,图1 分别表示海藻糖(C)、吐温80(B)、司盘60(A)取零水平时余下的两个因子对干酵母活菌数的影响。
响应曲面的陡峭程度表示变量因子对响应值影响的大小,由图1 可见,海藻糖对马克斯克鲁维干酵母活菌数的影响极显著,司盘60 其次,而吐温80 的影响不显著。而从等高线图来看,只有吐温80 和海藻糖添加量的交互作用对干酵母活菌数的等高线图为明显的椭圆形,表明二者的交互作用显著。
采用Design-Expert 软件对该模型进行分析,得到马克斯克鲁维酵母热风干燥复合保护剂的最 佳 配 比 为:1.44% 司 盘60、1.08% 吐 温80 和1.00% 海藻糖,相应的最高活菌数为3.203×1010CFU/g。为实际应用方便,可将该保护剂的最佳添加比例调整为1.45% 司盘60、1.05% 吐温80 和1.0%海藻糖。该比例与表3 中的第6 组试验(1.4%司盘60、1.0% 吐温80 和1.0% 海藻糖)的保护剂比例非常接近,试验组6 的活菌数为3.188×1010CFU/g,与预测值基本相同,表明该试验设计方法可用于马克斯克鲁维酵母热风干燥中的复合保护剂的优选。
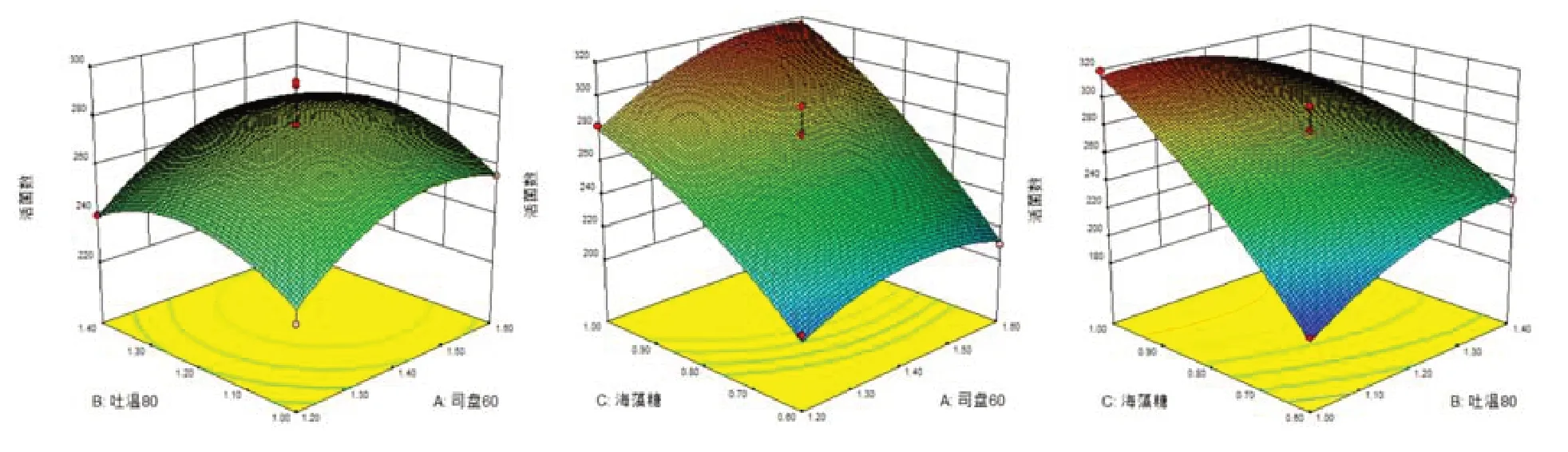
图1 海藻糖、吐温80 和司盘60 添加量的交互作用对干酵母活菌数的影响的响应曲面图和等高线图
3 结论
通过对马克斯克鲁维酵母保护剂的研究发现,司盘60、吐温80 和海藻糖在马克斯克鲁维酵母热风干燥过程中具有较好的保护作用。采用响应面法优化马克斯克鲁维酵母复合保护剂,得到最优的复合保护剂为:司盘60 质量分数为1.45%,吐温80 为1.05%,海藻糖为1.0%,在此保护剂作用下,马克斯克鲁维干酵母活菌数可达到3.2×1010CFU/g,与实际试验结果相符,表明该模型具有应用意义,对马克斯克鲁维活性干酵母的工业化生产具有一定的指导作用。
