基于网络药理学肝脂溶颗粒治疗2型糖尿病合并脂肪肝的分子机制
2020-12-24杨永刚李庆杰张泽鹏刘扬扬
杨永刚 李庆杰 张泽鹏 刘扬扬
(1长春中医药大学附属医院,吉林 长春 130000;2长春中医药大学附属医院实验中心;3长春中医药大学附属医院科研办公室)
近年来,2 型糖尿病(T2DM)合并非酒精性脂肪肝(NAFLD)患者显著增高,超过76%的T2DM 患者患有NAFLD〔1〕,而NAFLD 患者T2DM 或空腹血糖损害的发生率高达18%~33%〔2〕。T2DM与NAFLD可相互促进,并形成恶性循环,从而加速疾病进展〔3〕。NAFLD 致使T2DM 患者大血管和微血管并发症患病率显著增加〔4〕,二者并存导致内分泌代谢紊乱加重、心血管疾病患病风险及全因死亡或肝病相关死亡风险显著增加〔5〕。
肝脂溶颗粒是长春中医药大学终身教授刘铁军在其导师全国首届国医大师任继学教授的指导下创立的治疗NAFLD的经验方,自1996 年作为院内制剂应用20余年,经过410例临床试验验证,肝脂溶颗粒对肝功能、血脂、血糖等多项指标均有改善作用。本文借助网络药理学从系统生物整体角度来探究肝脂溶颗粒治疗T2DM合并NAFLD的作用机制。
1 资料与方法
1.1肝脂溶颗粒网络药理学与药效物质基础研究 整理肝脂溶颗粒及肝脂溶颗粒各组方药材化学成分,建立肝脂溶颗粒化学成分数据库,并通过UHPLC-Q-TOF/MS 对肝脂溶颗粒提取物中化学成分的鉴别。根据已明确的肝脂溶颗粒化学物质组,构建肝脂溶颗粒小分子化合物结构数据库。在已知数据库中查询NAFLD、胰岛素抵抗等靶点,筛选与肝脂溶颗粒相关的作用靶点,构建肝脂溶颗粒“成分-靶标”网络图并进行分析。
1.2细胞实验 ①药品与试剂:肝脂溶颗粒(由黄芪、葛根、泽泻、丹参、大黄等组成),长春中医药大学附属医院提供,人肝癌细胞(HepG2)细胞株购自武汉大学细胞保藏中心,胰岛素(Sigma 公司),DMEM培养基、胎牛血清(北京索莱宝科技有限公司),牛血清白蛋白(BSA)、胰蛋白酶(Gibco公司),葡萄糖氧化酶检测试剂盒(中生北控生物科技股份有限公司),葡萄糖激酶(GCK)酶联免疫吸附试验(ELISA)试剂盒(郑州鼎国生物技术有限公司),总蛋白提取试剂盒、二喹啉甲酸(BCA)蛋白测定试剂盒(上海碧云天公司),余试剂为分析纯。②细胞培养及胰岛素抵抗模型:将 Hep G2 细胞培养在含5%胎牛血清的DMEM培养基(含1%的青霉素和 链霉素)中,在 37℃、5% CO2、95%湿度培养箱中培养,取对数生长期的细胞用于实验。将 Hep G2 细胞置于含1×10-7mol/L胰岛素(实验组)诱导36 h〔6〕。③细胞存活率检测:选取不同浓度的药物(0、5、10、20、40、80、120、160、200、240 μg/ml)处理细胞24 h后进行MTT实验。④实验分组与干预:实验分为正常组、模型组、肝脂溶颗粒低浓度组、肝脂溶颗粒高浓度组。将 HepG2 细胞用含 10% 胎牛血清的 DMEM 培养基接种于 96 孔板,待细胞完全贴壁后,将培养基吸出换上含0.2% BSA的DMEM 培养基继续孵育,12 h后即细胞适应无血清的环境后再将培养基移出。正常组加入0.2%BSA的DMEM培养基;模型组加入含胰岛素浓度 10-6mol/L,0.2%BSA的DMEM培养基培养48 h;待胰岛素抵抗模型建立后,于模型组换上无胰岛素 0.2%BSA培养基,给药组分别在模型组的基础上给予肝脂溶颗粒20、80 μg/ml干预36 h。⑤葡萄糖消耗实验:将HepG2细胞培养36 h后,吸取培养液用葡萄糖氧化酶法检测培养液中的葡萄糖含量,用空白孔中的葡萄糖含量减去其余各孔的葡萄糖含量即为各孔36 h的葡萄糖消耗量(GC)。葡萄糖消耗检测完毕后,用每孔加入MTT溶液(5 mg/ml)20 μl,37℃继续培养4 h,吸出培养液,每孔加入150 μl 二甲基亚砜(DMSO),震荡10 min,使结晶物完全溶解。以DMSO调零,用酶标仪在490 nm下测定各孔吸光度(OD)值,以监测细胞的数目与活力通过计算 GC/MTT 可以消除细胞增殖对培养液中葡萄糖消耗的误差。⑥FOXO1 表达检测:选用低浓度20 μg/ml和高浓度80 μg/ml肝脂溶颗粒药物处理细胞24 h,随后收取细胞进行Western印迹检测FOXO1蛋白水平及rt-qPCR检测FOXO1转录水平的变化。
2 结 果
2.1通过检索中医药成分数据库(TCMSP/TCMID/TCM Database@Taiwan),建立本方成分数据库 应用IPA、OMIM、NCBI等数据库检索疾病靶点,并建立数据库,应用DAVID完成主要功能靶点预测,建立成分与靶点之间的预测关系,通过Omicshare平台,完成预测通路的富集分析高级气泡图。网络药理学结果推测肝脂溶颗粒治疗T2DM合并NAFLD的潜在靶点,发现其可调控FOXO通路中41个相关靶点。见图1~3。
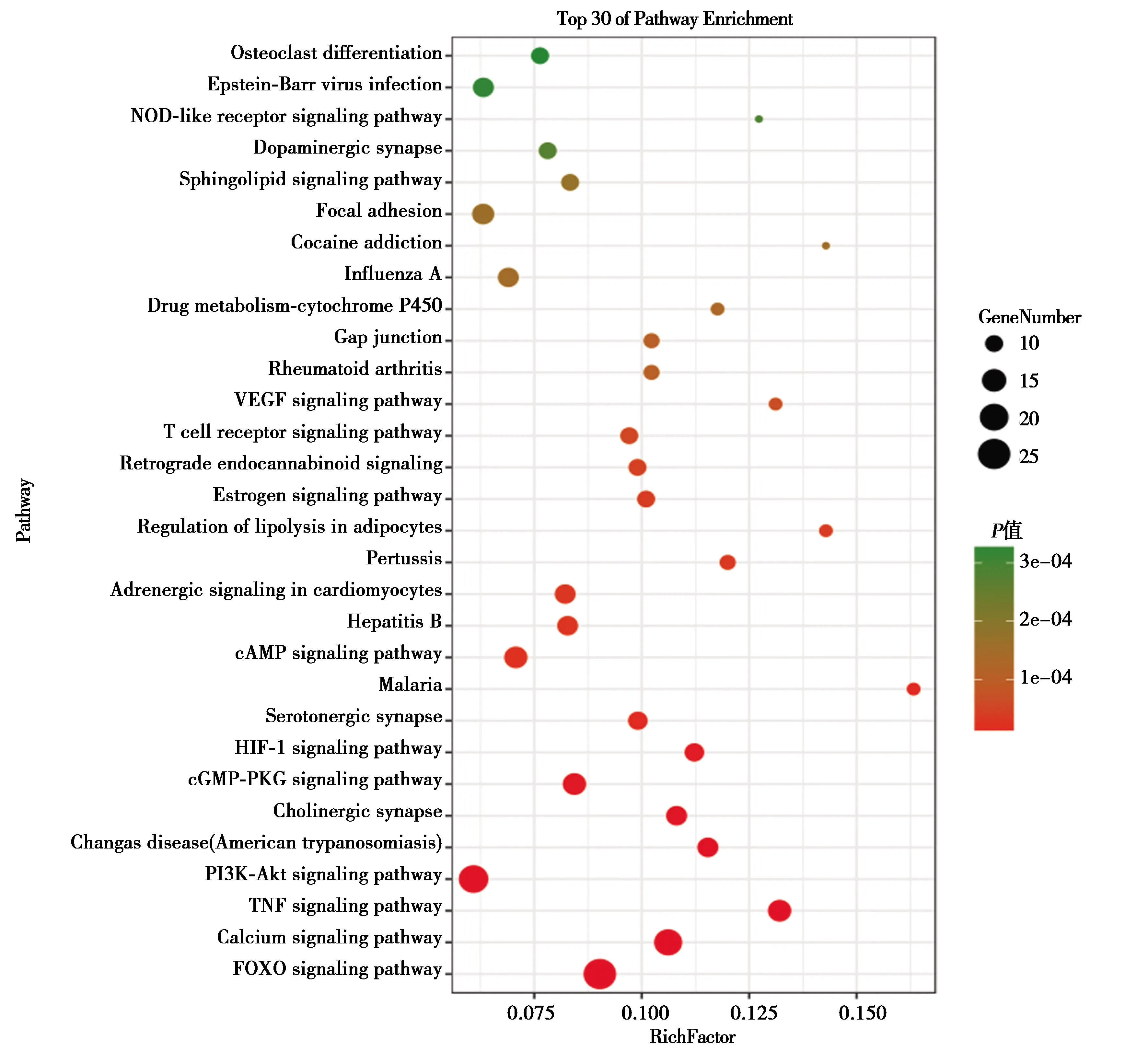
图1 高级气泡图显示肝脂溶颗粒的潜在KEGG通路,前30项潜在通路

图2 通过网络药理学的靶点预测及富集分析得出肝脂溶颗粒对FOX信号通路具有调控作用
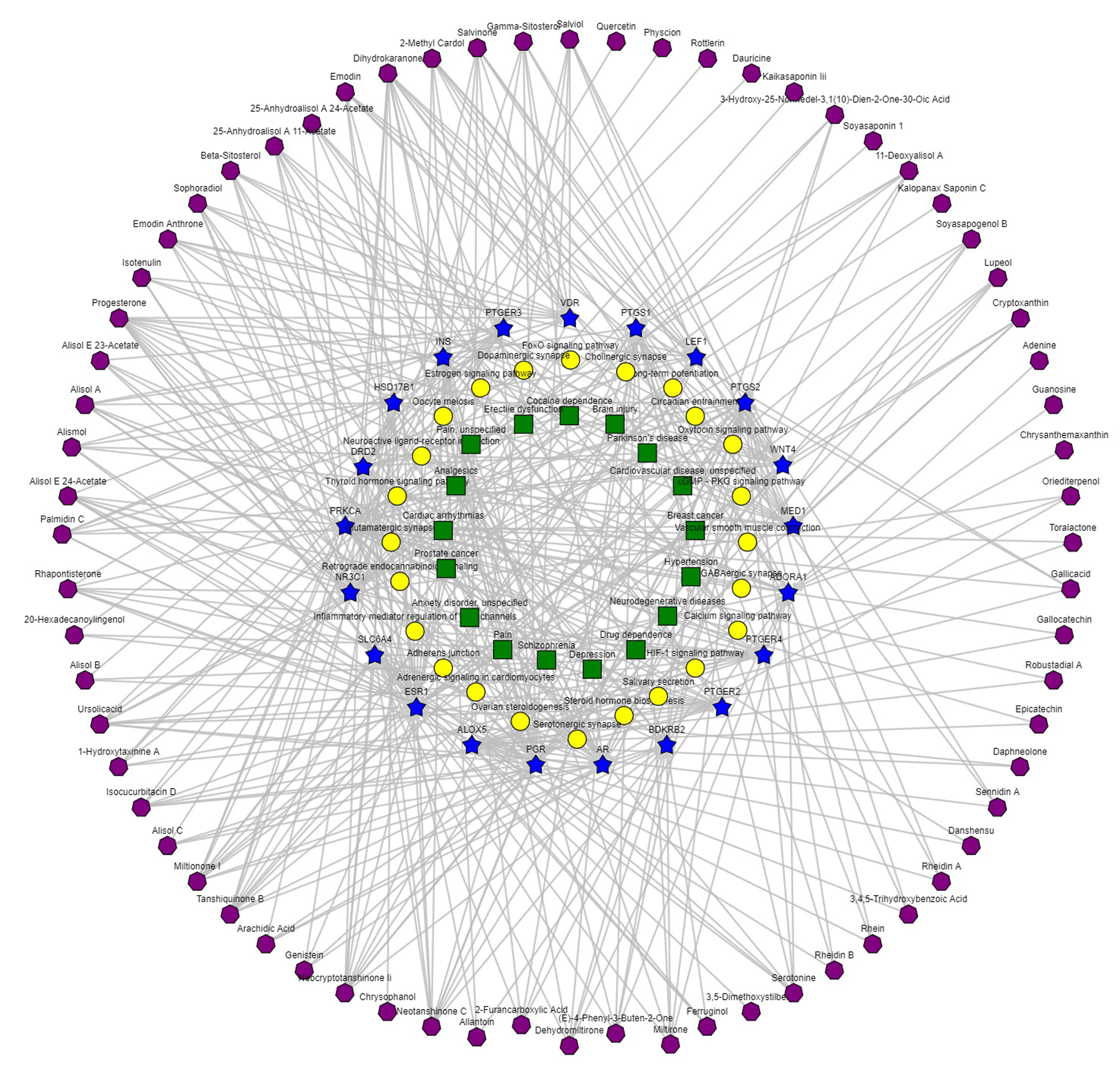
图3 肝脂溶颗粒的疾病靶点网络
2.2肝脂溶颗粒不同处理时间对 HepG2细胞葡萄糖消耗量的影响 HepG2细胞葡萄糖消耗量随肝脂溶颗粒时间增加而降低。肝脂溶颗粒作用于HepG2细胞的最佳时间点为24 h。见表1。
表1 不同浓度胰岛素作用不同时间人源肝癌HepG2细胞葡萄糖消耗量
2.3MTT法检测肝脂溶颗粒对HepG2细胞的毒性作用 0~80 μg/ml的药物浓度对细胞的毒性较小。因此选用低浓度20 μg/ml和高浓度80 μg/ml进行后续实验。见图4。

图4 不同浓度肝脂溶颗粒对HepG2细胞的毒性作用
2.4肝脂溶颗粒药物调控胰岛素抵抗HepG2细胞的葡萄糖摄入量 对照组葡萄糖消耗量为0.104±0.099,模型组为0.536±0.042,肝脂溶颗粒低浓度组为0.733±0.057,高浓度组为0.816±0.077;药物处理组一定程度上缓解了胰岛素抵抗模型组的葡萄糖摄入水平。
2.5肝脂溶颗粒药物通过FOXO1调控HepG2细胞葡萄糖代谢 FOXO1 mRNA水平在模型组和药物处理组中都没有变化。但其蛋白水平在模型组中高表达,药物处理后表达下调。推测肝脂溶颗粒通过翻译后途经调控FOXO1的蛋白水平调控肝脏中糖原合成,进而调控葡萄糖代谢从而治疗糖尿病。见图5。通过软件分析FOXO1免疫印迹的光密度值,证明加药处理后细胞内FOXO1的表达量上升20%。
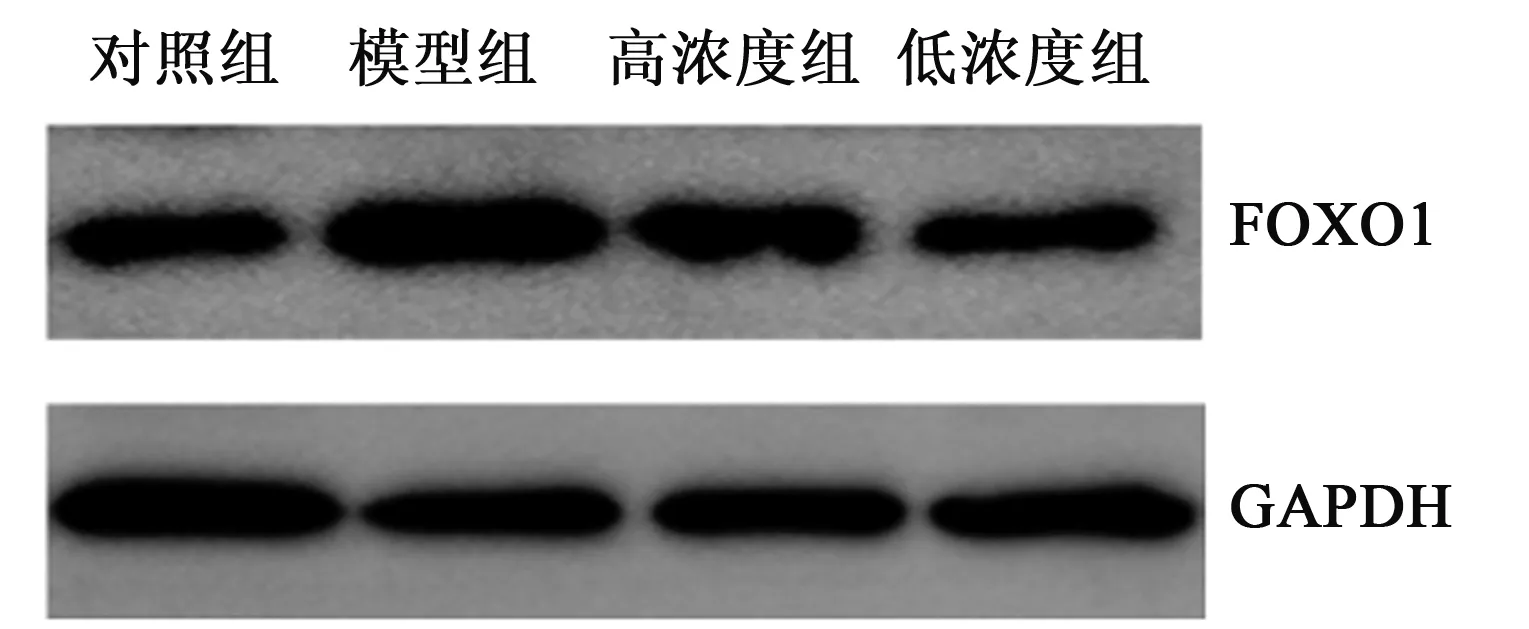
图5 肝脂溶颗粒通过翻译后修饰途径调控FOXO1的蛋白水平
3 讨 论
脂肪肝从中医角度认为是全身的津液输布、运化失常,与人的先天禀赋、体质及后天调摄不当有关,肝郁脾虚、痰湿内聚、化为肥膏,属于气血津液病范畴,乃本虚表实之病,以肝郁脾虚为本,湿、热、瘀、积为标,最终形成“脂毒”。遵循《素问至真要大论》“坚者消之”、“结者散之”、“逸者行之”、“衰者补之”的法则,强调肝脾同调、湿热瘀积同治,而从湿、热、瘀、积论治NAFLD,以清热利湿、化瘀消积为基本治法〔7,8〕。在上述治法的基础上,独创性的根据“六腑以通为用”经典理论及吴又可“逐邪勿拘结粪”学说,将中医下法与现代医学肠肝循环理论结合,体现了传统继承观与时代发展观相结合的鲜明特点,将毒性物质(脂毒等)从肠道排除,切断肠肝循环,改善糖脂代谢、炎症反应,进而减轻或控制肝病的发展〔9〕。网络药理学是理解中药方剂复杂化学体系与病证复杂生物系统的相互作用的科学方法〔10〕。其结合系统生物学、药理学和计算机技术等多学科技术,与中药多成分-多靶点-多途径作用特征相吻合,在深入揭示中药作用机制的研究中已经越来越受到研究者的重视〔11,12〕。网络药理学的方法与中医药的思维有相同之处,因此网络药理学对于研究中医药的机制具有一定优势。肝脂溶颗粒的主要组成包括黄芪、葛根、大黄、泽泻、丹参等。现代药理学证实黄芪、葛根、大黄等都具有降低血糖、改善胰岛素抵抗的作用。FOXO1是肝脏监测血液中胰岛素水平与糖脂代谢的传感器〔13〕。FOXO1广泛参与调控β细胞的增殖、分化、自噬及线粒体功能等多种信号通路的调控,在胰岛细胞功能稳态中也发挥重要作用〔14〕。T2DM主要的发病机制是胰岛素抵抗,是靶器官如肝脏、肌肉及脂肪等对胰岛素的敏感性下降。肝脏是糖代谢的核心器官,能通过糖异生作用调节血糖输出,肝脏糖异生紊乱导致的肝糖输出增多是肝脏胰岛素抵抗发生的重要诱因〔15〕。研究表明,胰岛素抵抗在NAFLD 发展中起重要作用,胰岛素抵抗被认为是NAFLD 的首要症状〔16,17〕。本实验结果表明,在网络药理学结果中可以看出肝脂溶颗粒治疗T2DM合并NAFLD的潜在靶点,发现其可调控FOXO通路中41个相关靶点。在细胞试验中证实FOXO1的表达量与细胞对胰岛素的敏感性存在规律性的负相关。在发生胰岛素抵抗的HepG2 细胞里,FOXO1 基因及蛋白表达均显著增加。因此,肝脂溶颗粒治疗T2DM合并NAFLD是通过调控FOXO1蛋白而实现的,这也为中药治疗T2DM 合并NAFLD 提供新思路。
