miR-29a通过调控DNMT3b对宫颈癌细胞周期、凋亡及P16甲基化的影响
2020-12-24白志兴青海红十字医院妇产科青海西宁810000
白志兴 (青海红十字医院妇产科,青海 西宁 810000)
宫颈癌是常见妇科恶性肿瘤之一,其发病率和死亡率居生殖系统肿瘤首位,且近年来发病呈年轻化趋势〔1〕。目前对于宫颈癌的治疗手段主要为根治性手术和放化疗,治疗过程中的不良反应严重影响患者的生活质量〔2〕。因此,研究宫颈癌发生的分子机制对于寻找治疗宫颈癌的基因靶点十分重要。研究发现,癌基因区启动子异常甲基化与肿瘤的发生、发展密切相关〔3〕。微小RNA(miR)可通过与靶基因3′-UTR区结合参与机体细胞增殖、凋亡等生理过程〔4〕。研究表明,miR-29a在非小细胞肺癌〔5〕、宫颈癌〔6〕等恶性肿瘤组织中异常表达,在前列腺癌疾病中可调控去甲基化基因表达发挥抑癌作用〔7〕。通过在线软件预测发现,DNA甲基转移酶(DNMT)3b是miR-29a的靶基因。本研究通过检测宫颈癌组织中miR-29a表达,并分析其对宫颈癌细胞周期、凋亡及P16甲基化的影响,为宫颈癌防治寻求有效的干预靶点提供思路。
1 材料与方法
1.1材料 细胞、HcerEpic人正常子宫颈上皮细胞,Hela、SiHa、MS751人宫颈癌细胞系均购自美国典型培养物保藏中心。主要试剂与仪器: miR-29a mimics及阴性对照mimics-NC购自上海生工生物工程股份有限公司; miR-29a 与内参基因U6基因引物由上海生工生物工程股份有限公司合成;葡萄糖、胎牛血清、二甲基亚砜、DMEM培养基均购自美国ThermoFisher公司;Trizol试剂、反转录试剂盒、荧光定量聚合酶链反应(qRT-PCR)试剂盒、MTS细胞生长增殖检测试剂盒、细胞凋亡检测试剂盒购自美国sigma公司;蛋白提取试剂盒、二喹啉甲酸(BCA)试剂盒均购自上海碧云天公司;LipofectamineTM3000脂质体转染试剂盒购自美国Invitrogen公司;双荧光素酶报告基因检测试剂盒购自美国Promega公司;Anti-DNMT3b、Anti-GAPDH均购自上海钰博生物科技有限公司。 流式细胞仪购自美国贝克曼库尔特公司;CO2培养箱购自日本sanyo公司;酶标仪购自Bio-Rad公司;普通光学显微镜,购自美国Olympus 公司。
1.2细胞培养和转染 细胞培养:将复苏后的HcerEpic人正常子宫颈上皮细胞、Hela、SiHa、MS751人宫颈癌细胞转入含10%胎牛血清的DMEM培养基内(100 mg/L链霉素,100 kU/L青霉素),37℃,5% CO2培养,2~3 h后收集对数生长期细胞。qRT-PCR法检测各组细胞miR-29a相对表达量。
细胞转染及分组:对数生长期的细胞消化后接种于6孔细胞板(1×106个/孔),当细胞融合至70%~80%时,按照LipofectamineTM3000转染试剂盒说明书转染,实验分组:miR-29a过表达组(mimics)组,转染终浓度为100 nmol/L,miR-29a mimics序列为5′-GTGGAGGGTCCGAGGT-3′;miR-29a阴性对照(NC)组,转染终浓度为100 nmol/L,miR-29a mimics-NC序列为5′-CGCTTCGGCAGCACATATACTAA-3′;空白对照组(BC)不进行转染。转染48 h后,qRT-PCR法检测转染效率,筛选出稳定表达miR-29a细胞,培养48 h后,收集细胞检测。qRT-PCR法检测各组细胞miR-29a相对表达量。
1.3CKK-8法检测细胞增殖情况 将稳定表达miR-29a的细胞接种至96孔板(5.0×104个/孔),培养箱培养,分别于0、12、24、36、48、60、72 h后,按照说明书操作,加入CKK-8试剂,酶标仪(450 nm)检测细胞光密度(OD),绘制生长曲线。
1.4流式细胞仪检测细胞凋亡情况 胰蛋白酶消化转染后的各组细胞,经离心后收集、洗涤,加入annexin V-FITC及碘化丙啶(PI)溶液,4℃避光孵育10 min后,上机检测细胞凋亡率。FITC+/PI-为凋亡细胞,FITC-/PI-为活细胞,FITC+/PI+为坏死细胞,FITC-/PI+为机械损伤坏死细胞。细胞凋亡率=(凋亡细胞数/总细胞数)×100%。其中,第1象限为机械性损伤细胞,第2象限为坏死细胞,第3象限为活细胞,第4象限为凋亡细胞。
1.5流式细胞仪检测细胞周期变化 胰蛋白酶消化转染后的各组细胞,经离心后收集、洗涤,磷酸盐缓冲液(PBS)重悬,加入无水乙醇达到中浓度70%,固定细胞,4℃过夜,离心、洗涤后,PBS重悬,4℃避光反应30 min,流式细胞仪检测细胞周期,计算各组细胞G0/G1期、S期、G2/M期细胞所占百分比。
1.6甲基化特异性PCR(MSP)法检测细胞P16基因CpG岛甲基化状态 提取DNA,变性、纯化后,根据试剂盒说明书进行MSP-PCR,检测P16基因甲基化情况。MSP扩增后,甲基化:出现甲基化条带,无非甲基化条带;非甲基化:出现非甲基化条带,无甲基化条带;半甲基化:同时出现甲基化和非甲基化条带。
1.7Western印迹检测DNMT3b、p16 蛋白表达 收集1.2转染后稳定表达miR-29a的细胞,提取总蛋白,利用BCA试剂盒测定蛋白总量,利用Western印迹实验检测DNMT3b蛋白水平。
1.8荧光素酶报告基因检测miR-29a对DNMT3b的调控 在线软件TargetScan显示人miR-29a可能与DNMT3b基因3′UTR区域结合,对含有该结合位点的DNMT3b基因3′UTR进行扩增,连到PGEM-T载体上,测序筛选,酶切连接至pGL4荧光素酶报告载体,构建野生型p-GL4-DNMT3b-wt和突变型p-GL4-DNMT3b-mut报告基因质粒。取1.2培养细胞于48孔板,24 h细胞贴壁后,将miR-29a mimics、miR-29a mimics-NC与pGL4、含荧光素酶报告基因p-GL4-DNMT3b-wt、p-GL4-DNMT3b-mut共转染,24 h后,PBS漂洗,加入Passive lysis buffer裂解后,加入96孔板,在GloMax检测仪检测。
1.9统计学分析 采用SPSS20.00统计软件进行t检验。
2 结 果
2.1miR-29a在子宫颈癌细胞中的表达 子宫颈癌细胞SiHa(0.61±0.07)、Hela(0.53±0.04)、MSP175(0.69±0.08)中miR-29a的相对表达水平均较正常宫颈细胞HcerEpic(1.05±0.15)显著降低,差异有统计学意义(P<0.05)。
2.2miR-29a在 mimics转染宫颈癌Hela细胞后相对表达量 miR-29a mimics转染后,mimics组(13.25±0.86)Hela细胞中miR-29a的相对表达水平显著高于NC组(0.98±0.03)和BC组(0.96±0.02),差异有统计学意义(P<0.05)。
2.3流式细胞仪检测Hela细胞凋亡情况 mimics组(15.85±0.38)Hela细胞凋亡率较NC组(0.87±0.03)和BC组(0.85±0.02)显著升高(P<0.05)。见图1。
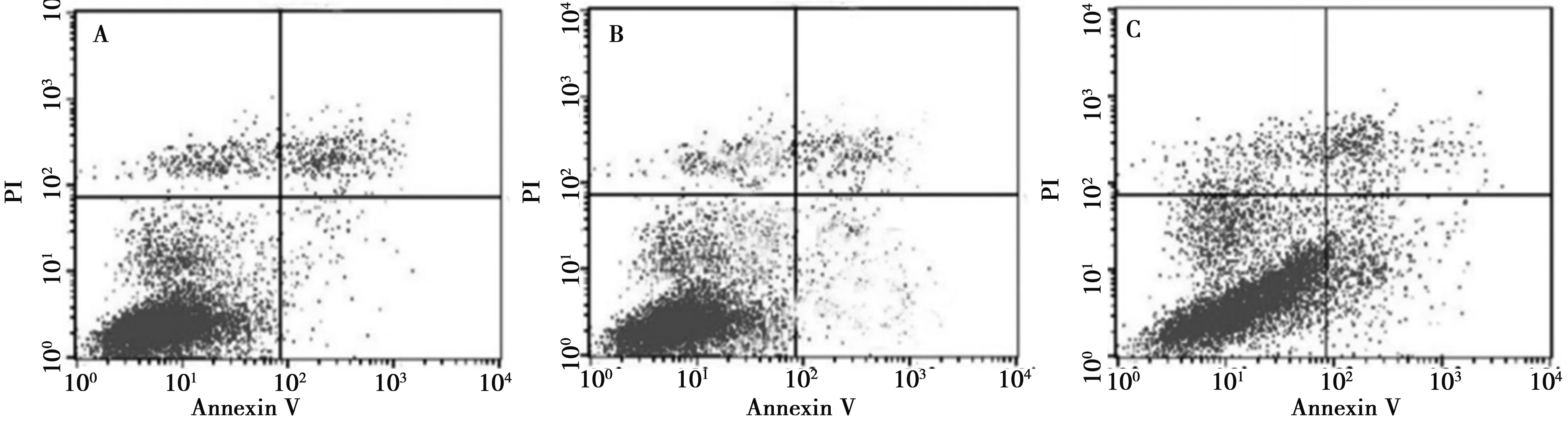
图1 细胞凋亡情况比较
2.4Hela细胞周期变化 流式细胞检测结果显示,mimics组G0/G1期细胞比例较NC组和BC组显著升高(P<0.05);3组S期及G2/M期细胞比较,差异无统计学意义(P>0.05)。见图2,表1。
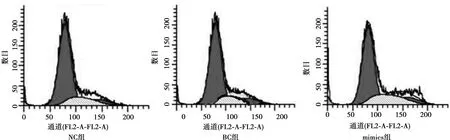
图2 Hela细胞周期变化
表1 3组细胞周期比较
2.5MSP法检测细胞P16基因CpG岛甲基化状态 mimics组Hela细胞P16基因CpG岛甲基化率显著低于NC组和BC组(P<0.05)。见图3。

U:非甲基化;M甲基化图3 MSP法检测细胞P16基因CpG岛甲基化
2.6Western印迹检测DNMT3b、p16 蛋白表达 mimics组Hela细胞中DNMT3b蛋白表达量显著低于NC组和BC组(P<0.05),p16 蛋白表达量显著高于NC组和BC组(P<0.05)。见图4,表2。
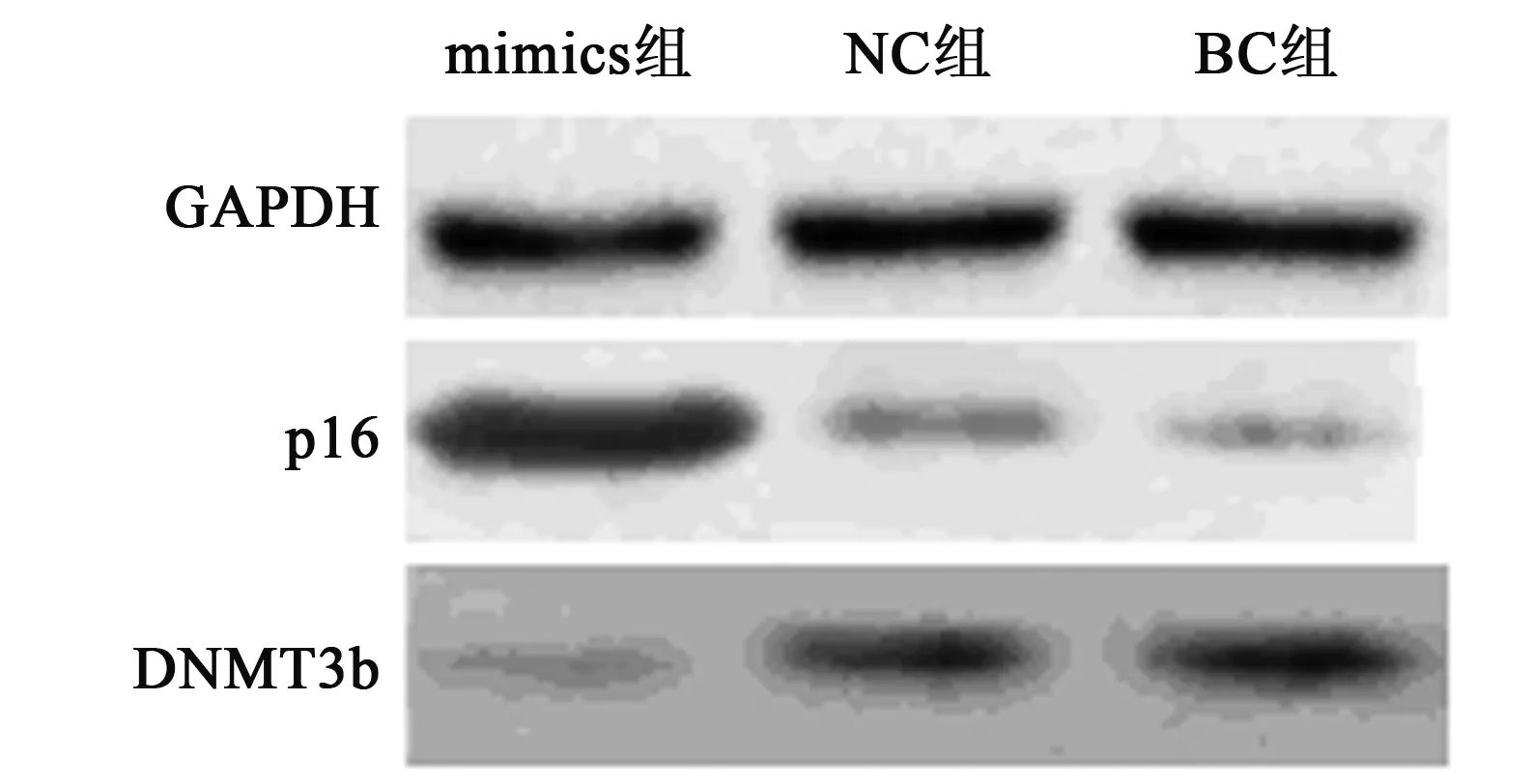
图4 Western印迹检测DNMT3b、p16 蛋白表达

表2 3组DNMT3b、p16 蛋白表达
2.7荧光素酶报告基因检测miR-29a对DNMT3b的调控 miR-29a mimics+p-GL4组荧光素酶活性强度(1.05±0.06)与miR-29a NC+p-GL4组(1.09±0.06)比较差异无统计学意义(P>0.05);miR-29a mimics+p-GL4-DNMT3b-wt组荧光素酶活性强度(0.42±0.01)较miR-29a NC+p-GL4-DNMT3b-wt组(0.92±0.04)显著降低(P<0.05);miR-29a mimics+p-GL4-DNMT3b-mut组荧光素酶活性强度(0.85±0.02)与miR-29a NC+p-GL4-DNMT3b-mut组(0.87±0.03)差异无统计学意义(P>0.05)。
3 讨 论
miR通过参与基因转录后调控在肿瘤的发生、发展中发挥重要作用。miR-29a在前列腺癌〔7〕、宫颈癌〔6〕肿瘤组织及细胞中表达水平降低。Hayes等〔8〕研究发现,过表达miR-29a可显著抑制肝癌细胞生长。过表达miR-29a可抑制乳腺癌细胞增殖及迁移,提示miR-29a低表达可能参与乳腺癌肿瘤的发生与发展〔9〕。miR-29a在宫颈癌组织中表达下调,通过多种途径发挥抗癌作用。Hela细胞中,miR-29a表达水平与抗癌基因p53活性负相关,过表达miR-29a可诱导p53依赖的细胞凋亡〔10〕。本研究结果表明转染效果较好,提示过表达miR-29a可显著抑制Hela细胞增殖,诱导细胞凋亡。进一步研究发现,过表达miR-29a可使细胞被阻滞在G0/G1期。抑癌基因启动区CpG岛高甲基化可能与宫颈癌发生有关〔11〕。P16基因在胃癌〔12〕、肝癌〔13〕等肿瘤中作为抑癌基因发挥作用,被称为肿瘤抑制基因,其功能产物P16蛋白可负向调节细胞周期,阻止细胞进入DNA合成期,P16基因失活则会引起细胞增殖失控。在宫颈癌中,P16基因主要失活形式为CpG岛甲基化。宫颈癌肿瘤细胞P16 CpG岛甲基化发生率较宫颈炎组织细胞显著升高〔14〕。多个研究显示,DNMT3b表达水平升高与CpG岛高甲基化正相关,DNMT3b可通过促进DNA高甲基化参与肿瘤发生、发展〔15,16〕。本研究结果提示过表达miR-29a可提高Hela细胞p16 蛋白水平。进一步研究提示过表达miR-29a可显著减少P16 CpG岛甲基化。
利用在线软件TargetScan对miR-29a靶基因预测发现,DNMT3b是miR-29a靶基因。DNMT3b是机体内重要的从头甲基化酶,可将DNA链中的C5胞嘧啶甲基化。DNA甲基化可沉默基因表达,而去甲基化则激活基因表达。DNMT在基因甲基化中发挥作用。研究表明,DNMT3b在膀胱癌〔17〕、肝癌〔18〕、乳腺癌〔19〕等多种肿瘤中表达水平升高。因此干扰DNMT3b蛋白表达,影响肿瘤细胞DNA的甲基化状态,已成为新的癌症靶向治疗研究热点。已有研究发现,转染siRNA干扰DNMT3b表达可显著抑制肝癌细胞生长及迁移,且能诱导肝癌细胞的凋亡〔20〕。另有研究表明,在肺癌细胞中过表达miR-29a可抑制DNMT3b mRNA及蛋白表达,从而重新激活因DNA甲基化而沉默的抑癌基因,抑制肿瘤生长,发挥抗癌作用〔21〕。本研究结果提示过表达miR-29a可能抑制DNMT3b表达。进一步研究提示miR-29a可靶向调控DNMT3b基因表达,过表达miR-29a可抑制DNMT3b基因转录和翻译。
