淫羊藿苷通过调节Nrf2/HO-1信号通路减轻大鼠肾缺血再灌注损伤①
2020-12-24陈明霞张娟红陆卫红
陈明霞 张 恩 刘 芳 张娟红 陆卫红 冷 伟
(陕西中医药大学,咸阳 712000)
肾缺血再灌注损伤(renal ischemia-reperfusion injury,RIRI)是指肾脏缺血一段时间后血液回流到组织而引起的组织损伤,导致细胞蛋白、脂质和DNA严重损伤,引起氧化应激、炎症,最终导致细胞凋亡和坏死。RIRI是术后急性肾功能不全的主要原因之一,对患者的预后不利,导致肾衰竭, 甚至危及生命。RIRI的病理生理过程复杂,目前尚无有效治疗方法。因此本研究将开发新的用于RIRI治疗的药物并研究其分子机制。
淫羊藿又名仙灵脾、刚前,是一种治疗骨质疏松症、心血管功能障碍、改善神经功能和性功能的中草药,为多年生草本植物[1]。《神农本草经》记载淫羊藿具有滋阴补阳、壮阳强身之效。淫羊藿苷(Icariin,ICA)为淫羊藿活性成分的提取物,具有强大的心血管保护功能,可抗动脉粥样硬化、改善血管内皮功能障碍[2-5]。研究发现,ICA对新生儿心肌细胞缺氧复氧损伤具有保护作用,但在RIRI中的作用研究鲜有报道[6]。因此,本研究借助RIRI大鼠模型,研究ICA对RIRI的保护作用,及其分子机制。
1 材料与方法
1.1材料
1.1.1动物 SPF级SD大鼠40只,雌雄不限,取自我院动物中心,许可证号:SYXK(川)2018-213,体质量200~230 g。于(23±3)℃、湿度40%~70%条件下适应性饲养7 d,自由摄食饮水,昼夜节律12 h。
1.1.2试剂 ICA(110737-201516)购自中国食品药品检定研究院,含量94.2%;生理盐水(merck-millipore,02-0780-00);水合氯醛(经科公司,JKLN006718);染色液(古朵,GD-K4042);PBS(Miltenyi,DXT-130-070-525);ELISA试剂盒(westang,f00001);MDA检测试剂盒[jingkang,JK-(a)-2197];SOD检测试剂盒[jingkang,JK-(a)-2293];TUNEL染色酶(Roche,11767305001);蛋白酶K(源叶,S10085);DAPI(源叶,S19119);RIPA裂解液(源叶,R12135);脱脂奶粉(源叶,S30865);抗体Cleaved Caspase-3(Asp175)Antibody #9661、Cleaved Caspase-9(Asp315)(D8I9E)Rabbit mAb #20750、NRF2(D1Z9C)XP® Rabbit mAb #12721、HO-1(E9H3A)Rabbit mAb(Mouse Specific)#86806、NQO1(A180)Mouse mAb #3187购自CST公司。
1.1.3仪器 生物安全柜(鑫贝西,11228 BBC86);生物显微镜(意大利OPTIKA,B-510BF);生化分析仪(科华卓越,LFF-LC-1817);酶标仪(QIAGEN,9232933);玻璃匀浆器-Glass Homogenizer(Ybscience,YB101103-1);倒置荧光显微镜(mshot,MF52);凝胶成像系统(AXYGEN,GDBL-1000)。1.2方法
1.2.1RIRI造模及分组 采用微型动脉夹夹闭双侧肾蒂法制备大鼠RIRI模型。术前禁水4 h,禁食12 h。采用2%异氟烷和氧气/氧化亚氮混合气体吸入法麻醉大鼠,10%水合氯醛(300 mg/kg)腹腔注射麻醉,仰卧固定,切开腹中线。用微型动脉夹夹闭双侧肾蒂,肾脏颜色变为暗红色提示诱导缺血成功,移去微型动脉夹,耗时约40~50 min。当肾脏颜色由红变白再变为鲜红色时,RIRI模型构建成功,缝合伤口。假手术组仅切开腹中线,不夹闭双侧肾蒂。术后将大鼠置于37℃苏醒,同等条件下正常饲养24 h 后处死,收集血清或肾组织用于后续试验,-80℃保存备用。RIRI模型大鼠随机分为4组:ICA组(60 mg/kg)、RIRI组、RIRI+ICA低剂量组(30 mg/kg)和RIRI+ICA高剂量组(60 mg/kg),每组8只。ICA处理组在术前用相应剂量的ICA对大鼠进行连续3 d的灌胃预处理。假手术组给予等体积生理盐水。
1.2.2HE染色观察肾组织病理损伤 取待检RIRI组织,固定包埋,切4 μm厚片,各试验组制作5片,从中选取1片进行分析。根据HE染色液说明书进行染色。染色后在各切片中选取5个区域观察,随机选取1个区域作为试验结果。
1.2.3肾功能评估 提取RIRI后的待检血液样本,4℃、2 000 g离心15 min,取上清。生化分析仪检测血清中BUN和Cr表达水平。各试验组检测5组数据,除去最高值和最低值进行统计分析。
1.2.4ELISA 根据ELISA试剂盒说明书检测待检血清中炎症因子(TNF-α、IL-1β和IL-6)水平。将酶复合物用稀释液稀释,加血清及TNF-α、IL-1β和IL-6的阴性和阳性对照物,孵育1 h,洗板,加底物,避光反应30 min后加终止液完成反应。酶标仪检测450 nm处TNF-α、IL-1β和IL-6吸光度。
1.2.5氧化应激检测 待检血液样本于4℃、2 000 g 离心15 min,取上清。根据MDA和SOD检测试剂盒说明书检测试验组大鼠血清MDA和SOD水平。SOD水平上升、MDA水平下降则表示氧化应激减轻。
1.2.6TUNEL检测细胞凋亡情况 取待检RIRI组织,固定包埋,切4 μm厚片,各试验组制作5片,从中选取1片进行试验。二甲苯醇脱羧,蛋白酶K(20 μg/ml)37℃处理15 min。PBS洗涤3次,TUNEL染色酶37℃处理30 min。PBS洗涤3次,DAPI染色,倒置荧光显微镜分析各试验组肾组织细胞凋亡情况。
1.2.7Western blot检测Cleaved Caspase-3、Cleaved Caspase-9、Nrf2/p-Nrf2、HO-1和NQO1表达 RIPA裂解液溶解肾组织,提取蛋白,双辛酸法定量。各试验组取40 μg蛋白行SDS-PAGE分离,转移至PVDF膜。5%脱脂奶粉在室温下封膜2 h。加入Cleaved Caspase-3(1∶1 000)、Cleaved Caspase-9(1∶1 000)、Nrf2/p-Nrf2(1∶1 000)、HO-1(1∶1 000)和NQO1(1∶1 000)一抗4℃孵育过夜。加入二抗室温孵育2 h。加入ECL观察条带,凝胶成像系统(AXYGEN)拍照。

2 结果
2.1ICA改善缺血再灌注后肾损伤 HE染色结果显示,ICA组与假手术组无明显病理损伤,表明60 mg/kg ICA对大鼠无明显毒副作用。RIRI组大鼠肾组织病理损伤明显,且随ICA剂量增加病理损伤减轻,表明ICA可剂量依赖性地缓解肾组织病理损伤和功能紊乱(图1A)。RIRI组大鼠BUN和Cr水平显著高于对照组和ICA组(P<0.01),而RIRI+ICA低剂量组和RIRI+ICA高剂量组大鼠BUN和Cr水平比RIRI组显著降低,RIRI+ICA高剂量组降低更为显著(P<0.01,图1B)。提示大鼠肾缺血再灌注后,ICA剂量依赖性地降低血清BUN和Cr水平,改善缺血再灌注后大鼠肾损伤。
2.2ICA减轻RIRI引起的炎症反应和氧化应激 RIRI组炎症因子水平明显高于假手术组和ICA组(P<0.01),RIRI+ICA低剂量组和RIRI+ICA高剂量组炎症因子水平降低,且RIRI+ICA高剂量组降低最为显著(P<0.01)。提示ICA剂量依赖性地降低大鼠RIRI后炎症因子表达。RIRI各组SOD水平相比于假手术组和ICA组明显下降(P<0.01),RIRI+ICA低剂量组和高剂量组SOD水平相比于RIRI组明显上升,且呈剂量依赖性,其中RIRI+ICA高剂量组上升最为显著(P<0.01)。RIRI组MDA水平比假手术组和ICA组显著上升(P<0.01),而RIRI+ICA低剂量组和高剂量组MDA水平相比RIRI组明显降低,且呈剂量依赖性,其中RIRI+ICA高剂量组降低最为明显(P<0.01)。说明ICA剂量依赖性地上调SOD,下调MDA,抑制氧化应激,缓解RIRI引起的炎症反应和氧化应激(图2)。
2.3ICA减轻RIRI引起的细胞凋亡 ICA组与假手术组细胞无显著凋亡现象,表明60 mg/kg ICA对大鼠无明显毒副作用,RIRI各组细胞凋亡显著,随ICA剂量上升细胞凋亡减少。RIRI组Cleaved Caspase-3 和 Cleaved Caspase-9 表达明显高于假手术组和ICA组(P<0.01),且呈剂量依赖性(图3)。说明ICA通过抑制Cleaved Caspase-3和Cleaved Caspase-9表达抑制细胞凋亡。

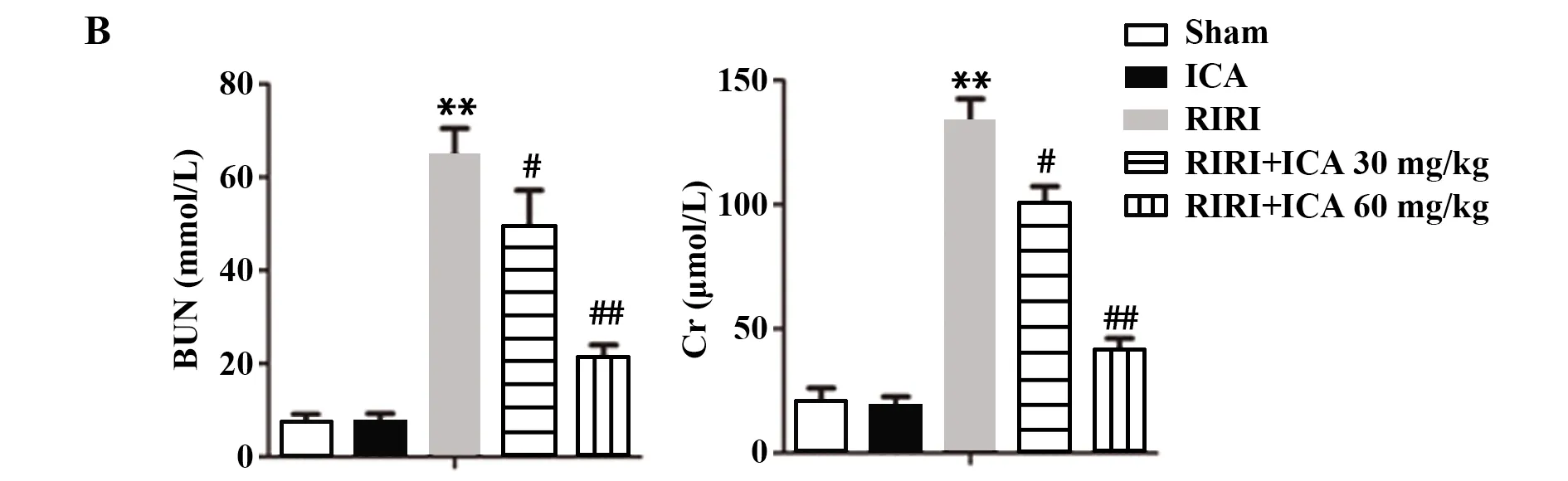
图1 ICA对缺血再灌注后肾损伤的影响
2.4ICA通过调节Nrf2/HO-1信号通路改善大鼠RIRI RIRI组p-Nrf2/Nrf2、HO-1和NQO1表达相比于假手术组和ICA组明显降低(P<0.01),且呈剂量依赖性,表明ICA剂量依赖性地激活Nrf2/HO-1信号通路。加入通路抑制剂ML385(10 μmol/L)后,RIRI+ML385组p-Nrf2/Nrf2、HO-1和NQO1表达水平比RIRI组显著降低(P<0.05),而RIRI+ICA+ML385组相比于RIRI+ML385组p-Nrf2/Nrf2、HO-1和NQO1表达明显上升(P<0.05),表明ICA可逆转ML385对Nrf2/HO-1信号通路的抑制作用。RIRI+ML385组BUN和Cr含量明显高于RIRI组(P<0.05),而RIRI+ICA+ML385组BUN和Cr含量明显低于RIRI+ML385组(P<0.05,图4)。说明ICA可剂量依赖性地逆转通路抑制剂ML385的作用,下调BUN和Cr水平。ICA以剂量依赖方式通过激活Nrf2/HO-1/NQO1信号通路减轻大鼠RIRI。
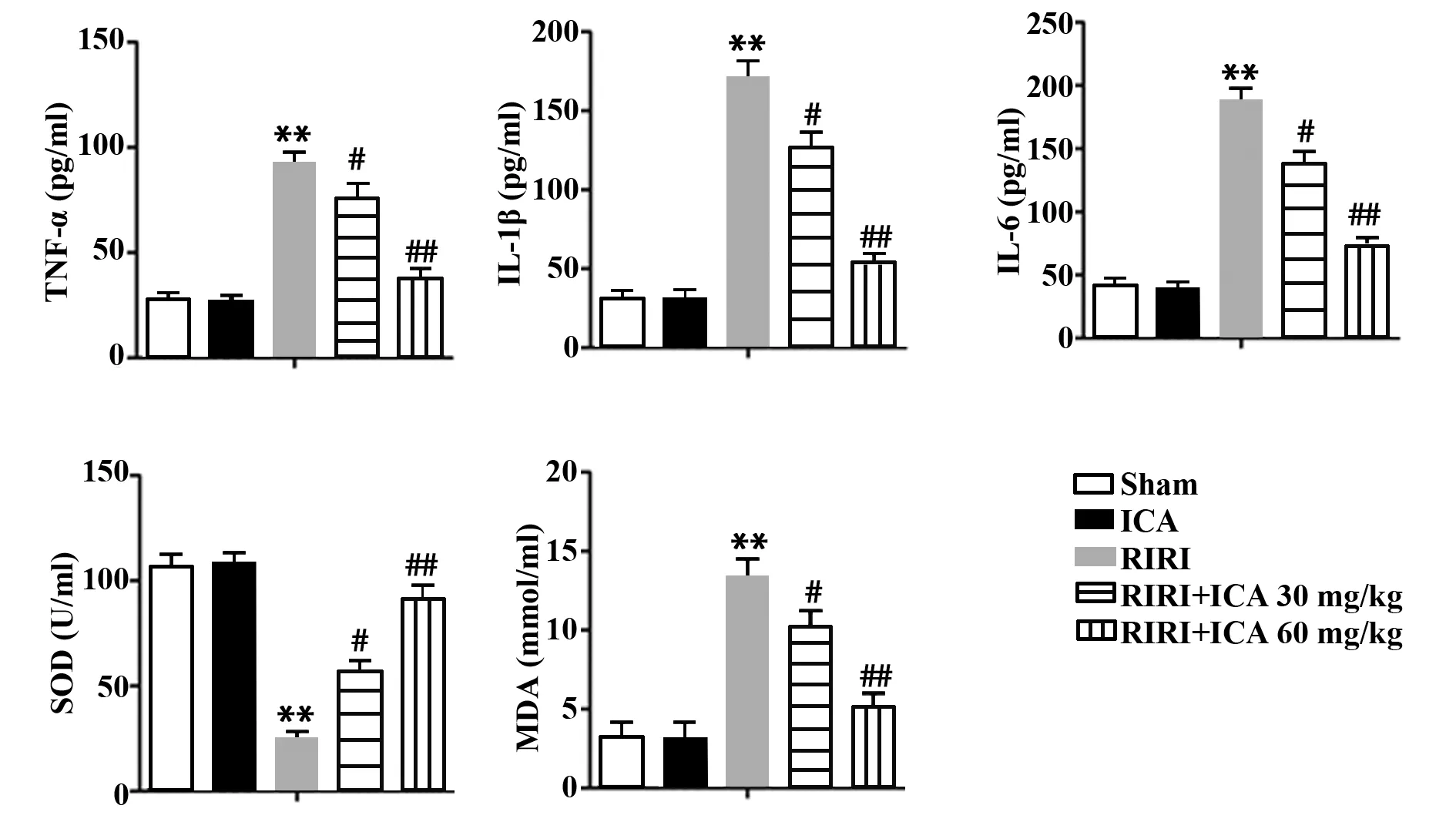
图2 ICA对RIRI引起的炎症和氧化应激的影响Fig.2 Effect of ICA on inflammation and oxidative stress caused by RIRINote:Compared with Sham,**.P<0.01;compared with RIRI,#.P<0.05,##.P<0.01.
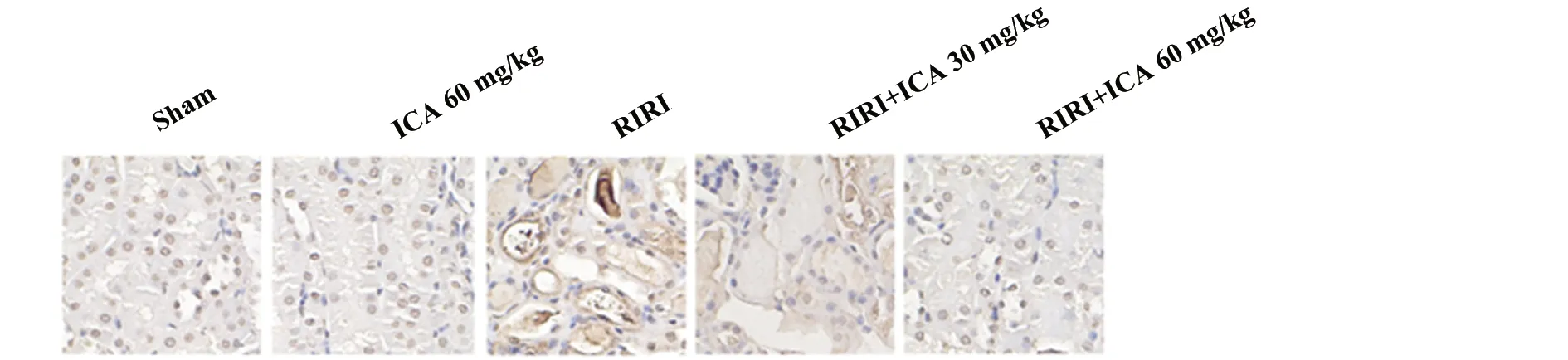
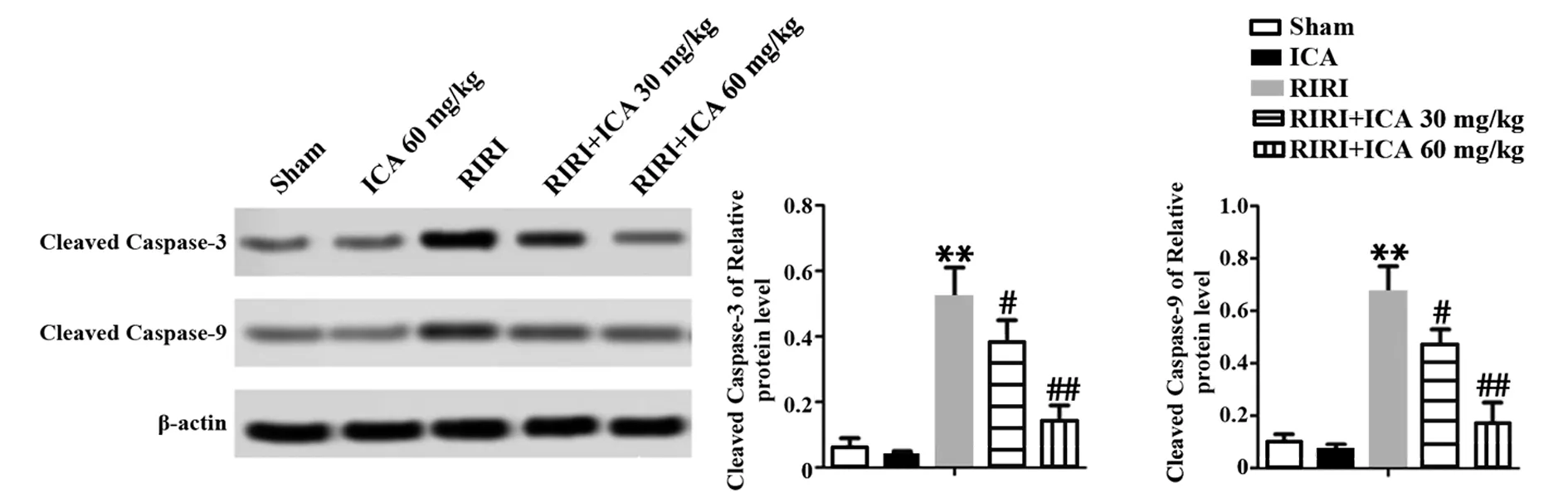
图3 ICA减轻RIRI引起的细胞凋亡
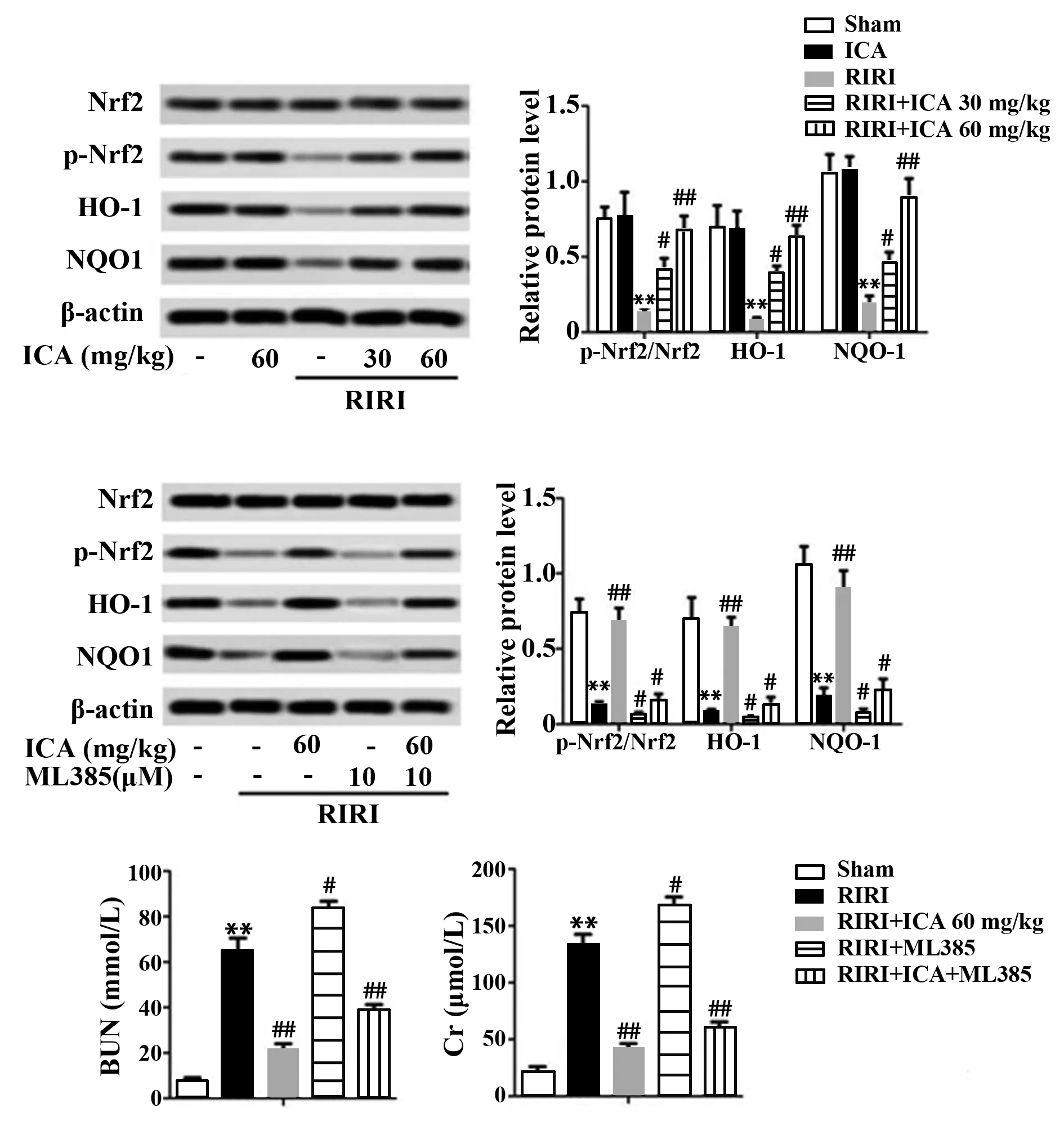
图4 ICA通过调节Nrf2/HO-1信号通路改善大鼠RIRI损伤Fig.4 ICA improves rat RIRI injury by modulating Nrf2/HO-1 signaling pathwayNote:Compared with Sham,**.P<0.01;compared with RIRI,#.P<0.05,##.P<0.01.
3 讨论
RIRI是指肾缺血再灌注对肾组织造成的损伤,其原因并非缺血,而是恢复血液供应后,过量自由基攻击重新获得血液供应的组织内细胞。RIRI主要发生在创伤性休克、外科手术、器官移植、烧伤、冻伤和血栓等血液循环障碍性疾病之后,主要引发肾功能紊乱、炎症反应、氧化应激和细胞凋亡,导致损伤加重[7]。本研究利用生化分析仪检测RIRI后肾功能变化,结果显示BUN和Cr含量上升,说明缺血再灌注对肾脏造成了组织学损伤,以此标准评估肾功能。RIRI后BUN和Cr含量上升,说明缺血再灌注导致肾组织损伤和肾功能紊乱[8]。ELISA检测RIRI后炎症因子(TNF-α、IL-1β和IL-6)表达水平,结果显示,炎症因子表达水平上升,引起大鼠肾组织炎症反应,与既往研究结论相似[8]。SOD是氧化应激的重要酶,MDA是脂质过氧化的终产物。研究发现,RIRI后使用SOD清除自由基,对损伤组织具有一定保护作用[7]。本研究利用SOD和MDA检测试剂盒分别检测SOD和MDA表达水平,结果显示,RIRI后SOD表达水平降低,MDA表达水平上升,说明RIRI引发大鼠氧化应激。Cleaved Caspase-3和Cleaved PARP被认为是不良组织反应的分子标志物和早期指标,提示细胞凋亡和炎症反应,导致蛋白改变[9,10]。本研究采用TUNEL染色检测RIRI后细胞凋亡情况,并进一步检测Cleaved Caspase-3和Cleaved Caspase-9表达水平。结果发现,RIRI后细胞凋亡增加,Cleaved Caspase-3和Cleaved Caspase-9表达升高,说明RIRI导致细胞凋亡,不良组织反应分子标志物表达上升。本研究中RIRI对肾的损害作用与既往研究结论相似[11,12]。研究发现,氧化苦参碱、阿立哌唑、四氢生物蝶呤、舒洛地特、罗布麻素等药物通过抑制炎症因子、氧化应激、细胞凋亡及激活抗凝血酶Ⅲ减弱RIRI[11-16]。本研究亦发现ICA可作为RIRI治疗的潜在药物。
ICA是从中草药淫羊藿中提取的黄酮类化合物,可减轻DNA损伤、抑制平滑肌细胞增殖和迁移、减少病灶面积和巨噬细胞浸润,防止血小板活化。ICA还能有效改善心血管系统功能,调整内分泌水平。临床上,ICA主要用于治疗绝经后骨质疏松症[17]。Zhang等[18]发现,ICA通过诱导Caspase依赖性凋亡抑制急性早期幼粒细胞白血病细胞生长。Jia等[19]研究表明,ICA通过抗氧化、抗炎症、抗凋亡特性在脊髓损伤中起神经保护作用。本研究探究了ICA对RIRI 的作用及分子机制。在大鼠RIRI后给予低剂量(30 mg/kg)和高剂量(60 mg/kg)ICA,结果发现,ICA剂量依赖性地下调血清BUN、Cr、炎症因子、MDA、Cleaved Caspase-3和Cleaved Caspase-9水平,上调SOD水平,抑制细胞凋亡。说明ICA剂量依赖性地改善大鼠RIRI引起的肾损伤。
核因子E2相关因子2(nuclear factor-E2-related factor-2,Nrf2)被认为是治疗癌症的靶分子,通过抑制Nrf2和诱导Nrf2 2种路径靶向治疗肿瘤[21]。Nezu等[22]研究发现,Nrf2在早期RIRI中高度活化可阻止肾小管损伤进展。本研究利用Western blot检测ICA对Nrf2表达的影响,并用通路抑制剂ML385(10 μmol/L)再次验证了Nrf2表达水平。结果显示,ICA剂量依赖性地上调RIRI后p-Nrf2/Nrf2、HO-1和NQO1表达,且可逆转通路抑制剂ML385对Nrf2通路的抑制作用,并使BUN和Cr含量降低,改善肾组织损伤和肾功能紊乱。结果表明,ICA剂量依赖性地调节Nrf2信号通路,减轻大鼠RIRI,与既往研究结果相似[22]。
醌氧化还原酶1(quinone oxidoreductase 1,NQO1)和血红素加氧酶(heme oxygenase 1,HO-1)属于抗氧化和抗凋亡基因[7]。NQO1是一种调节ROS生成的抗氧化蛋白,对RIRI诱导的肾损伤具有保护作用[23]。研究发现,RIRI后西地那非通过激活Nrf2、HO-1和NQO1对肾损伤起保护作用[24]。精氨酸通过Nrf2/HO-1信号通路减轻RIRI[25]。Nrf2/HO-1信号通路通过抑制糖原合酶Kinase-3β缓解糖尿病大鼠RIRI[26]。本研究利用Western blot检测给予ICA后HO-1和NQO-1表达水平的变化,并用通路抑制剂ML385再次验证了HO-1和NQO-1的表达及BUN、Cr含量。结果显示,ICA剂量依赖性地上调RIRI后HO-1和NQO1表达水平,且可逆转通路抑制剂ML385对HO-1和NQO1的抑制作用,下调BUN和Cr含量,调节HO-1和 NQO1信号通路,减轻大鼠肾损伤。
总之,ICA剂量依赖性地调节Nrf2/HO-1/ NQO1信号通路,改善RIRI引起的肾组织损伤和肾功能紊乱,减轻RIRI引起的炎症反应和氧化应激,并抑制细胞凋亡。
