儿童重症肌无力合并卵巢早衰及粒细胞减少症一例并文献复习
2020-12-23谢艾岑廖雄宇何展文
谢艾岑?廖雄宇?何展文
【摘要】目的 探討儿童重症肌无力合并卵巢早衰及粒细胞减少症的发病机制、诊治方法及预后。方法 收集一例重症肌无力合并卵巢早衰及粒细胞减少症儿童的临床资料,以“重症肌无力”“卵巢早衰”“粒细胞减少症”为关键词(包括中英文)对PubMed和中国知识基础设施工程(CNKI)数据库收录的论文进行检索,结合文献分析病例特点、实验室检查、影像学检查、诊治方法。结果 该例13岁患儿以双下肢乏力、双眼睑下垂、继发性闭经及粒细胞减少为主要表现,其乙酰胆碱受体抗体、抗卵巢IgG抗体均为阳性,卵泡刺激素明显升高(102.2 U/L),雌二醇水平下降(17 ng/L);白细胞1.88×109/L,中性粒细胞0.69×109/L;B超提示双侧卵巢容积减少;胸部CT提示胸腺增生。考虑诊断为重症肌无力合并卵巢早衰及粒细胞减少症,治疗上予胸腺切除,静脉注射丙种球蛋白调节免疫,并继续口服溴吡斯的明,择期予性激素替代治疗;随访至2020年3月,患儿无肌无力发作,中性粒细胞升至正常水平,但仍闭经。检索数据库后共收集到7篇相关病例报道,年龄15 ~ 27岁,临床表现重症肌无力、卵巢早衰,予溴吡斯的明、雌激素替代治疗、胸腺切除、血浆置换等治疗,治疗效果不一。结论 儿童重症肌无力合并卵巢早衰及粒细胞减少症在国内外均十分罕见,其发病机制可能与机体T淋巴细胞功能紊乱有关,造成多器官免疫损伤,在祛除诱因的前提下,应纠正机体免疫紊乱,同时予溴吡斯的明对症处理,必要时予性激素替代治疗。
【关键词】重症肌无力;卵巢早衰;粒细胞减少症;T淋巴细胞功能紊乱;儿童
Pediatric myasthenia gravis complicated with premature ovarian failure and granulocytopenia: a case report and literature review Xie Aicen, Liao Xiongyu, He Zhanwen. Department of Pediatrics, Sun Yat-sen Memorial Hospital, Sun Yat-sen University, Guangzhou 510120, China
Corresponding author, He Zhanwen, E-mail: hobbyvan@ 163. com
【Abstract】Objective To investigate the pathogenesis, diagnosis, treatment and prognosis of myasthenia gravis (MG) complicated with premature ovarian failure (POF) and granulocytopenia. Methods Clinical data of one child with MG complicated with POF and granulocytopenia were collected. Literature review was conducted by using the keywords of “myasthenia gravis”, “premature ovarian failure” and “granulocytopenia” from PubMed and CNKI. Clinical characteristics, laboratory and imaging examination, diagnosis and treatment of this case were analyzed. Results The main manifestations of this 13-year old patient included lower limb fatigue, double eyelid ptosis, secondary amenorrhea and granulocytopenia. The acetylcholine receptor antibody (AchR-Ab) and anti-ovarian antibodies-IgG (AOA) were positive. The follicle-stimulating hormone (FSH) was significantly increased (102.2 U/L) and the estrogen (E26) level was decreased (17 ng/L). The white blood cell count was 1.88×109/L and the neutrophil count was 0.69×109/L. B-mode ultrasound showed volume reduction of bilateral ovaries. Chest CT prompted thymic hyperplasia. The diagnosis of MG complicated with POF and granulocytopenia was confirmed. The child underwent thymectomy, intravenous immunoglobulin for immunity regulation, oral intake of pyridostigmine bromide and alternative sex hormone replacement therapy. During follow-up until March 2020, the child experienced no onset of muscle weakness, the neutrophil level rose to normal range, whereas she still had amenorrhea. Through literature review, 7 relevant articles were retrieved, aged 15-27 years old. Clinical manifestations mainly consisted of MG and POF. The therapeutic options primarily included pyridostigmine bromide, estrogen replacement therapy, thymectomy and plasma exchange with different clinical efficacy. Conclusions Pediatric MG complicated with POF and granulocytopenia has been rarely reported at home and abroad. The pathogenesis of these complicated diseases may be related to the dysfunction of T lymphocytes in the body, leading to immune damage of multiple organs. Besides eliminating the inducement, the immune disorder of the body should be corrected, pyridostigmine bromide should be administered and sex hormone replacement treatment should be delivered if necessary.
【Key words】Myasthenia gravis;Premature ovarian failure;Granulocytopenia;
T lymphocyte dysfunction;Child
重症肌无力是指主要由乙酰胆碱受体抗体介导、细胞免疫依赖、补体参与、主要累及神经肌肉接头突触后膜乙酰胆碱受体的获得性自身免疫性疾病[1-2]。卵巢早衰是指妇女在40岁以前因某种原因引起的闭经、不育、雌激素缺乏,以及促性腺激素水平升高为特征的一种疾病[3-4]。儿童重症肌无力合并卵巢早衰及粒细胞减少症的病例在国内外十分罕见,目前仅有少量儿童重症肌无力合并卵巢早衰的相关病例被报道[5-11]。该病的发病机制尚未明确,目前尚无规范治疗方法。现就本科室收治的1例重症肌无力合并卵巢早衰及粒细胞减少症患儿进行回顾性分析,包括其临床特征、相关检查结果及诊治经过等,并进行相关文献复习,旨在为儿童重症肌无力合并卵巢早衰及粒细胞减少症的诊治提供参考。
对象与方法
一、1例重症肌无力合并卵巢早衰及粒细胞减少症患儿临床资料的收集
我科于2019年7月收治1例重症肌无力合并卵巢早衰及粒细胞减少症的患儿,收集并分析其病史、实验室检查、影像学检查、诊治方法及转归等资料。
二、文献检索
以“重症肌无力”“卵巢早衰”和“粒细胞减少症”为关键词(包括中英文)对PubMed和中国知识基础设施工程(CNKI)数据库中截至2020年3月收录的论文进行检索,收集并分析重症肌无力合并卵巢早衰及粒细胞减少症患者的资料。
结果
一、1例重症肌无力合并卵巢早衰及粒细胞减少症患儿的病历资料
1. 主诉及病史
患儿女,13岁。因间断性四肢乏力3年余、闭经10个月于2019年7月入院。2016年6月患儿在上呼吸道感染后出现间断性四肢乏力,表现为行走或写作业10 min后自觉四肢乏力,双上肢无法上举,双下肢不能行走,休息2~5 min后可自行缓解,发作频率、时间无规律,无眼睑下垂及眼球活动受限,无晨轻暮重。2016年8月起,发作频率增加,发作形式同前。患儿2016年9月就诊于当地医院,查胸部CT、头颅及颈胸腰椎MRI平扫、脑电图、肌电图、心电图、心脏多普勒超声、血尿遗传代谢病检测均未见异常,予三维B片口服,症状无明显改善。患儿于2016年10月入住我院,期间查:乙酰胆碱受体抗体(AchR-Ab)阳性(> 8.0 nmol/L),T淋巴细胞0.810、B淋巴细胞0.076、CD4+ T淋巴细胞/淋巴细胞0.272、CD8+ T淋巴细胞/淋巴细胞0.399;CD4+ T淋巴细胞/CD8+ T淋巴细胞0.682。抗核抗体弱阳性;抗Sm抗体/抗核糖核蛋白抗体弱阳性;抗核抗体1.891 S/CO;抗双链DNA (dsDNA)3.336 Index。抗人球蛋白试验、乳酸、血氨、甲状腺抗体、免疫6项(IgA、IgG、IgM、补体C3、C4、总IgE)、风湿4项(CRP、RF、抗O、抗链球菌DNA酶B)、致畸4项IgM(弓形体IgM抗体、风疹病毒抗体、巨细胞病毒IgM抗体、单纯疱疹病毒IgM抗体)、骨2项(骨碱性磷酸酶、25-羟维生素D)结果均未见异常。胸部X线片、心脏多普勒超声、心电图结果亦未见明显异常。考虑“重症肌无力”,予口服溴吡斯的明后,症状明显好转。后予出院并规律口服溴吡斯的明(60 mg,每日3次)。患儿2018年2月月经初潮,每次持续3 ~ 5 d,月经量中等,月经周期规律。2018年9月,患儿曾于1次“急性上呼吸道感染”服药后(具体用药不详),出现双下肢乏力、双眼睑下垂,停用该药数日后,肌肉无力症状逐渐缓解。但患儿逐渐月经紊乱至闭经,期间无伴肌无力症状加重,无发热、抽搐,无皮疹,无口腔溃疡、脱发,无关节肿痛等。为进一步诊治,患儿2019年7月再次入住我院。既往史、个人史、家族遗传史无特殊。
2. 体格检查、实验室及影像学检查
体格检查:体质量37 kg(-1.2标准差),身高146.5 cm(-1.8标准差)。双眼无眼睑下垂,无肌肉萎缩,四肢肌张力正常,四肢肌力5级。深浅反射正常引出,病理反射未引出。发育程度双乳B2,外阴PH2。
入院后完善检查:血常规血红蛋白 128 g/L,白细胞1.88×109/L,中性粒细胞 0.69×109/L,血小板 248×109/L。AchR-Ab 7.13 nmol/L(阳性)。卵巢功能:睾酮0.25 nmol/L,孕酮0.21 μg/L,催乳素42.8 μg/L,雌二醇17 ng/L,卵泡刺激素(FSH)102.2 U/L,黄体生成素(LH)69.8 U/L,硫酸脱氢表雄酮(DHEA-S)62.13 μg/L,17-α羟孕酮(17-αOH) 0.57 μg/L,性激素结合蛋白(SHBG) 58.67 nmol/L,抗卵巢IgG抗体阳性。抗核糖体抗体阳性,抗dsDNA抗体阳性,抗核小体阳性,抗组蛋白抗体阳性。狼疮抗凝物质检测:LA1筛查试验 37.6 s。ESR 40.0 mm/h。淋巴細胞亚群,血细胞簇分化抗原CD20:白细胞 1.79×109/L,淋巴细胞 0.96×109/L,CD4+ T淋巴细胞/CD8+ T淋巴细胞 1.25,CD20+ B淋巴细胞/淋巴细胞0.182;T淋巴细胞活化状态检测:T淋巴细胞0.775,CD3+ CD25+ 细胞0.081,CD3+ CD69+ 细胞 0.011,CD3+HLA-DR+细胞0.312。IgA 4.76 g/L,IgG 17.70 g/L,补体C4 89 mg/L,抗链球菌DNA酶B 292 kU/L,总IgE 128 kU/L。血生化、甲状旁腺素、游离甲状腺功能3项(FT3、FT4、TSH)、血氨、乳酸、EB病毒DNA定量、巨细胞病毒DNA定量、肺炎支原体IgM均未见异常。
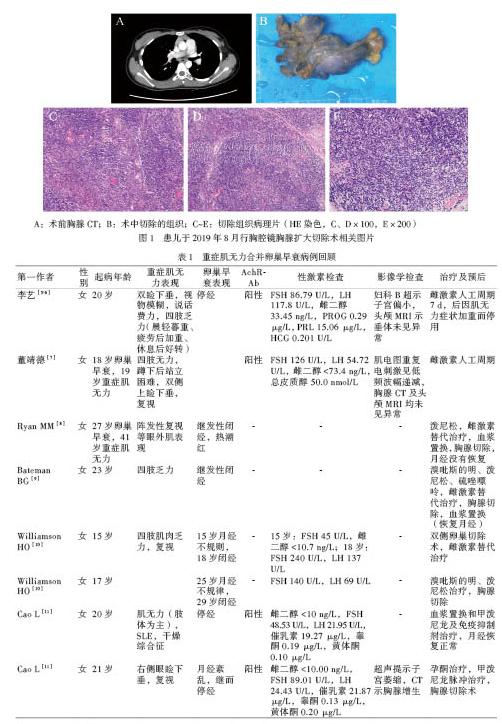
妇科经腹经直肠B超:子宫体容积 6.44 ml,右卵巢容积 0.62 ml,左卵巢容积 0.14 ml,盆腔积液。胸腺CT:前上纵隔区见胸腺组织,考虑胸腺增生可能性大;左肺尖段多发小结节,考虑炎症,建议复查(图1A)。右侧肺门、纵隔、双侧腋窝多发稍大淋巴结。骨髓常规:粒系增生活跃,分类各阶段比例与形态大致正常;垂体MRI动态增强未见异常。X线胸片、心电图、肾上腺B超、心脏多普勒超声均未见明显异常。
考虑诊断:重症肌无力、卵巢早衰、粒细胞减少症、胸腺增生,予丙种球蛋白(2 g/kg)调节免疫,继续口服溴吡斯的明。患儿2019年8月3日于全身麻醉下行胸腔镜胸腺扩大切除术,术中切除一大小约9.5 cm×6.0 cm×2.0 cm灰黄灰褐色组织(图1B),送病理检查。病理报告:肉眼所见组织一块,大小约9.5 cm×6.0 cm×2.0 cm,切面灰黄灰褐色、实性、质中。病理诊断:符合胸腺增生。术后病理诊断为胸腺增生(图1C ~ E)。2019年8月28日复查抗卵巢IgG抗体阳性,神经肌肉疾病检测人骨骼肌受体酪氨酸激酶抗体(Musk-AB) < 0.01 kU/L、人抗兰尼碱受体钙释放通道抗体(Ryr-Ab)阴性、人抗连接素抗体(Titin-Ab)阴性、AchR-Ab 3.31 nmol/L(阳性),予带药(溴吡斯的明)出院。2020年2月复查血常规:血红蛋白135 g/L,白细胞3.26×109/L,中性粒细胞1.82×109/L,血小板267×109/L。淋巴细胞亚群,血细胞簇分化抗原CD20:白细胞2.00×109/L,淋巴细胞1.10 ×109/L,CD4+ T淋巴细胞/CD8+ T淋巴细胞1.26,CD20+ B淋巴细胞/淋巴细胞0.180;T淋巴细胞活化状态检测:T淋巴细胞0.780,CD3+ CD25+ 细胞0.085,CD3+ CD69+ T淋巴细胞0.013,CD3+ HLA-DR+ 细胞0.316。2020年1月16日妇科经腹部B超复查:子宫体容积7.19 ml,右卵巢容积 0.30 ml,左卵巢容积0.91 ml。2020年3月12日复查妇科经腹部B超:子宫体容积4.24 ml,右卵巢容积 0.28 ml,左卵巢容积 0.20 ml。
3. 治疗与转归
予胸腺切除,静脉注射丙种球蛋白调节免疫,并继续口服溴吡斯的明,择期予性激素替代治疗。随访至2020年3月,患儿无肌无力发作,中性粒细胞升至正常水平,但仍闭经。
二、文献检索结果
检索数据库后共收集到7篇(9例)重症肌无力并卵巢早衰病例报道[5-11]。最早被报道的是 1980年的2例患者[10]。病例多为育龄期女性患者,包括重症肌无力表现、卵巢早衰表现,予溴吡斯的明、雌激素替代治疗、胸腺切除、血浆置换等治疗,疗效不一,见表1。
讨论
本例患儿2016年确诊重症肌无力,当时行胸部CT检查尚未发现胸腺增大,规律口服溴吡斯的明(60 mg,每日3次)下,未见肌无力发作。2018年9月,患儿曾于1次“急性上呼吸道感染”服药后(具体用药不详),出现双下肢乏力、双眼睑下垂,停用该药数日后,肌无力症状缓解,但逐渐月经紊乱至闭经。2019年7月,于我院住院期间,发现胸腺增生、粒细胞减少,且多种自身抗体阳性。闭经是卵巢早衰的主要临床表现,发生在青春期后则表现为继发闭经,40岁以前月经终止,往往有第二性征发育[12]。该患儿为青春期女性,闭经前已出现第二性征,FSH及催乳素水平升高、雌激素水平下降,B超提示左侧卵巢容积明显缩小,抗卵巢IgG抗体阳性,排除垂体性闭经、Turner综合征等先天性疾病,考虑诊断为“卵巢早衰”[13]。
胸腺来源的具有免疫抑制作用的CD4+ CD25+ T淋巴细胞,即调节性T淋巴细胞(Treg),能抑制CD4+ T淋巴细胞、CD8+ T淋巴细胞的增殖,抑制IFN-γ的产生,维持机体的免疫耐受、避免自身免疫性疾病的发生[14]。另外,Treg可分泌免疫下調性细胞因子转化生长因子-β(TGF-β)发挥免疫抑制功能,而TGF-β在体外又可以诱导人外周血Treg细胞增殖及分化。有临床研究者记录了一例重症肌无力合并高促性腺激素性闭经的30岁患者,在控制重症肌无力病情后,观察到卵巢功能间歇性恢复。研究中测定该患者治疗后的CD3+ T淋巴细胞百分比和CD4+ T淋巴细胞百分比增加,CD8+ T淋巴细胞百分比减少,其中CD4+ T淋巴细胞/CD8+ T淋巴细胞高于正常对照组[15]。研究表明,T淋巴细胞亚群与卵巢早衰患者的自身免疫功能紊乱密切相关。本文报道的患儿,治疗前后CD3+ T淋巴细胞百分比也有不同程度的增加,与既往报道相符。但目前关于重症肌无力合并卵巢早衰与Treg亚群、辅助性T淋巴细胞及细胞毒T淋巴细胞亚群的关系尚无统一看法,特别是在儿童中十分罕见。
另外,胸腺激素可抑制运动神经末梢乙酰胆碱的合成和释放,所以当胸腺激素过多时,可产生重症肌无力。Ryan等[8]曾记录一例女性患者,27岁时出现继发性闭经,诊断为卵巢早衰,予血浆置换、泼尼松治疗效果欠佳;41岁时出现阵发性复视等眼外肌受累表现,诊断为重症肌无力,予吡啶斯的明、泼尼松治疗后,肌无力症状加重,并出现胸腺增生,予胸腺切除后,月经仍未恢复。Bateman等[9]报道过1例接近同时出现重症肌无力合并卵巢早衰的患者,在接受溴吡斯的明、雌激素、泼尼松、硫唑嘌呤、血浆置换及胸腺切除治疗后,恢复月经。回顾本例患儿,在继发闭经后,治疗上予丙种球蛋白调节免疫,继续口服溴吡斯的明,并行胸腺切除,随访至今,未见肌无力症状发作,但月经仍未恢复。我们曾猜测,AchR可能同时存在于卵巢中。但该患儿还合并粒细胞减少症,并且多种自身抗体阳性。该患儿在切除胸腺前后,其外周血的淋巴细胞亚群及T淋巴细胞功能并没有明显变化,这表明胸腺切除术也许并不会影响T淋巴细胞亚群的比例和增殖。故治疗上可考虑使用免疫抑制剂及血浆置换来纠正该患儿机体的免疫紊乱。
粒细胞减少症病因复杂,后天获得性病因中以继发于某些自身免疫性疾病较为常见[16]。本例患儿后期出现粒细胞减少,抗中性粒细胞抗体及多项自身抗体阳性,考虑与免疫紊乱相关,在控制好重症肌无力病情的前提下,使用丙种球蛋白(2 g/kg)调节免疫后,粒细胞升至正常水平。
Hoek等[17]认为,关于自身免疫性内分泌疾病,有三大发展进程,首先是树突状细胞的异常聚集,第二是免疫应答的异常调节,第三是内分泌细胞对细胞因子和(或)自身抗体的异常易感性。本例患儿在一次上呼吸道感染后,出现闭经,住院期间虽未检测出相关病原体,但不排除因感染后诱发机体免疫紊乱,导致青春期进展过速、性激素过度分泌,进一步出现月经紊乱、闭经等卵巢功能衰退的表现。同时,机体的免疫损伤还有可能出现粒细胞减少症等免疫相关疾病。
重症肌无力合并卵巢早衰及粒细胞减少症的病例鲜有报道,治疗上国内外尚无统一方案,大部分主张抗胆碱酯酶药、泼尼松治疗,合并胸腺增生者予胸腺切除,必要时予性激素替代治疗。美国2013年修订的重症肌无力管理国际共识指南及意大利2019年的最新建议中指出,吡啶斯的明溴化物是首选口服药物;免疫抑制治疗方面中糖皮质激素、硫唑嘌呤或霉酚酸酯较常见;但大剂量激素治疗也可导致患者症状迅速恶化。硫唑嘌呤是重症肌无力中使用最广泛的非甾体免疫抑制剂,与糖皮质激素联合治疗使得缓解时间更长,但短期疗效不明显,突然停药可能导致重症肌无力复发症状,甚至肌无力危象。静脉使用丙种球蛋白可通过多种途径影响体液和细胞免疫[1, 18]。症状不典型的重症肌无力易被误诊[19]。本例患儿初始症状典型,早期已明确诊断为重症肌无力,多种自身抗体由早期阴性发展为阳性,在祛除诱因的前提下,已使用丙种球蛋白纠正机体免疫紊乱,并予溴吡斯的明对症处理,中性粒细胞升至正常,亦无肌无力发作,遗憾的是,随访至今,患儿月经仍未恢復。因糖皮质激素有可能导致肌无力症状加重,故本例患儿病程中未使用糖皮质激素。另该患儿治疗前后,外周血淋巴细胞亚群及T淋巴细胞功能无明显变化,我们猜测,患儿卵巢功能尚未恢复,也许与机体免疫紊乱尚未完全纠正有关。必要时可考虑使用其他免疫抑制剂,如硫唑嘌呤,或进行血浆置换,择期使用性激素替代治疗。
参 考 文 献
[1] Evoli A, Antonini G, Antozzi C, DiMuzio A, Habetswallner F, Iani C, Inghilleri M, Liguori R, Mantegazza R, Massa R, Pegoraro E, Ricciardi R, Rodolico C. Italian recommendations for the diagnosis and treatment of myasthenia gravis. Neurol Sci, 2019, 40(6):1111-1124.
[2] 中华医学会神经病学分会神经免疫学组, 中国免疫学会神经免疫学分会. 中国重症肌无力诊断和治疗指南2015. 中华神经科杂志,2015,48(11):934-940.
[3] 陈子江, 田秦杰, 乔杰, 刘嘉茵, 杨冬梓, 黄荷凤, 梁晓燕,秦莹莹, 伍琼芳, 杨晓葵, 肖红梅, 陈士岭, 姚元庆, 徐丛剑, 曹云霞, 张以文, 庄广伦, 陈贵安, 林金芳, 李尚为, 朱桂金, 章晓梅, 华克勤, 阮祥燕, 吴洁, 郁琦, 孙赟. 早发性卵巢功能不全的临床诊疗中国专家共识. 中华妇产科杂志, 2017,52(9):577-581.
[4] 何敏菲, 袁珂, 王春林. 儿童青少年早发性卵巢功能不全的病因及治疗. 国际儿科学杂志, 2020,47(1):42-46.
[5] Li Y, Xiao B, Xiao L, Zhang N, Yang H. Myasthenia gravis accompanied by premature ovarian failure and aggravation by estrogen. Intern Med, 2010, 49(6):611-613.
[6] 李艺, 杨欢, 肖波, 肖岚, 张宁. 重症肌无力合并卵巢早衰一例. 中华神经科杂志, 2006, 39(12): 826.
[7] 董靖德, 王小姗, 靳凌. 重症肌无力合并卵巢早衰1例报告. 临床神经病学杂志,2011, 24(2):117.
[8] Ryan MM, Jones HR Jr. Myasthenia gravis and premature ovarian failure. Muscle Nerve, 2004, 30(2):231-233.
[9] Bateman BG, Nunley WC Jr, Kitchin JD 3rd. Reversal of apparent premature ovarian failure in a patient with myasthenia gravis. Fertil Steril, 1983, 39(1):108-110.
[10] Williamson HO, Phansey SA, Mathur S, Mathur RS, Baker ER, Fudenberg HH. Myasthenia gravis, premature menopause, and thyroid autoimmunity. Am J Obstet Gynecol, 1980, 137(8):893-901.
[11] Cao L, Liu W, Zhu Z. Clinical characteristics and relationship between myasthenia gravis and premature ovarian failure: report of two cases. J Int Med Res, 2019, 47(8):3992-3997.
[12] 徐苓,宋亦军.卵巢早衰的临床表现和诊断标准.实用妇产科杂志,2003,19(4):195-196.
[13] Vujovic S, Brincat M, Erel T, Gambacciani M, Lambrinoudaki I, Moen MH, Schenck-Gustafsson K, Tremollieres F, Rozen-berg S, Rees M; European Menopause and Andropause Society. EMAS position statement: managing women with premature ovarian failure. Maturitas, 2010, 67(1):91-93.
[14] 冯静, 李杏杏, 王佩娟. 免疫性卵巢早衰与T淋巴細胞亚群相关性研究. 吉林中医药, 2013, 33(5):441-443.
[15] Miyake T, Sato Y, Takeuchi S. Implications of circulating autoantibodies and peripheral blood lymphocyte subsets for the genesis of premature ovarian failure. J Reprod Immunol, 1987, 12(3):163-171.
[16] 师晓东, 罗丹青.儿童中性粒细胞减少症的最新分类与治疗进展.中华实用儿科临床杂志,2018,33(3):173-176.
[17] Hoek A, Schoemaker J, Drexhage HA. Premature ovarian failure and ovarian autoimmunity. Endocr Rev, 1997, 18(1):107-134.
[18] Sanders DB, Wolfe GI, Benatar M, Evoli A, Gilhus NE, Illa I, Kuntz N, Massey JM, Melms A, Murai H, Nicolle M, Palace J, Richman DP, Verschuuren J, Narayanaswami P. International consensus guidance for management of myasthenia gravis: Executive summary. Neurology, 2016, 87(4):419-425.
[19] 葛同军, 周涌涛. 重症肌无力误诊一例. 新医学, 2016, 47(10): 715-717.
(收稿日期:2020-06-01)
(本文编辑:林燕薇)
