三氟乙酸增强的解吸电喷雾电离质谱成像用于脂质空间分布研究
2020-12-23王晓群黄光明
王晓群,黄光明
(中国科学技术大学化学与材料科学学院,合肥230026)
脂质在能量存储、细胞膜形成和细胞信号通路等方面发挥着重要的作用[1,2].研究表明,诸多癌症、神经系统疾病和免疫疾病均涉及大量脂质的异常代谢[3~5].因此,研究生物组织中脂质的相对含量和空间分布,将有助于发现人类疾病的生物标记物.脂质种类众多且相互作用复杂,因此同时对多种脂质进行成像分析具有重要的研究价值.
解吸电喷雾电离质谱成像(DESI-MSI)作为一种常压下的质谱成像技术,具有无需样品预处理、碎片离子少等优点[6,7],已被广泛用于研究如脑、肝及肾脏等多种生物组织中脂质的空间分布[8~10].但是有些脂质在组织中的丰度较低或者在电喷雾过程中的离子化效率低,难以被DESI-MSI检测到;且采用DESI-MSI方法检测脂质时,会形成大量钠、钾等加合离子,造成质谱峰分裂,不利于谱图解析及后续的定量分析[11,12].因此,需要进一步提高检测灵敏度、简化谱图,以便更好地利用DESI-MSI技术研究脂质的空间分布及疾病的发病机制.
前文[13]针对小分子代谢物建立了一种三氟乙酸增强的DESI-MSI方法,显著提高了小鼠脑组织中氨基酸、多胺和嘌呤类等物质的检测灵敏度.同时,该方法利用三氟乙酸在解吸电喷雾过程中为小分子代谢物提供更多质子,可以抑制小分子代谢物的金属加合物的形成,从而简化谱图解析.本文继续采用该方法来提高DESI-MSI对脂质的检测能力,将0.01 mmol/L三氟乙酸添加到甲醇中作为DESI-MSI的喷雾溶剂,使小鼠脑组织中可成像的脂质种类从59种提高到71种.此外,还研究了多种脂质间的空间相关性,为揭示多种脂质之间潜在的代谢规律提供了新的研究手段.
1 实验部分
1.1 试剂与仪器
甲醇(色谱纯,美国霍尼韦尔公司);三氟乙酸(色谱纯,上海阿拉丁生化试剂有限公司);超纯水由Milli-Q纯化系统(美国Millipore公司)制备.所用试剂未经进一步纯化处理,直接使用.
Exactive Plus型质谱仪(美国Thermo Scientific公司);JY 92-ⅡDN型超声波细胞破碎仪(宁波市宁波新芝生物科技股份有限公司);1860型低温切片机(德国徕卡生物系统).
1.2 脑组织样本的制备
所有动物实验程序均经中国科学技术大学机构动物护理和使用委员会批准.将8周龄C57BL/6J小鼠麻醉后,立即取出脑组织置于液氮中冷冻.小鼠脑组织匀浆的制备:将冷冻的小鼠脑组织添加一定超纯水(每50 mg组织加1 mL水),用超声波细胞破碎仪进行组织匀浆,并于-80℃储存待DESI-MS分析.将冷冻匀浆在质谱分析前置于室温下解冻30 min.小鼠脑组织切片的制备:使用冷冻包埋剂(OCT)将小鼠脑组织固定,在-20℃下解冻1 h后,用低温切片机切为厚度为16μm的薄片,并置于ITO载玻片上.将切片置于-80℃冰箱中保存,使用前须真空干燥30 min.
1.3 质谱实验条件
实验使用的自制DESI离子源由2层同轴的熔融石英毛细管组成:外毛细管内径为250μm,外径为370μm,作为雾化气气路导管;内部毛细管内径为50μm,外径为150μm,作为电喷液路导管.雾化气体氮气从内外毛细管之间的空隙通过.DESI离子源几何参数:离子源与样品表面的距离为1.5 mm,离子源与质谱仪入口的距离为6 mm,离子源喷射冲击角度为55°,收集角度小于10°.电喷雾参数:喷雾溶剂分别为添加0.01 mmol/L和未添加三氟乙酸的甲醇;喷雾溶剂流速为2μL/min;喷雾电压为4 kV;正离子采集模式.使用二维电动移动平台控制样品的运动速度和方向,每行的扫描速度为250μm/s,两行间距为250μm.
1.4 Nissl染色
染色步骤:(1)将4%的多聚甲醛溶液滴加到小鼠脑组织切片上覆盖脑片,固定1 h;(2)将玻片浸泡在PBS缓冲液中洗去多聚甲醛,5 min后更换PBS缓冲液,再浸泡5 min;(3)取出玻片,将灭菌超纯水滴至玻片表面,覆盖脑片,约5 min后去除液体;(4)将0.25%尼氏(Nissl)染液滴至玻片表面,覆盖脑片,染色约15 min;(5)梯度脱色:将玻片依次放入70%,80%,95%和100%乙醇溶液中;(6)在100%乙醇溶液中脱色后,立即滴加树脂覆盖住脑片,盖上盖玻片即可.最后,滴加树脂并用玻璃盖玻片盖住组织切片以完成Nissl染色.
1.5 数据处理
使用ProteoWizard的MSConvert软件(http://proteowizard.sourceforge.net/)将.RAW格式的质谱原始数据转换为.mzXML格式,再利用自编MATLAB程序将.mzXML格式文件转化为.mat文件,最终利用开源成像软件MSiReader(免费软件,www.MSiReader.com)获得脂质的空间分布.
1.6 脂质的鉴定
查询人类代谢组数据库(HMDB,https://hmdb.ca/),要求m/z的测量值与理论值误差<5×10-6;且其稳定同位素分布符合理论预测.
2 结果与讨论
2.1 三氟乙酸提高DESI-MS对脂质的检测能力
在喷雾溶剂甲醇中加入0.01 mmol/L三氟乙酸,考察了小鼠脑匀浆的脂质变化,结果如图1所示.与其它质谱方法得到的结果[14,15]类似,实验检测到脑组织中主要的脂质有磷脂酰胆碱(PC)、磷脂酰乙醇胺(PE)、磷脂酰丝氨酸(PS)及鞘磷脂(SM),大多数脂质的分子量集中在700~900之间[图1(A)].而未添加三氟乙酸时用DESI-MS检测到59种脂质,含有26种PC,26种PE,3种PS,3种SM及1种磷脂酸(PA)[图1(B)].使用三氟乙酸后,检测到的脂质数量增加到71种,新增的12种脂质中包括4种PC,2种PE,5种PS及1种磷脂酰肌醇(PI).表S1和S2(见本文支持信息)分别列出了利用三氟乙酸检测的71种脂质的分子信息及其对DESI-MS能检测到的59种脂质的质谱信号强度的影响.以上结果表明,三氟乙酸的加入提高了脂质在解吸电喷雾过程中的离子化效率,这可能与三氟乙酸的强给质子能力有关(酸离解常数为0.23).类似的增强质谱信号的方式也被用于基质辅助激光解吸离子化质谱成像分析中,利用添加在基质溶液中的三氟乙酸作为质子供体提高电离效率[16,17].

Fig.1 Detection of lipids from mouse brain homogenate improved by trifluoroacetic acid
我们还希望利用三氟乙酸的强给质子能力形成更多的质子加合峰,用于抑制金属离子加合峰,从而有助于简化谱图解析及定量分析.实验结果表明,采用未添加三氟乙酸的DESI-MSI时,PC(32:0)的钾和钠加合物信号强度分别占总信号强度(质子化峰、钠加合物以及钾加合物三者信号强度之和)的72%和19%,而质子化信号强度仅占9%[图2(A)].添加三氟乙酸后质子化信号强度比例上升到85%.部分脂质几乎全部以质子化形式出现.另外,通过比较DESI成像中检测到的59种脂质的信号发现,加酸后这59种脂质的质子加合物的信号强度总和提高约5倍,而其钠、钾加合物的信号强度总和分别降低了52%和75%[图2(B)].同时还发现,使用三氟乙酸后新增的12个脂质全部以质子化形式出现.以上结果表明,加酸有助于抑制脂质金属离子加合物的形成,提高质子化效率,从而有助于简化谱图及后续的定量分析.

Fig.2 Formation of protonated lipids promoted by trifluoroacetic acid and formation of sodium and potassium adducts of lipids inhibited by trifluoroacetic acid
2.2 三氟乙酸增强的DESI-MSI同时获得多种脂质的空间分布
利用三氟乙酸增强的DESI-MSI对小鼠脑组织的矢状面切片进行了成像分析,图3(A)示出了71种脂质在矢状面切片上的空间分布.通过与相邻切片的染色结果比对并结合脑组织的主要解剖特征,确定矢状面切片上16个主要脑区包括:视觉皮层(Visual cortex)、躯体感觉皮层(Somatosensory cortex)、运动皮质(Motor cortex)、岛状皮质(Insular cortex)、梨状皮质(Piriform cortex)、胼胝体(Corpus callosum)、海马(Hippocampus)、纹状体(Striatum)、丘脑(Thalamus)、大脑脚(Cerebral peduncle)、视前区(Preoptic area)、下丘脑(Hypothalamus)、上丘(Superior colliculus)、中脑(Midbrain)、脑干(Brainstem)和小脑(Cerebellum)[图3(B)].

Fig.3 Spatial distributions of lipids revealed by trifluoroacetic acid-enhanced DESI-MSI
由图3可见,71种脂质在小鼠脑组织切片上体现了不同的分布规律.在脑区白质区域(由神经元的轴突或长树突集聚而成,不含胞体只有神经纤维的脑区,如胼胝体、丘脑、大脑脚、中脑、脑干和小脑内围等)有21种脂质的含量较高,其中包含11种PC[如PC(40:1)],6种PE[如PE(P-34:1)],3种PS[如PS(36:1)]以及1种PA(40:2).而在剩下的灰质区域(神经元胞体及其树突聚集的脑区)中,15种脂质的含量相对较高,其中包括PC(32:0),PE(P-38:6),PS(40:6)及SM(d36:1)等.另外,少数脂质主要分布在某些特定脑区,如PC(40:6),PS(36:2)和SM(d38:1)主要分布在小脑外周的灰质区域,而PE(P-36:4)主要分布在纹状体.以上结果表明,利用三氟乙酸增强的DESI-MSI方法可实现小鼠脑组织中多种脂质的同时成像分析.
此外,对于DESI-MSI中可能存在的高速喷雾液滴对邻近样品点的影响,参考文献[18~20]方法,通过对喷雾溶剂的流速和种类、毛细管与样品的距离和角度等进行调控,使带电喷雾液滴撞击样品表面后获得面积更小、更接近圆形分布的撞击面,从而进一步提高成像的空间分辨率.
2.3 空间分布相关性分析
研究表明,生物组织中2种物质之间若存在较强的空间相关性,则两者间可能存在潜在的代谢关联[21].三氟乙酸增强的DESI-MSI增加了检测到的脂质种类,因此可以用其对更多种类的脂质展开空间分布相关性的研究.本文采用皮尔森相关系数(rij)来评估2种脂质空间分布的相关性[13,21~23].
2.3.1 全脑层面空间分布相关性分析小鼠脑组织中的脂质主要有PC,PE以及PS 3种,分别研究了它们在全脑层面空间分布的相关性(空间分布如图3所示).PC是大脑细胞膜的主要成分之一,参与细胞信号传导等重要生理过程.图4示出了全脑层面30种PC之间的654个rij值,其中有94个rij≥0.7,表明这些脂质间具较强的空间正相关性.如,PC(42:1)与PC(42:2)之间的rij值为0.91,PC(P-38:1)与PC(P-34:1)之间的rij值为0.81,均主要分布在胼胝体、丘脑等白质区域.由于未添加三氟乙酸的DESIMSI无法检测到PC(42:2)和PC(P-34:1),故无法评估它们与其它脂质的空间相关性.另外,一些PC的空间分布也表现出较强的负相关性,如,PC(42:2)与PC(32:0)之间的rij值为-0.62.由图3还可看出,PC(42:2)主要分布在脑组织的白质区域,而PC(32:0)主要分布在皮层、纹状体等灰质区域.以上结果表明,利用三氟乙酸增强的方法对更多的PC空间相关性进行研究,可能为研究PC间潜在代谢提供新的研究手段.

Fig.4 Pearson correlation coefficients(rij)calculated among the spatial distributions of 30 PCs in the whole brain tissue section

Fig.5 Pearson correlation coefficients(rij)calculated among the spatial distributions of 28 PEs(A)and 8 PSs(B)in the whole brain tissue section
PE是细胞膜的另一个重要组成部分,主要位于大脑神经系统.据报道,在细胞凋亡的早期,PE从细胞膜内侧翻转到外侧,与PS共同为细胞提供早期凋亡信号[24~26].由图5(A)可见,PE(38:2)与PE(P-38:1)和PE(P-38:2)之间均具有较强的空间正相关性,其对应的rij值分别为0.92和0.93,从成像图上看三者均主要分布在胼胝体、丘脑等白质区域.而PE(38:4)与PE(P-38:1)和PE(P-38:2)之间的空间分布呈负相关,对应的rij值分别为-0.46和-0.47,其中,PE(38:4)主要分布在白质区域,而PE(P-38:1)和PE(P-38:2)主要分布在皮层、纹状体等灰质脑区.PS作为细胞膜的第三大磷脂成分,具有增强大脑记忆的功能.PS具有很强的亲脂性,从人体吸收后可以迅速通过血脑屏障进入大脑,起到舒缓血管、增强脑部供血的作用[27,28].利用未添加三氟乙酸的DESI-MSI只检测到3种PS[PS(40:0),PS(40:9)和PS(42:9)],而添加三氟乙酸后则再检测到5种PS[即PS(36:1),PS(36:2),PS(38:4),PS(40:4)和PS(40:6)].图5(B)示出了8种PS在全脑层面的rij值.PS(40:0)与PS(36:1),PS(38:4)在白质区域分布呈现强烈的正相关性,相应的rij分别为0.93[PS(40:0)和PS(36:1)],0.71[PS(40:0)和PS(38:4)]和0.76[PS(36:1)和PS(38:4)].另外,PS(40:6),PS(40:9)以及PS(42:9)在灰质区域的含量相对较高,三者间也具有较强的空间正相关性.以上结果表明,利用三氟乙酸增强的DESI-MSI可以研究更多种类的PS空间分布的相关性.
2.3.2 脑区层面空间分布相关性分析大脑按照生物功能及解剖特征可分为若干脑区.除了从全脑层面探索各脂质间的相关性,还有必要深入探索脂质在具有重要生物功能脑区的相关性.例如,小脑负责调整肌紧张、维持身体平衡、控制肌肉张力和协调等[29].分析表明,部分PS间在小脑表现独特的空间分布相关性.PS(36:2)与PS(36:1)在全脑层面无显著相关性[rij=0.15,图6(A)],但两者在小脑区域表现出较强的空间负相关性[rij=-0.48,图6(B)],其中PS(36:1)主要分布在小脑内围的白质区域,而PS(36:2)主要分布在小脑外围的灰质区域.PS(36:2)与PS(40:6)在全脑层面也无显著相关性[rij=-0.11,图6(C)],但两者在小脑外围的灰质部分体现出了很强的正相关性[rij=0.86,图6(D)].综上所述,从脑区层面开展更详细的脂质空间分布相关性探索,可为揭示潜在的脂质代谢途径提供新的研究思路.
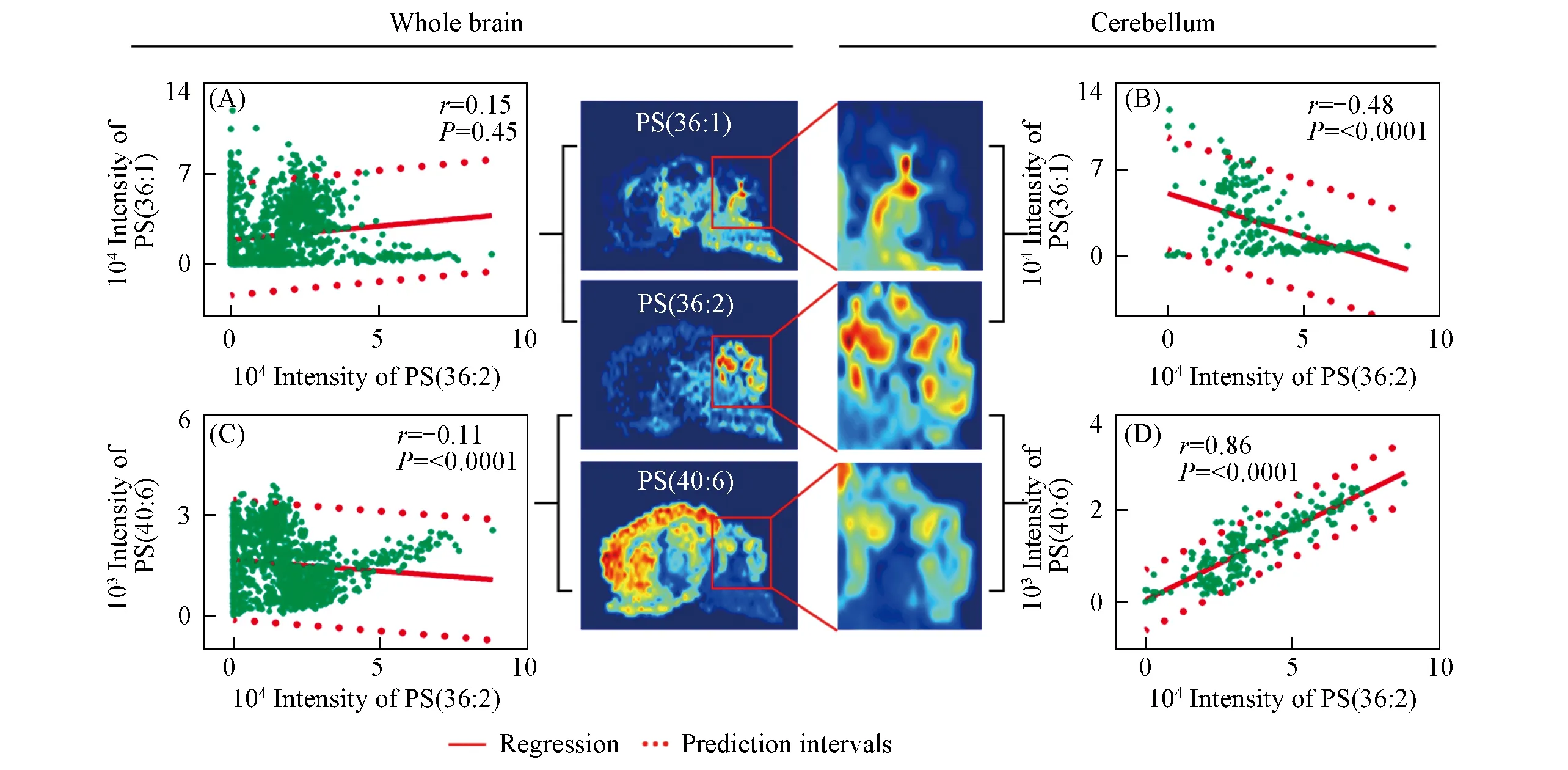
Fig.6 Correlations between the spatial distributions of PSs in the cerebellum
3 结 论
利用三氟乙酸增强的DESI-MSI实现了小鼠脑组织切片中更多脂质的同时成像分析,将可成像的脂质种类从59种提高到71种.利用该方法可以研究更多种类的脂质在小鼠脑组织上的空间分布相关性.另外,通过脑区层面分布相关性研究,可以发现部分脂质之间在某些特定功能脑区会表现独特的空间相关性,有利于后续深入研究全脑以及特定脑区的脂质代谢异常及可能的代谢调控.用三氟乙酸增强的方法对脑组织脂质进行原位分析,有望为探索大脑相关疾病(如阿尔兹海默症、动脉粥样硬化和帕金森病等)的发病机制以及研发基于代谢调控的治疗方法提供新的研究手段.
支持信息见http://www.cjcu.jlu.edu.cn/CN/10.7503/cjcu20200448.
