仙台病毒荧光定量PCR检测方法的建立及初步应用
2020-12-23黄宗文
黄宗文 王 吉 马 宏
(1.北京理工大学,北京 100081)(2.中国食品药品检定研究院,北京 102629)
仙台病毒(Sendai virus,SeV)在病毒分类上属于副黏病毒科、呼吸道病毒属病毒,病毒核酸为单股负链 RNA,基因组长度 15 384个核苷酸[1-2]。1953年在日本仙台首次发现,命名为Fushimi株[3]。仙台病毒可引起啮齿类动物呼吸系统疾病,感染仙台病毒的动物免疫系统会受到影响,可能影响药效学实验结果,且被仙台病毒感染的动物群很难净化[4-6]。
现行实验动物微生物等级国家标准对大鼠、小鼠、豚鼠、地鼠清洁级及以上等级,必检项目中均含有仙台病毒[7],但ELISA存在检测耗时较长,包被抗原较难制备,需要免疫动物制备阳性血清等问题[8]。
实时荧光定量PCR(fluorescent quantitative PCR,FQ-PCR)方法有灵敏度较高、直接检测病毒核酸并可以对核酸浓度定量检测等优点[9]。本研究建立了特异的SeV实时荧光定量PCR检测方法,能够快捷、准确地检测样本中仙台病毒的核酸含量。
裸鼹鼠具有抗衰老、耐低氧、耐疼痛等方面的特性,目前广泛用于脑神经、抗氧化、肿瘤等方面的研究。本文应用建立的方法对裸鼹鼠SeV进行了携带情况筛查。
1 材料与方法
1.1 材料
1.1.1 病毒及样品:仙台病毒、小鼠肝炎病毒(MHV-V1)、呼肠孤病毒3型(Reo3)、淋巴细胞脉络丛脑膜炎病毒(LCMV),中国食品药品检定研究院实验动物质量检测室保存;小鼠肺炎病毒(PVM),美国ATCC(编号:VR-25);40只SPF小鼠,国内某单位送检;4只屏障环境饲养黄鼠样本,国内某单位送检;5只6周龄清洁级小鼠,国内某单位送检;58份裸鼹鼠样本,中国人民解放军第二军医大学。
1.1.2 主要仪器与试剂:荧光定量 PCR仪(7500 fast Real-Time PCR System),ABI公司;逆转录试剂盒,AMV Reverse Transcriptase,购自 Promega公司;RNA提取试剂盒,购自 QIAGEN公司;SYBR®Premix Ex TaqTMGC,TaKaRa公司。
1.2 方法
1.2.1 引物的设计:将不同株仙台病毒序列进行比对,发现一段保守序列,位于RNA polymerase protein基因,序列号:NC_001552.1(8 556~15 242),对此保守序列设计引物。序列见表1。

表1 引物序列Table 1 The sequences of primers
人工合成SeV基因组12 181~12 480 DNA序列,转入pMD19-T质粒中,作为SeV质粒标准品。
1.2.2 病毒 RNA提取、逆转录:对正常鸡胚尿囊液、SeV 感染鸡胚尿囊液、Reo3、PVM、MHV、LCMV,进行RNA提取操作,以提取的 RNA为模板,用AMV Reverse Transcriptase试剂盒逆转录获得cDNA。
1.2.3 实时荧光定量PCR扩增体系及标准曲线的建立:用含有目的片段的质粒pGEM-T Easy-pol作为标准品,按 109~100copies/μL梯度稀释,作为进行实时荧光定量PCR反应的模板,建立标准曲线。扩增体系如下:Premix 10μL,引物1μL,待检测模板1μL,RNase-free Water 8μL,体系 20μL。 扩增条件为:每个循环 50℃2 min,95℃10 min,95℃15 s,60℃1 m in,扩增40个循环。
1.2.4 特异性实验:以 SeV、Reo3、PVM、MHV、LCMV及鸡胚尿囊液阴性对照为扩增模板,检测SeV实时荧光定量PCR检测方法的特异性。
1.2.5 最低检出限实验:以109~100copies/μL 质粒标准品为模板,进行实时荧光定量PCR扩增,每个浓度标准品各做3个平行。扩增反应循环阈值(Ct)≤35,拷贝数(copies)≥10时,对应的最低模板浓度为方法的最低检出限。
1.2.6 重复性和稳定性实验:以 107copies/μL、106copies/μL、105copies/μL 3个不同浓度阳性质粒标准品为模板,扩增3次,计算批间变异系数。
1.2.7 实时荧光定量PCR方法的应用
1.2.7.1 用建立的Q-PCR方法对40只SPF小鼠、4只黄鼠、5只清洁级小鼠、58只裸鼹鼠肺组织检测,同时设 109~105copies/μL质粒标准品对照。按1.2.4扩增体系和条件扩增。
1.2.7.2 判断标准的确定
扩增效率Eff%在90%~110%之间,建立的标准曲线相关系数R2>0.99,实验成立。
样品同时满足循环阈值(Ct)≤35,拷贝数(copies)≥10,判定为阳性。其余情况判定为阴性。
1.2.8 动物样本ELISA方法检测:以国家标准中ELISA方法对40只SPF小鼠、4只黄鼠、5只清洁级小鼠、58只裸鼹鼠血清检测[8]。
2 结果
2.1 实时荧光定量PCR扩增体系及标准曲线的建立
以质粒标准品作为模板,进行扩增反应,模板浓度为 1.0×107、1.0×106、1.0×105、1.0×104、1.0×103copies/μL,扩增曲线见图 1,扩增效率 Eff%为99.362%,标准曲线(图2)相关系数R2值为0.999。

图1 1×107~1×103copies/μL标准品扩增曲线Fig.1 The am p lification curve of 1×107—1×103copies/μL standard
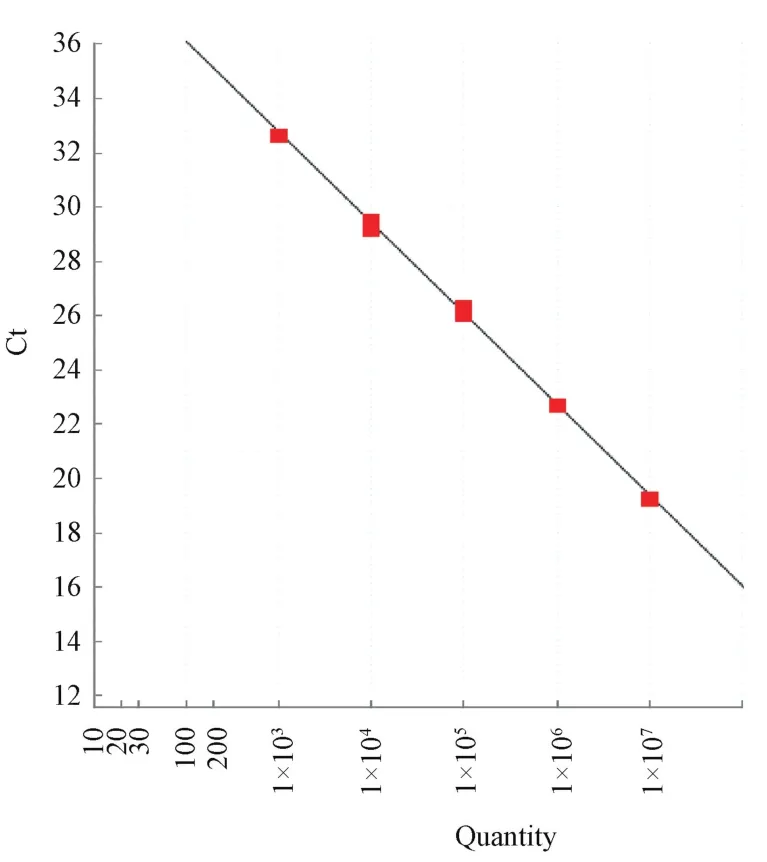
图2 1×107~1×103copies/μL标准品标准曲线Fig.2 The standard curve of 1×107—1×103copies/μL standard
2.2 方法特异性验证
实时荧光定量PCR检测方法特异性检测,分别以 SeV、Reo3、PVM、MHV、LCMV、正常鸡胚尿囊液的cDNA为模板进行扩增,结果如图3所示,可以看出以SeV的 cDNA为模板扩增曲线明显,而以Reo3、PVM、MHV、LCMV、鸡胚尿囊液的 cDNA 为模板,则无扩增。显示该方法可对仙台病毒特异检测。

图3 SeVQ-PCR特异性检测结果注:1:SeV;2~7:Reo3、PVM、MHV、LCMV、正常鸡胚尿囊液Fig.3 Specifictesting results of SeVQ-PCRNote:1:SeV;2-7:Reo3、PVM、MHV、LCMV、normal chick embryo allantoic fluid
2.3 方法稳定性和重复性验证
检测质粒标准品 3个浓度对应的 Ct、标准差(CtSD)及变异系数见表2。各质粒标准品浓度3次检测结果Ct的变异系数<5%,说明该方法稳定、可重复。

表2 荧光定量PCR检测方法的重复性和稳定性试验结果Table 2 The repeatability and stability testing results of Q-PCR
2.4 最低检测限度结果
如图 4、图 5所示,标准曲线扩增效率为100.644%、相关系数R2值为0.994。质粒标准品模板浓度为10 copies/μL时仍有曲线扩增,Ct为34.031,该方法检测结果为10.653 copies/μL,偏差较小;可认为最低检测限度为10 copies/μL。

图4 1×109~1×100copies/μL标准品的标准曲线Fig.4 The standard curve of 1×109—1×100cop ies/μL standard

图5 1×109~1×100copies/μL标准品扩增曲线Fig.5 The am p lification curve of 1×109—1×100copies/μL standard
2.5 实时荧光定量PCR方法的应用
2.5.1 SPF小鼠检测结果:将该方法用于40只SPF小鼠的肺组织样本的检测,得到扩增曲线(图 6)。

图6 40只SPF小鼠扩增曲线Fig.6 The amplification curve of 40 SPF mice
经过荧光定量PCR检测,40只SPF小鼠肺组织样本的循环域值(Ct>35)和拷贝数(copies<10)均在检测限之外,判定上述样本为阴性。
2.5.2 黄鼠检测结果:将所建立的实时荧光定量PCR方法用于4份黄鼠的肺组织样本的检测,标准品为109~102copies/μL,得到扩增曲线(图7),阳性率为 100%(表 3)。

图7 黄鼠扩增曲线Fig.7 The amplification curve of Sperm ophilus dauricus

表3 黄鼠检测结果Table 3 The testing resu lts of Sperm ophilus dauricus
2.5.3 清洁级小鼠检测结果:将所建立的实时荧光定量PCR方法用于5只清洁级小鼠样本的检测,标准品为109~102copies/μL,得到扩增曲线(图 8),阳性率为100%(表4)。

图8 清洁级小鼠扩增曲线Fig.8 The amplification curve of clean mice
2.5.4 裸鼹鼠检测结果:将所建立的实时荧光定量PCR方法用于58只裸鼹鼠的肺组织样本的检测,得到扩增曲线(图9)。
表4 清洁级小鼠检测结果Table 4 The testing results of clean mice
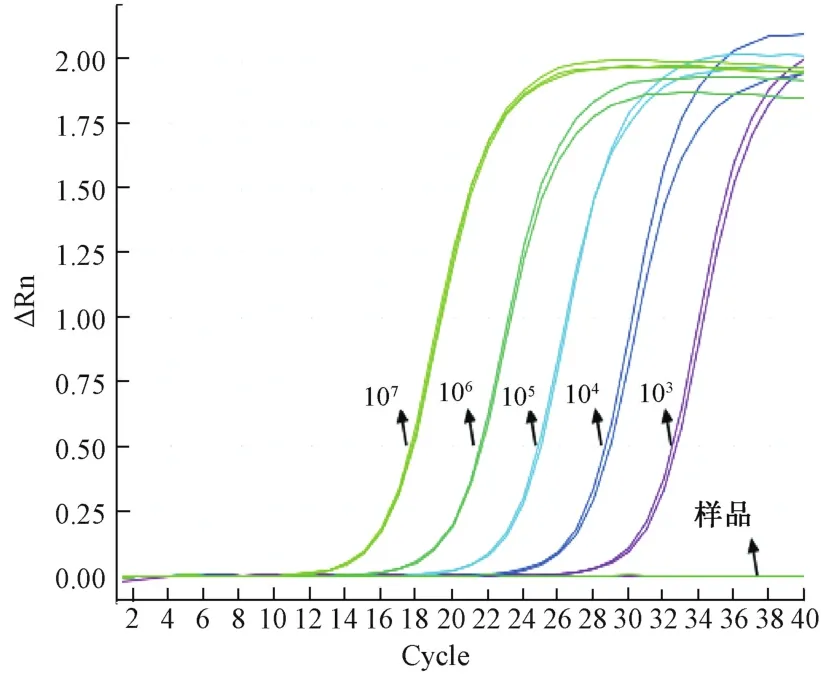
图9 裸鼹鼠扩增曲线Fig.9 The amplification curve of naked molerats
经过荧光定量PCR检测,58份裸鼹鼠肺组织样本的循环域值(Ct>35)和拷贝数(copies<10)均在检测限之外,判定上述样本为阴性。
2.6 ELISA方法检测结果
检测样本信息及结果见表5。

表5 ELISA方法检测结果Table 5 The testing results of ELISA method
3 讨论
仙台病毒在啮齿类动物中广泛传播,并引起动物支气管肺炎。在小鼠中有些情况引起临床反应,有的为隐形感染,这和宿主有关,比如小鼠暴露的年龄或小鼠品系对仙台病毒感染的敏感性[10-11]。另外,仙台病毒的不同毒株对小鼠致病性也不同。同时仙台病毒还是人兽共患病原,对人具有感染性,引起人的肺炎等呼吸道疾病[5]。因此,仙台病毒是鼠源性生物制品及其生产原材料外源病毒必须排除项目[12]。
从ELISA抗体检测结果和本文建立的Q-PCR方法检测结果可知,40只SPF小鼠和58只裸鼹鼠检测结果一致,均为阴性,说明送检动物确实无SeV感染。5只清洁级小鼠经ELISA检测阳性率为40%,说明送检小鼠确实存在SV的感染,同时也说明Q-PCR方法可以弥补因抗体在动物体内存在的差异性而导致的ELISA抗体检测方法漏检,也进一步证明建立的方法可以用于动物是否携带SeV的检测。4只屏障饲养的黄鼠经ELISA抗体检测结果均为阴性,经Q-PCR检测结果均为阳性。分析其原因:①送检黄鼠经背景调查来源为野生,且为成年黄鼠,因此在屏障环境饲养前可能就已感染SeV;②由于抗原抗体在动物体内存在的差异性,动物体内可能一直携带病毒,但抗体水平已经下降,抗体检测结果可能会为阴性。现在国内对仙台病毒检测主要为ELISA方法,通过检测血清中仙台病毒抗体间接反映病毒感染情况,存在步骤烦琐、耗时长、不能反映实时病毒感染状态等缺点,且药典关于“鼠源性病毒检查法”中仙台病毒的检测方法也仅局限于动物抗体产生、细胞接种和鸡胚接种等方法[12]同样存在检测周期长、敏感性低等特点。本文建立的荧光定量PCR方法操作快捷、灵敏、特异[13-18],可以定量检测样本病毒拷贝数[19-22],不仅可以用于动物的检测及反映动物感染状态,同时可以用于动物源性生物制品或生产原材料外源仙台病毒因子的检测,为用药安全提供保障。
目前市场上商品化SeV核酸检测商品化试剂匮乏。因此本实验建立的方法,不仅可以开展对小鼠、黄鼠、裸鼹鼠等动物及鼠源生物制品外源 SeV的检测,为保证实验小鼠、黄鼠、裸鼹鼠等实验动物使用安全性及为实验动物标准化研究提供依据,同时也为试剂盒的研制奠定了基础。
