苦竹笋总黄酮大孔树脂纯化工艺及其体外抗炎活性研究
2020-12-23晏俊玲樊扬秦川欧雪陈姝娟敖晓琳
晏俊玲,樊扬,秦川,欧雪,陈姝娟,敖晓琳
(四川农业大学 食品学院,四川 雅安, 625014)
苦竹笋为禾本科苦竹(Pleioblastusamarus)的嫩芽,广泛分布于我国南方地区[1]。在我国不仅是一种传统的绿色食品原料,还被用于民间医学,治疗痢疾、腹泻、糖尿病、炎症和传染病等[2]。近年来,竹笋因其较高的药用价值和开发利用前景而受到广泛关注。研究发现,苦竹笋中含有黄酮类、蛋白质、膳食纤维、生物碱和木质素及微量元素等,具有抗氧化、抗炎、抗菌、保肝、降血脂、免疫调节等作用[3-4]。苦竹叶和苦竹枝黄酮的纯化工艺和生物活性已有报道,但目前对苦竹笋黄酮的纯化工艺和生物活性尚未阐明。因此,本试验以苦竹笋总黄酮含量为指标,通过考察大孔吸附树脂对苦竹笋黄酮的吸附性能,筛选出最佳纯化工艺条件。此外,在脂多糖(lipopolysaccharide,LPS)激活的RAW264.7细胞中,对纯化的苦竹笋总黄酮的抗炎特性进行了评估,以期为后续开发功能性食品提供理论依据。
1 材料与仪器
1.1 材料与试剂
苦竹笋采自四川省雅安市;芦丁标准品(纯度≥98%),上海瑞永生物科技有限公司;NaNO2、无水乙醇、NaOH等化学试剂均为分析纯,大孔吸附树脂ADS-17、HPD500、S-8、HPD400、HPD100、AB-8、X-5、NKA-9、D101,华溢新材料, 其主要性能参数见表1所示。

表1 大孔吸附树脂的型号及物理性能Table 1 Models and physical properties of macroporous adsorption resin
1.2 仪器设备
Varioskan LUX酶标仪,赛默飞世尔科技有限公司;FA2004B电子天平,上海精天电子仪器有限公司;FW135高速冷冻干燥机,永康市小宝电器有限公司;RE 52-99旋转蒸发器,上海亚荣生化仪器厂;LGJ-18S真空冷冻干燥机,上海力辰邦西仪器科技有限公司;S28L超声波清洗器,东莞市墨洁超声波设备有限公司;7D-4Z台式高速离心机,蜀科仪器有限公司。
2 实验方法
2.1 苦竹笋总黄酮提取液的制备
苦竹笋经冻干粉碎、脱脂处理后,在料液比1∶27(g∶mL)、乙醇体积分数88%、超声功率200 W、提取温度60 ℃、提取时间25 min的条件下,提取2次,过滤后合并2次滤液,减压浓缩无醇味后置于4 ℃保存备用。
2.2 标准曲线的绘制及总黄酮含量测定
参照吴昊等[5]的方法并稍作修改。以芦丁为标准品,采用亚硝酸钠-硝酸铝显色法测定苦竹笋总黄酮含量。精确称取芦丁标准品20.00 mg于20 mL的容量瓶中,并用体积分数60%乙醇溶解,即得1 mg/mL的芦丁标准溶液。准确吸取芦丁溶液0.0、1.0、2.0、3.0、4.0、5.0 mL于10 mL 容量瓶中,分别加入300 μL的50 g/L NaNO2溶液,揺匀静置5 min,再加入300 μL的100 g/L Al(NO3)3溶液,揺匀静置5 min,最后加入4.0 mL 40 g/L NaOH溶液,体积分数为60%的乙醇定容,揺匀静置15 min,在510 nm波长处测量吸光度。以芦丁质量浓度(mg/mL)为横坐标,吸光度值为纵坐标绘制标准曲线:y=4.845 2x-0.003 3,R2=0.999 8,根据标准曲线计算出总黄酮的含量。
2.3 静态吸附与解吸实验
2.3.1 大孔吸附树脂选型
2.3.1.1 大孔吸附树脂预处理
大孔吸附树脂预处理参照冯靖等[6]的方法并略作修改。9种大孔吸附树脂用去离子水冲洗,除去白色漂浮物,滤纸吸走树脂水分,再用无水乙醇浸泡树脂24 h,去离子水冲洗至无醇味,冲洗液无白色浑浊,40 g/L HCl溶液浸泡5 h,去离子水反复冲洗至中性,40 g/L NaOH溶液浸泡5 h,去离子水清洗树脂至中性,滤纸吸去树脂表面水分,备用。
2.3.1.2 树脂吸附量、吸附率及解吸率的测定
准确称量已处理好的9种大孔吸附树脂(ADS-17, HPD500, S-8, HPD400, HPD100, AB-8, X-5, NKA-9, D101)各2 g分别放入锥形瓶中,向其中各加入粗提取液20 mL(总黄酮浓度1.55 mg/mL),封口,在25 ℃、120 r/min的气浴恒温振荡器上避光振荡12 h,待充分吸附后,过滤,取上清液,按照2.2的方法测定吸光度值,按照公式(1)(2)计算树脂吸附量和吸附率。将吸附后的树脂分别加入20 mL体积分数 50%乙醇,封口后,置于20 ℃、120 r/min的气浴恒温摇床上连续振荡12 h,使其完全解吸附,过滤后测定吸光度值。按照公式(3)计算树脂解吸率[7]。
(1)
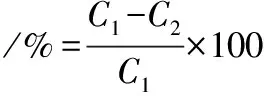
(2)

(3)
式中:q,饱和吸附量,mg/g;C1,苦竹笋粗提液中总黄酮质量浓度,mg/mL;C2,吸附饱和后溶液中总黄酮质量浓度,mg/mL;V1,吸附液总体积,mL;m,树脂干重,g;C3,解吸液中总黄酮质量浓度,mg/mL;V2,解吸液总体积,mL。
2.3.1.3 大孔吸附树脂动力学实验
准确称取2.0 g AB-8树脂置于锥形瓶中,再加入20 mL苦竹笋总黄酮粗提液(1.55 mg/mL)后将锥形瓶放于气浴恒温摇床内,在25 ℃、120 r/min的条件下,充分振荡12 h,每隔一定时间(0、10、20、30、40、50、60、90、120、270、360、480、600、720 min)取1 mL上清液,测定总黄酮质量浓度[8]。为了更好地了解可能的吸附机理,实验数据采用粒子内扩散模型、准一级和二级模型进行分析,计算方程分别见公式(4)(5)和(6)[8]。
粒子内扩散模型线性关系为:qt=kit0.5+C
(4)
准一级吸附动力学模型:ln(qe-qt)=lnqe-k1t
(5)
(6)
式中:ki,扩散速率常数,mg/(g·min0.5);k1,一级吸附速率常数,min-1;k2,二级吸附速率常数,g/(mg·min);C,常数;qe,平衡时吸附量;qt,t时刻的吸附量,mg/g。
2.3.1.4 吸附等温线和热力学实验[9]
制备不同质量浓度(0.31、0.62、0.93、1.24、1.55、1.86 mg/mL)的总黄酮样品,称取2.0 g树脂置于锥形瓶中,再加入20 mL样品溶液,分成3组,每组含有6种不同浓度的样品,分别置于25、35和45 ℃,120 r/min的气浴恒温摇床上连续振荡12 h,测定总黄酮含量,为研究吸附特性,采用Freundlich和Langmuir模型对试验数据进行分析,Freundlich和Langmuir模型的吸附等温方程分别见公式(7)(8):
(7)
(8)
式中:qm,最大吸附容量,mg/g,Ce,吸附平衡后的质量浓度,mg/mL;KL,Langmuir模型的平衡常数,mL/mg;KF,Freundlich常数,(mg/g或mL/mg)1/n;1/n,n为表现常数,表示吸附优惠性。
吸附热力学分析能提供更多的理论信息,进一步揭示能量变化和吸附机理,因此分析等量吸附焓变(ΔH)、吸附自由能变(ΔG)、吸附熵变(ΔS)等研究AB-8树脂的热力学性质[10],具体计算见公式(9)(10)和(11):
(9)
ΔG/(kJ·mol-1)=-lnKRT
(10)
(11)
式中:KL,Langmuir模型的平衡常数,mL/mg;M,芦丁的摩尔质量,610.51 g/mol;R,气体常数,8.314 J/(mol·K);T,吸附温度,K。
2.3.1.5 上样液pH值对大孔吸附树脂吸附的影响[9]
称取AB-8树脂2 g于具塞锥形瓶中,分别加入pH值为2、3、4、5、6、7、8、9、10的粗提液20 mL(总黄酮质量浓度1.55 mg/mL),然后将其置于25 ℃、120 r/min的气浴恒温振荡器中,振荡12 h,充分吸附后测定苦竹笋总黄酮质量浓度,并计算其吸附率。
2.3.1.6 乙醇浓度对大孔吸附树脂解吸的影响
取充分吸附饱和的AB-8树脂2 g于具塞锥形瓶中,分别加入20 mL体积分数为10%、30%、50%、70%、90%的乙醇进行解吸,置于25 ℃、120 r/min的气浴恒温振荡器中振荡12 h,充分解吸后测定苦竹笋总黄酮质量浓度,并计算其解吸率。
2.4 动态吸附与解吸实验
为探索最优的富集工艺,利用层析柱(1.6 cm×50 cm)填充AB-8树脂,进行动态吸附与解吸实验。本实验中,床层体积为25 mL。采用不同流速(1、2、3、4 BV/h)(1 BV=25 mL)负载粗液(总黄酮质量浓度1.55 mg/mL)进行吸附工艺研究,根据树脂柱对总黄酮吸附能力选择最佳流速及流量。先用去离子水冲洗树脂柱进行动态脱附处理,然后以不同流速(1、2、3、4 BV/h)用体积分数50%乙醇溶液解吸处理,来优化解吸液的流速和用量。
2.5 工艺验证
按照上述试验所确定的纯化苦竹笋黄酮的最佳工艺条件,进行验证,收集洗脱液,浓缩后冻干成粉末。按照公式(12)计算纯度:

(12)
2.6 抗炎活性研究
2.6.1 总黄酮纯化液的制备
称取苦竹笋粉末50 g,按照2.1的方法制备苦竹笋总黄酮粗提液,再根据最优纯化工艺进行处理,减压浓缩后无醇味置于4 ℃中备用。
2.6.2 抗炎活性测定
RAW264.7细胞培养于质量分数10%胎牛血清和质量分数1%青霉素链霉素的培养基中,37 ℃,体积分数5% CO2及适宜湿度条件下在细胞培养箱中培养。再参照段庆等[11]的方法并稍作修改,采用Griess法检测苦竹笋总黄酮纯化物对RAW264.7细胞产NO活性的抑制作用,将1×104个/孔RAW264.7细胞接种于细胞96孔板中,每孔体积为100 μL,接种孔周围加入新鲜培养基用来排除边缘效应,待细胞贴壁后弃去多余培养基,并进行药物处理。各孔药物处理组分为:阴性对照组(不含有LPS和样品);模型组(LPS组,含有0.5 μg/mL LPS);实验组(总黄酮质量浓度分别为0.14、0.32、0.5、0.68、0.86、1.04 mg/mL)。分别预处理2 h后,除阴性对照组外各组均加入0.5 μg/mL LPS 0.5 μL处理18 h,再吸取50 μL细胞培养上清液,依次加入恢复室温后的Griess ResgentⅠ50 μL和Griess ResgentⅡ50 μL,充分反应后于550 nm波长处检测吸光度。
2.7 数据统计学分析
采用SPSS 18.0软件对试验数据进行处理。
3 结果与分析
3.1 九种大孔吸附树脂对苦竹笋总黄酮的静态吸附与解吸性能
9种大孔树脂对苦竹笋总黄酮吸附能力和解吸能力对比研究结果见图1。大孔吸附树脂对成分的分离特性受很多因素的影响,如树脂的比表面积、极性和孔径大小、溶液性质等[13]。根据图1可知,因树脂的物理化学性质不同导致在相同条件下出现不同的结果,9种大孔树脂对苦竹笋总黄酮的“吸附-解吸”能力都有所不同,其中HPD100、HPD400和AB-8型树脂对黄酮类化合物的吸附能力及解吸能力均优于其他树脂,AB-8的吸附解吸性能最佳,其吸附率79.65%,解吸率68.73%。AB-8是弱极性树脂,可推测苦竹笋中含有弱极性黄酮,3种树脂的比表面积相差不大,而平均孔径AB-8明显大于HPD400和HPD100,说明在本研究中,树脂的极性性质和孔径对吸附解吸过程影响较大。综合考虑几种大孔树脂的吸附量、吸附率和解吸率,选择AB-8进行吸附动力学研究。

图1 九种树脂对总黄酮的吸附/解吸率及吸附量Fig.1 Adsorption/desorption ratio and adsorption capacity of total flavonoids of different resins
3.2 大孔吸附树脂动力学实验
吸附动力学研究对设备选型和工艺设计具有重要意义。本文研究了在25 ℃条件下,苦竹笋总黄酮在AB-8树脂上的吸附动力学性质,如图2-a显示,AB-8树脂对总黄酮的吸附能力在0~120 min快速上升,之后缓慢上升,400 min达到吸附平衡,其平衡时吸附量达到12.77 mg/g。可能是因为刚开始吸附时(0~100 min),树脂表面可提供充足的吸附位点,吸附初期样品溶液中的总黄酮质量浓度较高,可提供较大的推动力来克服阻力,吸收速率较快。随着吸附时间延长到达吸附中期(100~300 min),树脂的吸附位点趋于饱和,溶质从树脂表面进入其内部时受到一定阻力,吸附速率随之减慢。最后吸附处于平衡阶段(400~720 min)[14]。
图2b-d显示的是在25 ℃条件下拟合的3种动力学模型,其吸附动力学方程及相关参数如表2所示。在粒子内扩散动力学模型中,当拟合的qt对t0.5的曲线是一条过原点的直线,说明吸附速率是由粒子内扩散来控制的,如果是一条不通过原点的直线或者是混合曲线时,说明吸附速率不仅受粒子内部扩散控制,同时还受液膜层扩散控制[8]。从图2-b可知,拟合曲线是混合曲线,呈现出2个阶段,可见吸附速率是由液膜层扩散和粒子内扩散双重控制的。由表2中AB-8树脂对总黄酮的吸附动力学方程及参数可知,准二级动力学模型拟合结果的线性关系较好,其相关系数R2=0.998 8,粒子内扩散动力学相关系数最小,两阶段分别为0.996 9和0.977 7。因此,AB-8大孔树脂对苦笋总黄酮的吸附作用更符合准二级动力学吸附模型,且由准二级动力学模型拟合得出的qe与实验测定的qe较为接近。

图2 总黄酮在AB-8树脂上的吸附动力学曲线(a)、粒子内扩散(b)、准二级(c)和准一级(d)吸附模型拟合曲线Fig.2 Adsorption kinetics curves (a), intra-particle diffusion (b), quasi-secondary (c) and quasi-primary (d) of total flavonoids on AB-8 resin

表2 AB-8树脂对总黄酮的吸附动力学方程及参数Table 2 Adsorption kinetics equations and parameters of total flavonoids on AB-8 resin
3.3 吸附等温线模型
通常用线性拟合来描述不同温度下不同浓度的样品(吸附质)和吸附剂的吸附平衡关系[15]。3个不同温度条件下AB-8树脂对总黄酮的吸附等温线及其线性相关结果如图3所示。
从图3可看出,随着样品初始总黄酮浓度增加,吸附能力增强。黄酮浓度较低时,吸附能力迅速提高,吸附后平衡浓度(Ce)达0.5 mg/mL左右时达到饱和,其吸附量趋于平衡,此时上样液总黄酮浓度为1.55 mg/mL。可能是因为上样液浓度增加,与树脂单位表面积接触的黄酮较多,吸附性能较好[16],但上样液浓度过高,杂质也会增加,树脂容易堵塞,同时也会出现吸附过载的情况,使得苦竹笋中的总黄酮没有被吸附完全,也易发生沉淀和絮凝等现象,因此最佳吸附浓度为1.55 mg/mL。并且温度越低,平衡时吸附量越高,25 ℃时平衡吸附量约12.00 mg/g左右,由此可知适当的降温有助于AB-8树脂对苦竹笋总黄酮的吸附。

图3 不同温度条件下AB-8树脂对总黄酮的吸附等温线及其线性相关Fig.3 Adsorption isotherm of AB-8 resin on total flavonoids at different temperatures and its linear correlation
Langmuir模型描述的是单分子层吸附过程,所有吸附位点均匀且具有相同的能量,被吸附分子之间没有相互作用,而单分子层和多分子层的吸附都可以用Freundlich模型模拟,Freundlich模型吸附位点位于非均相表面上且具有不同能量,吸附分子间可能存在相互干扰[17]。
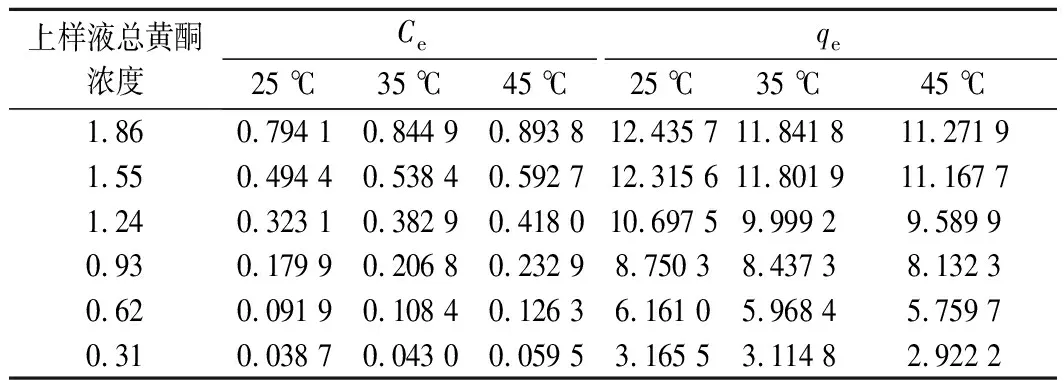
表3 不同温度条件下AB-8树脂对总黄酮的吸附影响 单位:mg/mL
图4建立了分别在25、35、45 ℃条件下AB-8树脂对总黄酮的Langmuir 和Freundlich 模型及其线性相关,表4总结了3种温度下的吸附等温线回归方程及其相关参数,从表3中可看出,Langmuir模型模拟的回归方程相关系数总体高于Freundlich模型,说明Langmuir吸附等温线更能准确反映苦竹笋黄酮在AB-8树脂上的吸附过程。由Langmuir等温线模型可知,当温度从25 ℃提高到45 ℃时,qm从14.13降至13.75 mg/g,表明苦竹笋总黄酮对AB-8型树脂的吸附是放热的。而在Freundlich等温线模型中,25 ℃时,KF值最高,吸附温度升高而KF值反而降低,说明吸附也是放热的,这与等温吸附曲线(图3)所呈现的结果相同。因为温度升高可能会加速溶液中分子的热运动,从而降低黄酮与树脂活性部位之间的接触力,从而降低吸附量[18]。同时1/n值在0.1~0.5,说明AB-8树脂对苦竹笋总黄酮的吸附是有利的。
3.4 热力学实验
以1/T为横坐标,lnK为纵坐标对Van’t Hoff方程进行线性拟合,由直线的斜率和截距可分别算出ΔH和ΔS,相关热力学参数表5。

图4 不同温度条件下AB-8树脂对总黄酮的Langmuir (a) 和Freundlich (b)模型及其线性相关Fig.4 Langmuir (a) and Freundlich (b) models of AB-8 resin on total flavonoids at different temperatures and their linear correlation

表4 AB-8树脂对总黄酮的吸附等温线方程及其相关参数Table 4 Adsorption isotherm equations and parameters of total flavonoids on AB-8 resin
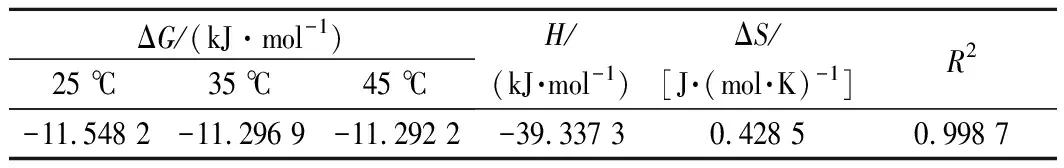
表5 不同温度下的热力学参数Table 5 Thermodynamic parameters at different temperatures
25、35、45 ℃时吸附热力学参数如表4所示。ΔG<0说明吸附是自发的,ΔH<0表明该吸附是放热的,这与等温吸附模型结果一致,此外,ΔH<40 kJ/mol且0 kJ/mol<|ΔG|<20 kJ/mol,表明AB-8树脂对苦竹笋总黄酮的吸附是物理吸附过程,这符合常规大孔吸附树脂的吸附规定[12]。同时ΔS>0,这可能是由于吸附过程中,溶质吸附同时也伴随着溶剂脱附,即溶剂置换过程,随着树脂表面的吸附位点不断被黄酮分子覆盖,大量水分子脱附,吸附体系中溶质的体积远远大于溶剂(水)的体积,同时水的摩尔体积小于吸附质的摩尔体积,更有利于在溶液中作自由运动,而水分子脱附产生的熵变也大于总黄酮吸附所产生的熵变,所以导致整个吸附体系混乱度增加。这于徐祖伟等[12]研究结果相似。
3.5 pH对AB-8树脂吸附性能的影响
上样液pH值对树脂的吸附能力有重要影响。pH值可以通过影响样品分子的电离程度来影响溶质与吸附剂之间的亲和力[19]。如图5所示,当样品溶液pH值从2增加到7时,树脂吸附率呈上升趋势,在pH值为7时达到最大吸附率(75.17%),而后吸附率不断下降。可见,过酸过碱的环境都会影响树脂对苦竹笋总黄酮的吸附,也有研究表明黄酮类化合物在过酸过碱的环境中的稳定性较差[6],这可能由于pH较高,黄酮类化合物中的酚羟基更易分离H+,氢键相互作用减少,从而导致出现较低的吸附能力。因此最佳上样液pH值为7。
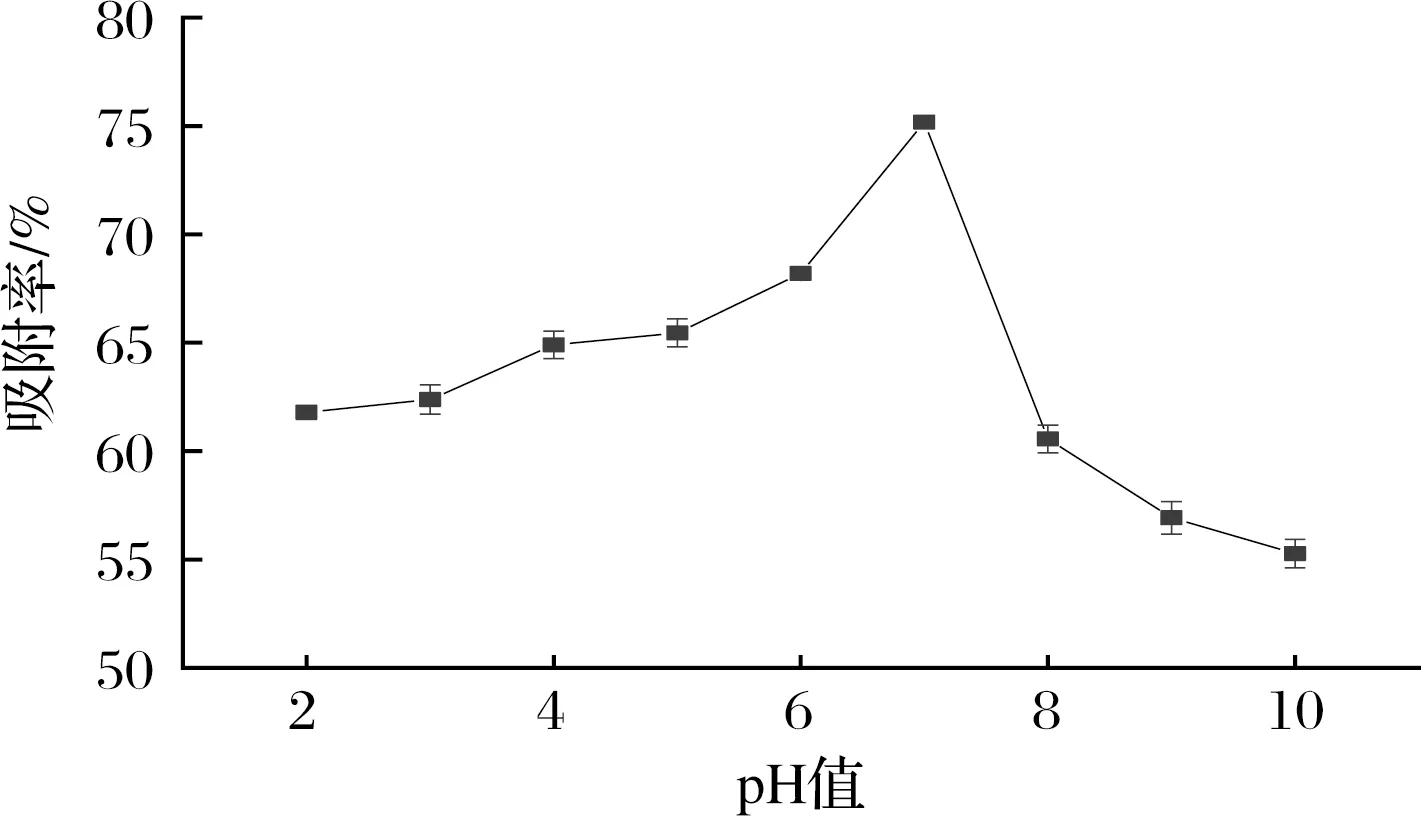
图5 上样液pH值对吸附率的影响Fig.5 Effect of pH value on adsorption rate
3.6 乙醇体积分数对AB-8树脂解吸性能的影响
乙醇是一种易于从溶液中去除、可循环利用、价格低廉的有机溶剂,因其安全性较好在实验室应用广泛[20]。因此,在本研究中,选取不同体积分数(10%、30%、50%、70%、90%)的乙醇作为洗脱液,对苦竹笋总黄酮进行静态解吸,结果见图6。
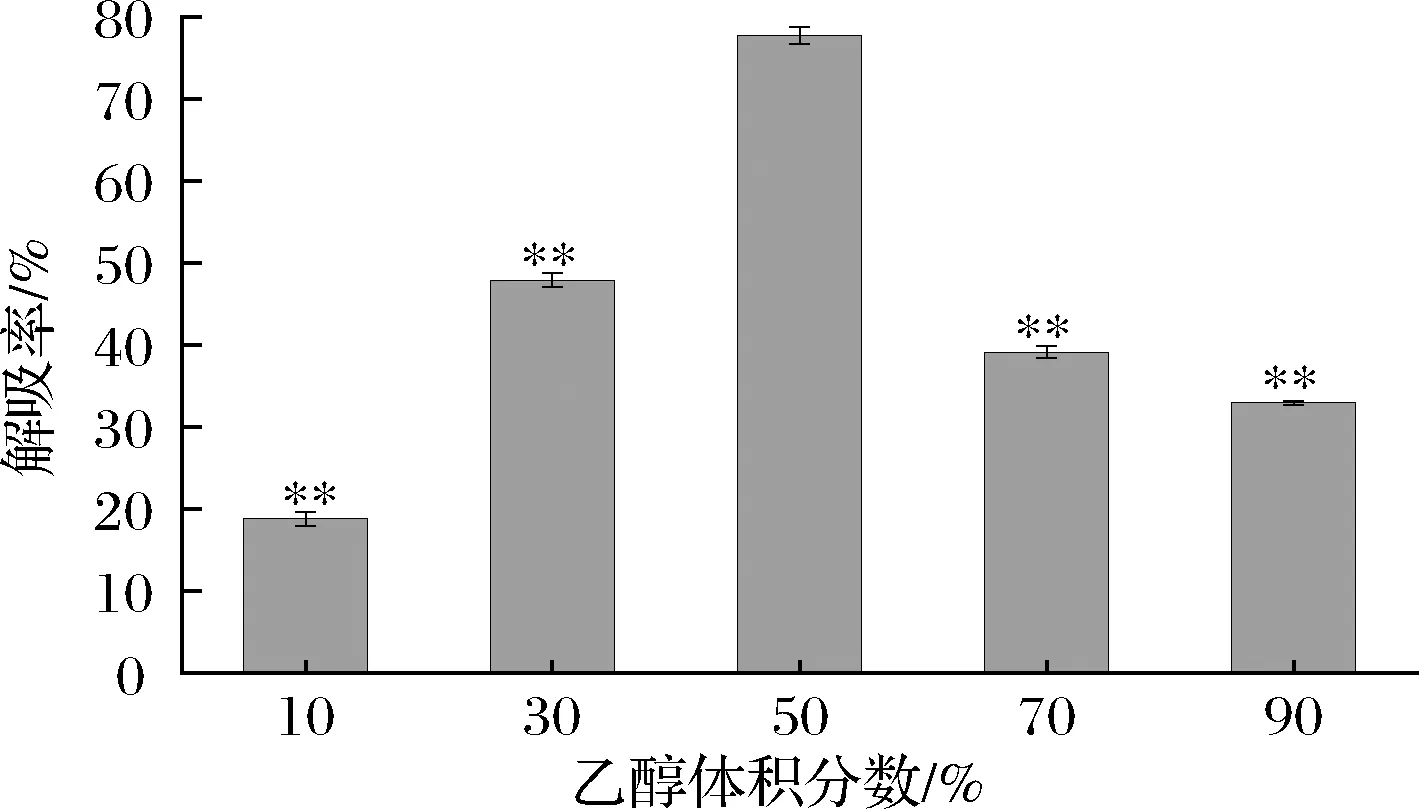
图6 乙醇体积分数对解吸率的影响Fig.6 Effect of concentration of ethanol concentration on adsorption rate注:与乙醇体积分数50%相比,*表示P<0.05,**表示P<0.01
结果表明,其解吸率分别为15.83%、47.89%、77.79%、39.15%、32.96%。由此可见,随着洗脱剂浓度的增加,解吸率也在增加,当乙醇浓度达到50%时,解吸率最大,而后解吸率反而降低。曾有相似研究也证实,黄酮类化合物不易溶解在较低浓度的乙醇中,而一些醇溶性杂质可能溶解在高浓度的乙醇中,导致解吸性能在一定程度上下降[21-22]。
并且树脂分子之间的吸附力与溶解度之间的相互作用对树脂中黄酮类化合物的解吸起着重要作用,当分子间作用力达到稳定时,黄酮类化合物会从树脂中解吸到溶剂中。黄酮类化合物与树脂之间也存在范德华力,当两者极性相近时,范德华力最大,AB-8为弱极性树脂,这也说明苦竹笋总黄酮样液中的黄酮类化合物极性较弱。因此50%(体积分数)乙醇为苦竹笋总黄酮最佳洗脱剂。
3.7 动态吸附解吸
上样液体积和流速与饱和吸附量有很大的关系,因此通常建立不同上样液流速下的动态吸附曲线来优化上样液的流速和体积。上样液流速影响黄酮样液向树脂内表面扩散,决定吸附效果,流速过大,黄酮样液未完全被树脂接触,提早泄露,吸附性能降低;而流速过小,所需时间延长,生产效率低[23]。由图7-a可知,流速越低,因适当延长了吸附时间,越晚达到泄露临界点。这可能是由于适当延长吸附时间对粒子内扩散过程及液膜层扩散有良好的影响,从而有助于提高吸附能力。一般情况下,流出液的目标物质质量浓度达到上样液目标物质质量浓度的1/10时,认为达到了目标物质的泄露点,流速为1、2、3、4 BV/h时,泄露体积分别约为4.2、3.2、2.8、2.4 BV,因此综合考虑1 BV/h为最佳上样流速,进样体积为4.2 BV(105 mL)。由图7-b可知,洗脱流速为4 BV/h时,解吸性能较好。洗脱速度为1、2、3、4 BV/h时,洗脱量分别约为4.5、5.8、6.5、8 BV,回收率达到50.96%、58%、64.52%、75.58%。因此选取4 BV/h为最佳流速,洗脱体积为8 BV(200 mL)。

图7 AB-8树脂柱在不同流速下总黄酮的动态吸附曲线(a)和动态解吸曲线(b)Fig.7 Dynamic breakthrough curves (a) and dynamic desorption curves (b) of total flavonoids on AB-8 resin column at different flow rates.
3.8 验证实验
通过上述试验,确定了最适宜纯化苦竹笋总黄酮的树脂以及纯化工艺条件,并且最佳工艺条件下,上样液总黄酮质量浓度为1.55 mg/mL,样液pH值为7,以1 BV/h的流速上样4.2 BV(105 mL),充分吸附后以去离子水冲至无色,再用体积分数50%乙醇以4 BV/h的流速进行洗脱,洗脱体积为8 BV(200 mL)。结果表明,经AB-8树脂柱层析进一步富集后,总黄酮回收率可达到(75.58±0.47)%,纯度由原来的(2.46±0.59)%提高至(15.72±0.48)%,提高了约7倍。经验证实验确定该条件有效可行,适宜于苦竹笋黄酮的纯化。
3.9 抗炎活性
NO作为一种重要的炎性介质,其浓度是评价炎症反应程度的重要指标[24]。粗提液与纯化液样品在不同总黄酮浓度(0.14~1.04 mg/mL)下的NO浓度对比结果如图8所示,与对照组相比,LPS能极显著地诱导RAW264.7细胞NO的增加,NO浓度由4.84 μmol/L上升到38.47 μmol/L,增加了约8倍,与LPS组相比,不同质量浓度的样品液处理后,细胞NO生成量均表现出不同程度的抑制效果,各样品对NO浓度的抑制随浓度的增加而增强,同等黄酮浓度下纯化液的NO浓度普遍低于粗提液样品,可见NO抑制率纯化液样品强于粗提液样品,纯化液样品总黄酮浓度达到1.04 mg/mL抑制率可达到97.80%,最终NO浓度为5.60 μmol/L,而同一浓度下的粗提液样品中NO浓度为13.81 μmol/L,抑制率仅为73.22%,说明苦竹笋总黄酮纯化液可更好地抑制LPS诱导小鼠腹腔巨噬细胞中NO的产生,本研究的苦竹笋纯化方法是有效的。

图8 苦竹笋总黄酮纯化液对LPS诱导的小鼠巨噬细胞NO生成量的影响Fig.8 Effect of total flavone purification solution on NO production in LPS-induced mouse macrophages注:与LPS组比较:*表示P<0.05、**表示P<0.01
4 结论
本实验探讨了苦竹笋总黄酮大孔吸附树脂纯化工艺,并对其体外抗炎活性进行研究。在进行动态吸附和解吸试验之前,先对树脂的筛选、吸附动力学、吸附等温线和热力学进行了研究。研究结果表明AB-8型树脂为最佳大孔树脂,对苦竹笋总黄酮吸附率为79.65%、解吸率为68.73%,准二级动力学模型和Langmuir等温线模型对吸附数据进行了最佳描述,吸附过程放热,降温有利于吸附。确定纯化最优工艺为:上样液浓度1.55 mg/mL,上样液pH值为7,洗脱剂浓度50%(体积分数),上样量4.2 BV(105 mL)、上样流速1 BV/h、洗脱剂用量8 BV(200 mL)、洗脱流速4 BV/h,经AB-8树脂柱层析进一步富集后,总黄酮回收率可达到(75.58±0.47)%,纯度由原来的(2.46±0.59)%提高至(15.72±0.48)%。此外,NO是一种常见的炎性介质, 过量的NO可导致一系列炎症疾病的发生[25]。通过对粗提样品和纯化样品的体外抗炎活性评价结果显示,同等黄酮浓度下纯化液的NO浓度普遍低于粗提液样品,纯化样品总黄酮浓度为1.04 mg/mL,抑制率可达到97.80%,最终NO浓度为5.60 μmol/L,而同一总黄酮浓度下的粗提样品中NO浓度为13.81 μmol/L,抑制率仅为73.22%,由此说明,经富集后的苦竹笋总黄酮表现出较好的抗炎活性。综上所述,本实验建立了苦竹笋总黄酮的富集方法,且开发的纯化富集物是有效可行的,适用于苦竹笋总黄酮工业化生产,后续可进一步通过各种色谱技术探索建立高纯度总黄酮的富集纯化方法。
