KDM5B在宫颈癌中的表达意义及对宫颈癌干细胞的影响
2020-12-23杨宝娟王志红王武亮
杨宝娟 张 庆 王志红 王武亮 张 珂
(郑州大学第二附属医院妇产科,郑州 450000)
宫颈癌发病率居全球女性恶性肿瘤第二位,死亡率位居女性生殖系统相关死亡的第一位[1]。流行病学调查全球每年有50万例左右宫颈癌新发病例和28万例左右宫颈癌相关死亡病例[2]。由于复发和转移使得宫颈癌患者预后较差,因此研究宫颈癌复发和转移的机制尤为重要[3]。肿瘤干细胞(cancer stem cells,CSCs)被认为具有自我更新能力,启动和驱动肿瘤细胞生长和转移,在肿瘤复发和转移中发挥关键作用[4,5]。但是CSCs是存在于肿瘤细胞中的一小部分群体,需要鉴定和分离,现有研究报道宫颈癌中可以鉴定分离出宫颈癌干细胞(cervical cancer stem cells,CCSCs)[6,7]。CCSCs具有增殖快、软琼脂克隆形成、转移能力强和致瘤性等生物学特性即为干性,CCSCs干性同样受到驱动基因、抑制基因和表观遗传学修饰相关基因等的调控[8-10]。组蛋白去甲基化转移酶(lysine demethylation 5B,KDM5B) 主要在正常睾丸组织中表达,近年来研究报道KDM5B 在肝癌、头颈部鳞状细胞癌及卵巢癌等常见的人类恶性肿瘤中表达上调,并在肿瘤增殖转移等恶性生物学行为中发挥重要作用[11-13]。KDM5B在宫颈癌中的表达水平及对CSCs的调控作用目前尚无文献报道,因此本文旨在研究KDM5B在宫颈癌组织中的表达水平和与患者临床病理特征的关系,及其在CSCs干性调控中发挥的作用,为发掘治疗宫颈癌新的分子基因靶点提供实验依据。
1 资料与方法
1.1资料
1.1.1组织样本 收集2011年1月~2013年1月入住我院的宫颈癌患者,获得手术切除宫颈癌组织70例,患者年龄25~75岁,平均年龄(45.04±21.36)岁,要求所有患者具有完整的病历资料和随访资料,并且未患有其他肿瘤或严重威胁生命健康的疾病,术前未接受放化疗、靶向治疗等任何形式的抗肿瘤治疗,由两位或两位以上的病理专家共同证实为宫颈癌,另选取30例因良性病变切除的正常宫颈组织,未合并其他肿瘤或威胁生命健康疾病的患者作为对照,患者年龄30~70岁,平均年龄(47.34±19.95)岁。宫颈癌组与对照组患者的年龄相比,差异无统计学意义。所有患者签署知情同意书,并由我院伦理委员会审核通过。
1.1.2试剂与仪器 SP试剂盒、非免疫羊血清、DAB显色试剂盒均购于上海碧云天有限公司;加拿大中性树胶购于Solarbio公司;宫颈癌Caski细胞系和人宫颈上皮永生化细胞H8均购自美国ATCC细胞库;DMEM-F12、DMEM高糖培养基及胎牛血清(FBS)均购自美国Gibco公司;KDM5B siRNA由上海吉凯有限公司设计合成;蛋白裂解液、BCA蛋白浓度检测试剂盒均购自美国Thermo公司;MTS购自美国Biovision公司;Transwell小室购自南京凯基生物技术有限公司;兔抗人KDM5B多克隆抗体(ab198884)、兔抗人OCT4多克隆抗体(ab181557)、鼠抗人Nanog多克隆抗体(ab109250)、兔抗人SOX2多克隆抗体(ab97959)和兔抗人GAPDH多克隆抗体(ab181602)均购自美国Abcam公司。
1.2方法
1.2.1免疫组织化学 采用SP免疫组织化学检测KDM5B蛋白的表达,组织样本在4%中性甲醛固定48 h以上,石蜡包埋,切成4 μm切片,70℃烘烤 2 h,二甲苯Ⅰ、Ⅱ各脱蜡15 min,70%、80%、90%、100%梯度酒精及双蒸水,水化,置于柠檬酸钠溶液中进行高温高压抗原修复,PBS冲洗2次后,室温3%过氧化氢甲醇溶液避光孵育30 min,以去除内源性过氧化物酶活性,滴加非免疫羊血清室温封闭1 h,滴加1∶100稀释的KDM5B一抗工作液,4℃孵育过夜,PBS冲洗3次后滴加二抗,37℃孵育30 min,PBS 洗涤3次后DAB试剂显色,苏木素染细胞核,常规梯度酒精脱水,干燥后加拿大中性树胶封片。
在低倍显微镜下计数100个细胞,随机计数5个视野。细胞内出现棕黄色颗粒为阳性细胞,按染色程度计分:无黄色计0分,浅棕黄色计1分,棕黄色计2分,深棕黄色计3分。根据阳性细胞所占比例计分,无阳性细胞计0分,<25%计1分;26%~50%计2分;51%~75%计3分;>75%计4分。按染色程度和阳性细胞所占比例评分综合判定,二者之和≤3分为阴性表达,>3分为阳性表达。术后电话及门诊随访1~60个月,患者死亡或者时间截止时随访终止[14]。
1.2.2细胞培养及转染 Caski、H8细胞用DMEM-F12培养基+10%FBS培养,置于37℃、5%CO2培养箱中。用无血清培养基将Caski细胞培养成肿瘤球,将对数生长期的肿瘤球制成单个细胞后重悬于FACS缓冲液中,实验组加入CD133 FITC 10 μl,对照组加入10 μl同型对照抗体,于4℃避光孵育30 min,每10 min混悬细胞1次,流式细胞仪上机分选出CD133+细胞CCSCs,扩大培养。流式细胞术检测扩大培养后CD133 阳性细胞率。将呈对数生长期的CCSCs细胞胰酶消化后铺至6孔板中,细胞完全贴壁后将脂质体2000与KDM5B siRNA和对照组转染试剂按说明书转染至细胞中,分为KDM5B siRNA(si-KDM5B)和对照组(si-NC),放至培养箱中培养。KDM5B siRNA序列:ATCGCTTGCTTCATCGATATT。
1.2.3MTS增殖实验 收集转染48 h后的各组细胞,胰酶消化计数后以每孔150 μl培养基、2 000个细胞接种于96孔板中,组内为6个复孔,铺板后放至培养箱中培养,分别在铺板后第0、1、2、3和4天时(即组间设5个平行复孔),每孔加入30 μl MTS工作液,培养箱中孵育2 h,全波长扫描仪在490 nm波长处测取吸光度OD值,OD值越高提示细胞的增殖能力越强。实验重复3次。
1.2.4软琼脂克隆形成实验 1.2%高压灭菌的软琼脂与无血清培养基1∶1混匀后,均匀铺至培养皿底部冷却至固态作为底层胶。0.6%高压灭菌的软琼脂与无血清培养基1∶1充分混匀37℃预热后,与100 μl 1×105个各组细胞混匀铺至底层胶上,放置培养箱中培养,每天显微镜下观察并拍照。实验重复3次以上。
1.2.5Transwell小室实验 收集转染48 h后的各组细胞,无血清培养基洗3次,以每孔1×105个细胞重悬至100 μl无血清培养基中,接种于Transwell小室的上室,500 μl完全培养基加入下室作为趋化因子,置培养箱中培养,显微镜下观察下室穿过10个细胞时终止培养,取出微孔膜,PBS洗涤3次,甲醇固定15 min,苏木素染色。随机计数显微镜下5个视野穿过的细胞,穿过细胞的数量越多,细胞的转移能力越强,取5个视野的均值代表细胞转移能力。实验重复3次以上。
1.2.6裸鼠移植瘤 按说明书将KDM5B干扰质粒及对照NC,以复感染指数MOI(病毒/细胞数量)20感染CCSCs,分为KDM5B sh-RNA组和NC组。96 h后添加含1.0 μg/ml G418(遗传霉素)的新鲜培养基培养,隔天添加1次,直至所有细胞均可观察到荧光。将筛选的稳转细胞株CCSCssh-KDM5B和CCSCsNC分别以每只1×107个/100 μl注射到4周龄左右的裸鼠右侧腋下,每组5只裸鼠。每3 d用游标卡尺测量瘤体积,4周左右处死裸鼠,该实验的所有操作均符合动物伦理学。
1.2.7Western blot检测蛋白表达 收集转染48 h后的各组细胞,加入蛋白裂解液(含有100×的蛋白酶和磷酸酶抑制剂)反复吹打,14 000 r/min、裂解30 min,4℃离心,20 min,上清液移至新的EP管中,BCA测蛋白浓度,煮沸变性后上样SDS-PAGE电泳,以湿转的方式将蛋白移至PVDF膜上,8%脱脂牛奶室温封闭3 h,TBST洗涤3次后加入目的基因一抗孵育4℃过夜,TBST洗涤3次后,二抗室温孵育2 h,ELC化学发光法曝光条带。实验重复3次以上。

2 结果
2.1KDM5B在宫颈癌组织中的表达及其与患者临床病理特征的关系 KDM5B在宫颈癌和正常宫颈组织中的表达阳性率分别为68.57%(48/70)、36.67%(11/30),宫颈癌组织中KDM5B阳性表达率显著高于正常宫颈组织(χ2=8.837,P=0.003)。KDM5B在宫颈癌组织中的表达水平与患者的年龄、TNM分期和组织学分级均无关,差异无统计学意义(P>0.05)。KDM5B与宫颈癌肿瘤大小、淋巴结转移显著相关 (均P<0.05)。见表1。

表1 KDM5B在宫颈癌组织中的表达水平与临床病理特征之间的关系[例(%)]Tab.1 Expression of KDM5B in cervical carcinoma and its relationship with clinicopathologic features[n(%)]
2.2宫颈癌组织中KDM5B的表达水平对患者预后的影响 对70例宫颈癌患者进行术后随访,并按KDM5B在宫颈癌癌组织中的表达水平分为KDM5B阳性表达组和KDM5B阴性表达组。Kaplan-Meier生存分析结果显示:KDM5B阳性表达组宫颈癌患者的5年总生存率明显短于KDM5B阴性表达组(Logrankχ2=23.081,P=0.000,图1)。

图1 宫颈癌组织中KDM5B的表达水平与患者术后生存时间的关系Fig.1 Relationship between expression of KDM58 in cer-vical carcinoma and postoperative survival time
2.3KDM5B在CCSCs中的表达水平 利用流式细胞术将Caski细胞分离培养的肿瘤球进行分选,筛选出CD133+细胞扩大培养后,流式细胞仪检测CD133+细胞为97.66%,Western blot检测KDM5B在CD133+细胞中的表达显著高于在宫颈癌细胞Caski和人宫颈上皮永生化细胞H8中的表达,H8细胞中的表达最低(图2)。

图2 KDM5B蛋白在CCSCs中的表达Fig.2 Expressions of KDM5B protein in CCSCsNote:Compared with CD133+,*.P<0.05.
2.4抑制KDM5B表达对CCSCs增殖的影响 MTS法测定si-KDM5B和NC组CCSCs的增殖能力,结果显示,与NC组相比,si-KDM5B组细胞增殖能力明显减慢(P<0.05,图3)。
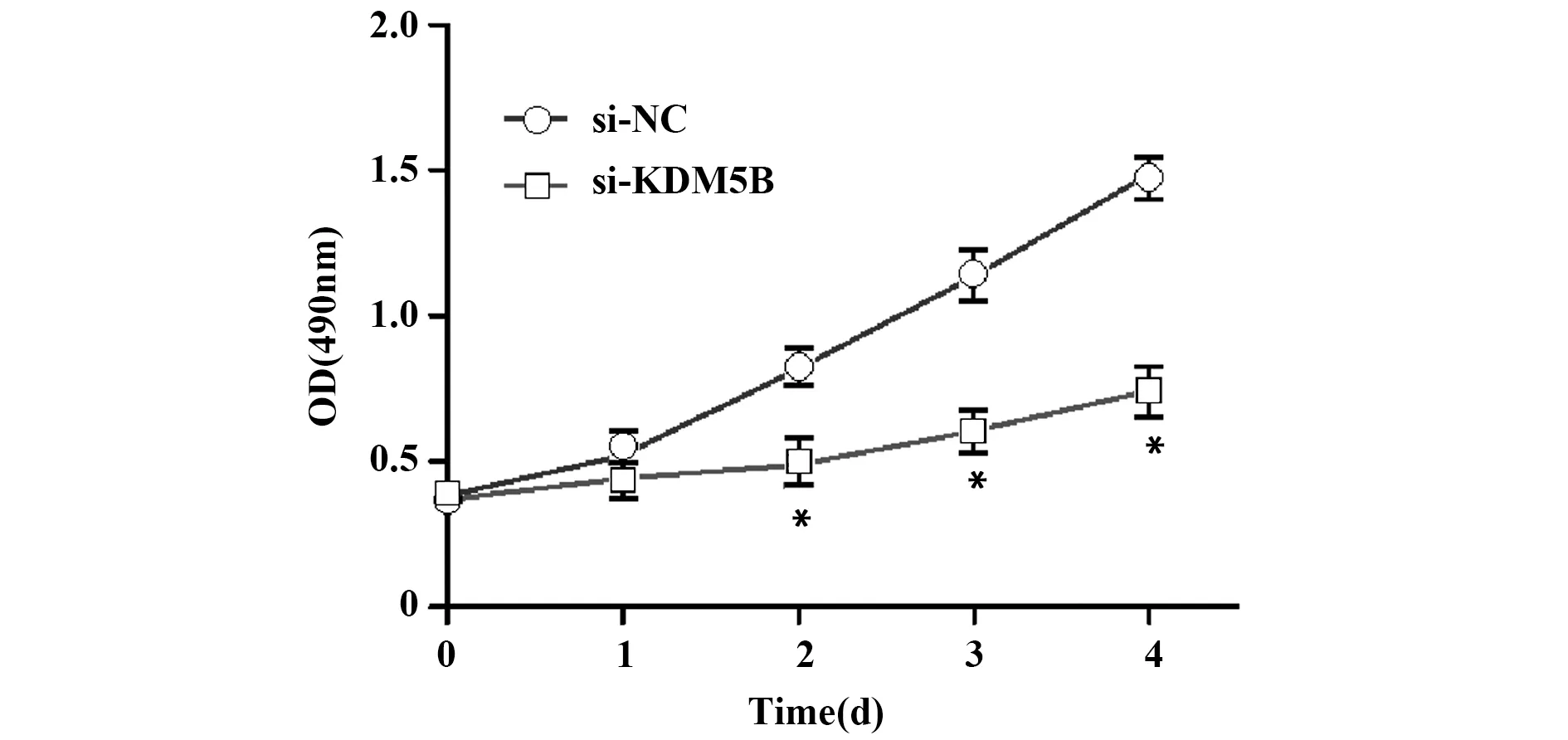
图3 MTS检测KDM5B对CCSCs增殖能力的影响Fig.3 MTS detected effect of KDM5B on proliferation ability of CCSCsNote:Compared with si-NC group,*.P<0.05.
2.5抑制KDM5B表达对CCSCs克隆形成能力的影响 采用软琼脂克隆实验测定si-KDM5B和NC组CCSCs的克隆形成能力,结果显示si-KDM5B组肿瘤克隆球形成明显小于NC组。si-KDM5B组肿瘤克隆球形成能力明显弱于NC组(图4)。

图4 软琼脂克隆形成实验检测KDM5B对CCSCs克隆形成能力的影响Fig.4 Soft agar clone formation assay detected effect of KDM5B on colony forming ability of CCSCs
2.6抑制KDM5B表达对CCSCs转移能力的影响 采用Transwell小室测定si-KDM5B和NC组CCSCs的转移能力,结果显示si-KDM5B和NC组细胞穿膜数分别为(48.43±8.14) 个、(96.32±10.28)个。si-KDM5B组细胞转移能力明显低于si-NC组(P<0.05,图5)。
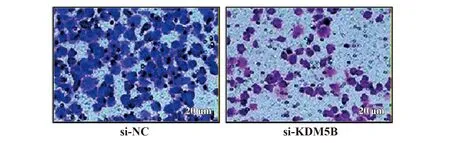
图5 Transwell检测KDM5B对CCSCs转移能力的影响Fig.5 Transwell detected effect of KDM5B on metastasis ability of CCSCs
2.7抑制KDM5B表达对CCSCs致瘤性的影响 分别注射CCSCssh-KDM5B和CCSCsNC后,CCSCssh-KDM5B组裸鼠体积显著低于CCSCsNC组(P<0.05,图6)。

图6 KDM5B对CCSCs致瘤能力的影响Fig.6 Effect of KDM5B on tumorigenicity of CCSCsNote:A.Nude mice were dissected for tumor size;B.Vernier caliper was used to measure the tumor volume of nude mice;compared with CCSCsNC group,*.P<0.05.
2.8抑制KDM5B表达对CCSCs干性基因的影响 Western blot结果显示,与NC组相比,si-KDM5B组OCT4、 Nanog和SOX2蛋白表达显著降低(图7)。

图7 Western blot检测KDM5B对CCSCs干性基因蛋白表达的影响Fig.7 Western blot analysis of effect of KDM5B on dry gene protein expression of CCSCsNote:Compared with Si-NC group,*.P<0.05.
3 讨论
宫颈癌是严重威胁全球女性健康的常见妇科肿瘤,发病率和死亡率较高[1,2]。宫颈癌患者早期症状的隐匿性,使得大多数患者确诊时已处于晚期,容易出现化疗药物抵抗及复发,是目前宫颈癌治疗面临的巨大挑战[15,16]。CSCs作为解释同一肿瘤内肿瘤细胞具有不同的表型和功能异质性的模型,对肿瘤的增殖和侵袭转移等恶性生物学行为均具有重要的促进作用,同时CSCs可以作为药物靶点,消除CSCs可以克服宫颈癌细胞的铂类化疗耐药。
CSCs虽然是肿瘤细胞中的一小部分细胞,但却是肿瘤细胞发生的起始,是促进肿瘤复发耐药的关键,具有促进肿瘤增殖、侵袭和转移等生物学行为的特性,即干性,而干性通常是由癌基因及抑癌基因等相关关键因子调控[8-10]。Huang等[17]研究发现分化抑制因子ID3可以通过增加β-连环蛋白的转录活性来促进肝内胆管细胞癌(ICC)干细胞的干性,并且可以作为预测ICC患者对辅助化学疗法反应的新型生物标志物。软骨寡聚基质蛋白(COMP)在乳腺癌细胞中阳性表达与患者的低存活率和较高的复发率相关,并在体内和体外实验中表明COMP表达增加了乳腺癌中癌症干细胞的比例,其通过增加Notch3和Jagged1之间的相互作用来调节癌症干细胞群[18]。T-box转录因子3(Tbx3)通过控制干细胞自我更新和分化来调节干细胞的维持从而促进宫颈癌的发生发展[18]。研究报道KDM5B在多种肿瘤中表达上调,并发挥重要作用,KDM5B也称为JARID1,2007年首次被鉴定为组蛋白去甲基化酶,通过参与调控靶基因启动子周围的多个抑制性转录复合物,发挥广泛调节染色质结构的作用[19]。KDM5B与其他三个家族成员KDM5A、KDM5C和KDM5D共同组成KDM5家族,KDM5家族包含五个保守结构域:催化JmjC结构域、N末端JmjN结构域、ARID结构域、PHD指结构域和C5CH2结构域,参与去甲基化酶活性[20]。越来越多的研究表明KDM5B具有致癌作用,KDM5B在乳腺癌组织中高表达,采用KDM5蛋白小分子抑制剂抑制KDM5B蛋白的表达导致乳腺癌细胞活力下降[21]。在胃癌中,KDM5B通过调节Akt通路来促进肿瘤细胞生长和转移[22]。肿瘤细胞可利用KDM5A获得顺铂等细胞毒性剂的化疗耐受性[23]。根据KDM5B促癌的生物学功能推测其可能与CSCs干性相关,研究发现JARID1B/KDM5B过表达导致非小细胞肺癌细胞增殖增加和肿瘤球形成,与CSCs和上皮-间质转化(EMT)标志物的表达呈正相关[24]。KDM5B在维持类似肝细胞癌CSCs的特征中起重要作用,敲减KDM5B的表达抑制了肿瘤细胞体外肿瘤球形成和侵袭[25]。Zhou等[26]报道KDM5B在宫颈癌细胞中升高主要逆转miR424-5p触发的细胞增殖抑制和细胞凋亡增加,沉默KDM5B表达同样抑制细胞生长,但是KDM5B与CCSCs的相关研究尚未见有报道。
为了研究KDM5B在CCSCs中发挥的作用,本研究采用免疫组化方法检测KDM5B在宫颈癌中的表达水平,结果显示KDM5B在宫颈癌组织中的表达显著高于正常宫颈组织,发现KDM5B蛋白阳性表达与宫颈癌肿瘤大小及淋巴结转移相关。采用Kaplan-Meier生存曲线发现KDM5B阳性表达与患者预后显著相关,KDM5B阳性表达患者5年总生存期较短。Huang等[12]同样采用免疫组化分析KDM5B在头颈部鳞状细胞癌(SCCHN)组织和癌旁上皮组织中的表达,结果发现SCCHN中KDM5B的表达高于相邻的非癌组织,并与淋巴结转移和肿瘤复发及预后密切相关。KDM5B在肝细胞癌组织中的表达增加与肿瘤体积大、TNM分期晚期和患者的总体存活率降低显著相关[11]。以上结果均提示KDM5B可能参与肿瘤的发生发展。
CSCs在肿瘤细胞中的含量较低,并且分离存在一定的困难,无血清悬浮培养法和流式细胞仪基于CSCs表面免疫学分子标志物分选法是目前分离CSCs的主要方法,CD133已被证实为CCSCs表面免疫学分子标志物之一[27-29],本文结合两种方法筛选出97.66%的CD133+细胞为CCSCs。而Western blot检测发现KDM5B在CCSCs中的表达显著高于在宫颈癌细胞Caski和人宫颈上皮永生化细胞H8中的表达,H8细胞中的表达最低,与其在宫颈癌组织水平表达具有一致性,采用小干扰RNA技术干扰目的基因KDM5B的表达研究其对CCSCs的影响,MTS增殖实验、软琼脂克隆形成实验、Transwell实验和裸鼠成瘤实验结果显示抑制CCSCs细胞中KDM5B基因的表达后细胞增殖、克隆形成能力、转移能力和致瘤能力均下降,即抑制CCSCs的干性。功能实验结果表明KDM5B基因可能为CCSCs干性的促进因子。八聚体结合转录因子4(octamer-binding transcription factor,OCT4)是维持正常干细胞和CSCs特征的主要转录因子,可以调控其他Nanog、SOX2等干性因子,OCT4、 Nanog、SOX2均为CSCs干性标志物,对CCSCs的干性均具有主要作用,因此采用Western blot检测KDM5B对OCT4、 Nanog和SOX2干性基因蛋白的表达影响,结果显示抑制KDM5B的表达后,CCSCs中蛋白的表达下降,表明KDM5B可能促进CCSCs的干性[30-32]。
综上所述,KDM5B在宫颈癌组织和CCSCs中高表达,与宫颈癌患者的肿瘤大小和淋巴结转移相关,干扰KDM5B的表达显著抑制CCSCs的干性,KDM5B在宫颈癌的治疗中具有潜在作用,可以为干预宫颈癌恶性生物学行为提供新的思路。
