沉默长链非编码RNA DGCR5对肺腺癌细胞增殖、侵袭、迁移及Wnt/β-catenin信号通路的影响
2020-12-23郭水根舒慧珍
郭水根 舒慧珍
(复旦大学附属浦东医院呼吸内科,上海 201399)
肺腺癌是常见的恶性肿瘤之一,其发病率和死亡率有升高趋势,研究肺腺癌的发病机制对其诊断和治疗具有重要价值[1]。肺腺癌的发生发展是多基因、多阶段、多因素共同作用的结果。长链非编码RNA(long non-coding RNA,lncRNA)是长度大于200 nt的RNA,不编码蛋白质,可在不同水平对染色质修饰、转录和转录后水平的基因表达发挥调控作用。研究发现多种lncRNA在肺腺癌的发生发展中发挥重要作用[2]。近年研究发现,lncRNA DGCR5在恶性肿瘤的发生发展中具有重要作用,在肝细胞癌、胰腺导管癌等恶性肿瘤中表达降低[3,4];在肺腺癌中,DGCR5表达升高,对肺腺癌的诊断和预后评价具有重要价值,但其对肺腺癌增殖、侵袭及迁移的作用机制尚不明确[5]。恶性肿瘤细胞的上皮间质转化(epithelial-mesenchymal transition,EMT)在细胞侵袭和迁移中具有重要作用,可增加恶性肿瘤细胞的侵袭及迁移能力[6]。Wnt/β-连环蛋白(β-catenin) 信号通路在EMT中发挥重要调控作用[7]。因此本文通过沉默DGCR5观察其对肺腺癌细胞增殖、侵袭、迁移及Wnt/β-catenin信号通路的影响,探讨DGCR5在肺腺癌中的可能作用机制,现报道如下。
1 材料与方法
1.1材料
1.1.1细胞株 人肺腺癌H1650和A549细胞株购自中国科学院上海生命科学研究院细胞库。
1.1.2主要试剂 siRNA-DGCR5和阴性对照siRN A购自上海吉玛公司;qRT-PCR试剂盒、Lipofec-tamineTM转染试剂盒、DMEM培养基、TRIzol试剂、CCK8试剂盒等购自美国Promega公司;Transwell小室购自美国Corning公司;兔抗人E-cadherin多克隆抗体、兔抗人Vimentin多克隆抗体、兔抗人β-catenin多克隆抗体、兔抗人p-gsk-3β多克隆抗体购自美国Sigma公司。
1.2方法
1.2.1细胞分组与转染 将生长良好的H1650和A549细胞株接种于6孔板(5×105个/孔),根据随机数字法分为空白对照组(Blank)、阴性对照组(NC)和siRNA-DGCR5组(si-DGCR5),待细胞生长至70%以上融合时进行转染。各组细胞更换无血清培养基,使用脂质体2000、按照说明书进行转染,si-DGCR5组细胞转染siRNA-DGCR5,NC组细胞转染siRNA-NC,Blank组不转染。转染6 h后更换培养液,选择转染24 h的细胞备用。
1.2.2qRT-PCR测量各组H1650和A549细胞中DGCR5水平 取转染24 h的各组H1650和A549细胞,TRIzol提取总RNA,取RNA样品1 μl,测定纯度和浓度。将得到的RNA逆转录为cDNA,qRT-PCR测量各组H1650和A549细胞中DGCR5水平,PCR反应条件:95℃ 10 min;95℃ 10 s,60℃ 60 s,共42个循环。以GAPDH为内参照。H1650和A549细胞中DGCR5水平以2-ΔΔCt计算。
1.2.3CCK8测定各组H1650和A549细胞增殖 收集贴壁生长的H1650和A549细胞,调整细胞浓度为5×104个/ml,加入96孔板培养24 h,各组细胞进行相应转染,转染方法参照1.2.1,每组设7个复孔,分别在24、48、72 h向各孔中加入CCK8溶液10 μl,孵育2 h,用酶标仪测定各组波长450 nm处OD值。
1.2.4Transwell测定各组H1650和A549细胞侵袭能力 将Matrigel基质胶融化成液态,在Trans-well小室上室加入基质胶孵育30 min,将转染后 24 h 的H1650和A549细胞浓度调整为5×105个/ml,上室加入200 μl细胞悬液,下室加入培养液,每组设7个复孔,培养24 h后取出小室,棉签擦去未穿透细胞,加入多聚甲醛固定20 min,加入结晶紫染色20 min,显微镜下拍照观察每个高倍视野侵袭细胞数。
1.2.5划痕实验测定各组H1650和A549细胞迁移能力 取转染24 h各组H1650和A549细胞接种于6孔板,3×105个/孔,待细胞贴壁生长后更换培养基,用10 μl枪头垂直划4条平行线,每组设7个复孔,培养24 h,分别在0 h和24 h拍照,观察各组细胞迁移情况,测量各组细胞迁移距离。
1.2.6Western blot测定各组H1650和A549细胞中E-cadherin、Vimentin、β-catenin、p-gsk-3β蛋白水平 取各组转染24 h的H1650和A549细胞,加入细胞裂解液裂解细胞后,以12 000 r/min离心15 min,取上清液以相同条件再次离心15 min,BCA法测定上清液中蛋白浓度。制备电泳凝胶,经电泳、转膜、封闭,加入一抗:兔抗人E-cadherin多克隆抗体(1∶300)、兔抗人Vimentin多克隆抗体(1∶300)、兔抗人β-catenin多克隆抗体(1∶300)、兔抗人p-gsk-3β多克隆抗体(1∶300)过夜孵育,以β-actin为内参,加入二抗(1∶3 000)孵育2 h,加入ECL发光液,于暗室曝光、显影液中显影、定影液中定影,采用Quantity One软件分析条带亮度,H1650和A549细胞中E-cadherin、Vimentin、β-catenin、p-gsk-3β蛋白水平以其蛋白条带灰度值/β-actin条带灰度值表示。

2 结果
2.1沉默DGCR5对H1650和A549细胞中DGCR5水平的影响 H1650和A549细胞中,与Blank组和NC组相比,si-DGCR5组DGCR5水平降低(P<0.05);Blank组和NC组DGCR5水平差异无统计学意义(P>0.05),见表1。

表1 各组H1650和A549细胞中DGCR5水平比较Tab.1 Comparison of DGCR5 levels in H1650 and A549 cells of each
2.2沉默DGCR5对H1650和A549细胞增殖的影响 H1650和A549细胞中,与Blank组和NC组相比,si-DGCR5组OD值降低(P<0.05);Blank组和NC组OD值差异无统计学意义(P>0.05),见表2、3。

表2 各组H1650细胞OD值比较Tab.2 Comparison of OD values of H1650 cells in each
2.3沉默DGCR5对H1650和A549细胞侵袭能力的影响 H1650和A549细胞中,与Blank组和NC组相比,si-DGCR5组穿膜细胞数降低(P<0.05);Blank组和NC组穿膜细胞数差异无统计学意义(P>0.05),见表4、图1。
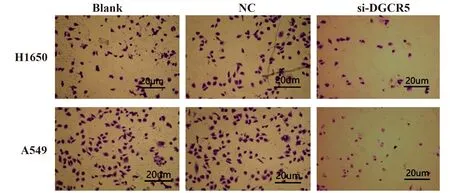
图1 Transwell检测各组H1650和A549细胞侵袭能力(×400)Fig.1 Transwell to detect invasiveness of H1650 and A549 cells in each group (×400)

表4 各组H1650和A549细胞中穿膜细胞数比较Tab.4 Comparison of number of transmembrane cells of H1650 and A549 cells in each
2.4沉默DGCR5对H1650和A549细胞迁移能力的影响 H1650和A549细胞中,与Blank组和NC组相比,si-DGCR5组迁移距离缩短(P<0.05);Blank组和NC组迁移距离差异无统计学意义(P>0.05),见表5、图2。

图2 划痕实验测定各组H1650和A549细胞迁移能力 (×100)Fig.2 Scratch test to determine migration ability of H1650 and A549 cells in each group (×100)Note:A.H1650;B.A549.

表5 各组H1650和A549细胞迁移距离比较Tab.5 Comparison of migration distance of H1650 and A549 cells in each
2.5沉默DGCR5对H1650和A549细胞E-cadhe-rin、Vimentin蛋白水平的影响 H1650和A549细胞中,与Blank组和NC组相比,si-DGCR5组E-cadherin蛋白水平升高(P<0.05),Vimentin蛋白水平降低(P<0.05);Blank组和NC组E-cadherin、Vimentin蛋白水平差异无统计学意义(P>0.05),见图3。
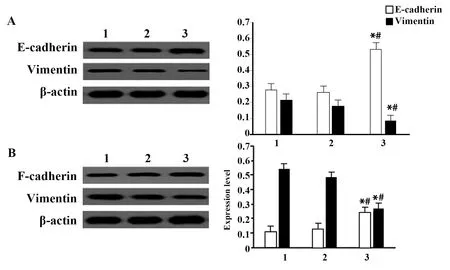
图3 各组H1650和A549细胞E-cadherin、Vimentin蛋白表达Fig.3 Expressions of E-cadherin and Vimentin proteins of H1650 and A549 cells in each groupNote:A.H1650;B.A549.1.Blank group;2.NC group;3.si-DGCR5 group.Compared with Blank group, *.P<0.05;compared with NC group,#.P<0.05.
2.6沉默DGCR5对H1650和A549细胞β-cate-nin、p-gsk-3β蛋白水平的影响 H1650和A549细胞中,与Blank组和NC组相比,si-DGCR5组β-catenin蛋白水平降低(P<0.05),p-gsk-3β蛋白水平升高(P<0.05);Blank组和NC组β-catenin、p-gsk-3β蛋白水平差异无统计学意义(P>0.05),见图4。

表3 各组A549细胞OD值比较Tab.3 Comparison of OD values of A549 cells in each
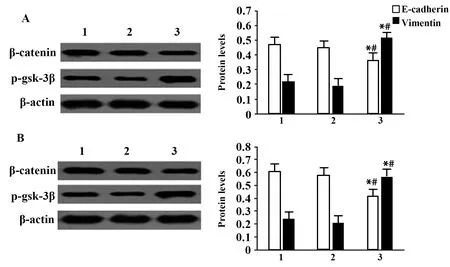
图4 各组H1650和A549细胞β-catenin、p-gsk-3β蛋白表达Fig.4 Expressions of β-catenin and p-gsk-3β proteins of H1650 and A549 cells in each groupNote:A.H1650;B.A549.1.Blank group;2.NC group;3.si-DGCR5 group.Compared with Blank group, *.P<0.05;compared with NC group,#.P<0.05.
3 讨论
肺癌在全球范围内发病率和死亡率居高不下,其中非小细胞肺癌(non-small cell lung cancer,NSCLC)约占肺癌的80%,且其5年生存率较低。NSCLC死亡的主要原因为早期临床症状不明显,临床确诊时通常已进入晚期阶段,癌细胞已发生侵袭和转移。肺腺癌为NSCLC的一种,治疗方法包括手术治疗、放疗、化疗、靶向治疗等,但上述治疗方法对于发生侵袭和转移的肺腺癌患者效果欠佳,预后较差[8]。因此探讨肺腺癌的发病机制,尽早抑制肺腺癌的增殖、侵袭和转移具有重要意义。
lncRNA是一类由于缺乏开放式阅读框而导致缺乏蛋白编码能力的RNA,可通过对基因的表达和翻译参与调控恶性肿瘤的生物学功能,在恶性肿瘤的发生发展、侵袭迁移及放化疗抵抗等过程中发挥重要作用[9]。研究已发现多种lncRNA在肺腺癌的发生发展中具有重要作用[10]。DGCR5作为一种lncRNA在多种恶性肿瘤中异常表达[11]。DGCR5在乳头状甲状腺癌、膀胱癌、肝癌等恶性肿瘤中表达降低,上调DGCR5可抑制上述恶性肿瘤的进展[12-14]。DGCR5在肺癌中也存在异常表达,Chen等[15]和Luo等[16]研究发现DGCR5在肺癌组织中表达降低,在肺癌的发生发展中可能发挥抑癌作用;Dong等[17]和李楠等[18]研究发现肺腺癌组织中DGCR5呈高表达,对肺腺癌的诊断和预后评价具有重要意义,在肺腺癌的发生发展中可能发挥促癌作用。本文通过沉默DGCR5观察其对肺腺癌细胞增殖、侵袭和迁移的影响,发现沉默DGCR5可抑制肺腺癌细胞的增殖、侵袭和迁移,本研究结果表明DGCR5在肺腺癌的发生发展中可能发挥促癌作用,抑制肺腺癌细胞中DGCR5表达可抑制肺腺癌细胞的增殖、侵袭和迁移,DGCR5有望成为肺腺癌的潜在治疗靶点。本研究结果与Dong等[17]和李楠等[18]研究结果一致,与Chen等[15]和Luo等[16]研究结果不一致,考虑其原因可能为本研究及Dong等和李楠等的研究对象为肺腺癌,而Chen等和Luo等的研究对象为肺癌,提示DGCR5在不同的肺癌类型中所发挥的作用可能不完全相同。
研究表明DGCR5参与肺癌的发生发展,但其在肺癌发生发展中的机制尚不明确。远处转移和浸润性是癌细胞的重要生物学特性,多数肺腺癌患者并非死于肺腺癌本身,而是随之出现的转移。EMT在肺腺癌的侵袭和迁移中发挥重要作用,EMT是上皮细胞通过特定程序转化成具有间质表型细胞的一种生物学过程,E-cadherin表达下降和Vimentin表达升高为EMT的主要特征。EMT后上皮细胞失去原细胞极性和基底膜连接等上皮细胞表型,获得高迁移和侵袭能力[19,20]。因此EMT是上皮来源细胞迁移和侵袭能力增强的重要原因。本研究发现沉默DGCR5可升高E-cadherin蛋白水平,降低Vimentin蛋白水平。提示下调DGCR5可能通过抑制肺腺癌细胞EMT发挥抑制肺腺癌侵袭迁移能力。
Wnt/β-catenin信号通路是经典的Wnt通路,和胚胎发育及细胞的生长、分化、凋亡等关系密切,还与EMT相关,Wnt/β-catenin信号通路可降低E-cadherin表达,使上皮细胞连接和极性缺失,导致细胞发生EMT,从而促进细胞的迁移和侵袭[21]。当Wnt信号通路被激活后,信号传导至p-gsk-3β,使降解复合物失活,导致细胞中β-catenin不能被降解,从而使β-catenin水平升高,p-gsk-3β水平降低[22]。DGCR5在恶性肿瘤中可通过信号通路发挥作用,如Liu等[23]研究发现DGCR5可通过激活Wnt信号传导影响宫颈癌的增殖、迁移和侵袭;Wang等[24]研究发现DGCR5可通过Wnt信号传导途径影响肝细胞癌进展。因此推测DGCR5可能通过Wnt/β-catenin信号通路影响肺腺癌的增殖、侵袭和迁移,故本文对其进行研究,发现下调DGCR5后,H1650和A549细胞中β-catenin蛋白水平降低,p-gsk-3β蛋白水平升高。表明DGCR5可能通过Wnt/β-catenin信号通路参与肺腺癌的发生发展。
综上所述,下调DGCR5可能通过抑制Wnt/β-catenin信号通路及肺腺癌细胞EMT抑制肺腺癌的增殖、侵袭和迁移。DGCR5有望成为肺腺癌新的治疗靶点。
