基于碳纳米材料的神经电极技术
2020-12-23刘杨段小洁
刘杨 ,段小洁 ,2,*
1北京大学工学院生物医学工程系,北京 100871
2北京大学前沿交叉学科研究院,北京 100871
1 引言
神经电极为神经系统与外部设备之间进行有效的信息传递提供了接口,这种电子器件不仅可用于基础神经科学的研究,如探索认知过程的基本机制1,2和感觉信息处理的神经基础3,也为神经系统很多疾病的治疗提供了解决方案。例如,神经电极对脑活动的记录可以识别与癫痫活动相关的神经放电模式4,从而用于癫痫病灶的定位5。在神经调控方面,人工耳蜗帮助失聪患者恢复听力6,深部脑刺激可用于减轻帕金森症状7以及脊髓刺激器有助于缓解神经性疼痛8。
理想的神经记录和刺激电极应当具有良好的生物相容性,同时具有低阻抗和高电荷注入容量9,以进行高质量、低损伤且长期稳定的神经记录和调控。柔软的神经组织通常表现出各向异性的粘弹性特征,能够承受由于血流、呼吸和自然身体运动而引起的应变和位移,其力学顺从性可由杨氏模量定量化描述。其中,中枢神经系统(脑和脊髓)组织的杨氏模量在100 Pa到10 kPa之间10,11。传统由金属和半导体等硬质材料构成的神经电极具有与神经组织的力学不匹配性11-13,会导致电极周围组织的炎症反应和胶质增生,形成胶质瘢痕,这些活化的生物组织又会造成电极结构退化、材料腐蚀、绝缘层失效及电极阻抗波动,降低了神经信号记录的能力和长期稳定性14。另一方面,电极阻抗与电极的表面积有关15,增大电极的电化学有效表面积(electrochemical surface area,ESA)16可降低阻抗,产生较低幅值的热噪声。通常情况下,单神经元动作电位记录使用的电极几何表面积(geometric surface area,GSA)不应超过2000 μm2,并且通常小得多16,小尺寸的金属电极可能具有较大的电化学阻抗,从而带来低信噪比17。为解决这一问题,需要选择多孔性的电极材料或进行电极的表面修饰,以获得具有较大有效表面积但几何尺寸较小的神经电极15,16,18。
柔性生物电子器件的发展为提高神经界面的生物相容性和长期稳定性提供了新策略10,19。电极的尺寸、形状和电极材料的拉伸模量决定了电极在生物组织中的顺从性11,12,20。例如几何尺寸的减小和柔性材料的使用可降低电极的抗弯刚度,减少神经电极和神经组织之间的结构和力学差异,因此,许多研究致力于通过优化器件的几何结构21或使用柔性材料22来实现对神经活动的稳定监测和调控。
多模态神经界面将外部设备与神经元之间的多种交互模式集成到一起,使得外部设备与神经环路的双向通信具有更高的时空精度19。多模态兼容的神经电极对相互无干扰的多模态神经界面的集成起关键作用。光遗传调控结合多通道神经电生理记录和光学成像是研究神经环路连接和功能的有利工具,可同时实现神经活动探测的高空间分辨率和时间分辨率14,23。然而对于金属电极阵列来说,其不透明性阻碍了对金属位点下方神经组织的光学成像和光遗传刺激24;同时,在光照下,由于金属电极-电解质溶液界面的Becquerel效应,记录得到的信号中会产生光伪迹,这会污染真实的神经信号,尤其是无法从伪迹中提取出低频的局部场电位(Local Field Potential,LFP)信号25,26,因此寻找具有透光性且具有较小或无光伪迹的电极材料,对于发展多模态神经电极技术极其重要。
磁共振成像(Magnetic Resonance Imaging,MRI)兼容的神经电极允许对电极周围脑组织的MRI可视化及电极位置的确定,同时可实现高分辨的电生理测量和大脑活动的MRI图谱的结合。一些由贵金属、不锈钢或钨丝等材料构成的植入式神经刺激或记录电极,虽然具有良好的稳定性和界面电化学特性,然而,即使是非铁磁性的材料,也会由于其和水/组织之间的磁化率不匹配而导致严重的场畸变,在MRI中造成电极周围较大的图像伪影或盲区,使得无法看到周围的脑组织,导致这些金属电极与MRI不兼容27。因此,发展具有高生物相容性且MRI兼容的神经电极至关重要,这对于基础神经科学研究以及临床评估和监测具有重要意义。
纳米技术在神经科学中的应用引起了人们极大的兴趣。迄今为止,由硅和贵金属构成的植入式电极,虽然具有良好的化学稳定性,但这些非柔性材料可能导致胶质瘢痕的出现,降低信噪比,阻碍其神经记录的长期应用12。碳纳米材料,主要包括石墨烯和碳纳米管,由于其独特的物理和化学性质,在众多材料中脱颖而出,成为构筑神经电极或修饰神经界面的重要材料。石墨烯有多种制备方法,包括液相剥离法、微机械剥离法、氧化剥离法(通常得到还原氧化石墨烯)、化学气相沉积法(chemical vapor deposition,CVD)和SiC外延生长法28。其中化学气相沉积法可生长大面积单层石墨烯薄膜,薄膜具有柔性和高透光性,可减少晶体缺陷并实现高载流子迁移率,极大地易化了石墨烯在光电器件方面的应用,奠定了石墨烯用于制备透明神经电极阵列的基础。通过剥离法可得到石墨烯片,利用石墨烯片悬浮液可制成石墨烯纤维结构电极,石墨烯纤维具有的较高孔隙度和粗糙度,有利于实现电极的低阻抗和高电荷注入能力。碳纳米管方面,可以通过CVD法生长垂直排列的碳纳米管阵列,再通过牵拉和纺丝过程得到具有高导电率和抗拉强度的碳纳米管纤维29,30,从而用于制备大脑深度电极。
到目前为止,人们已经发展了基于碳纳米材料的多种神经电极及其阵列。柔性透明神经电极实现了电生理记录、光学成像和光遗传调控的多功能集成14,23,26。基于碳纳米材料的MRI兼容神经电极对植入电极的定位、癫痫病灶的确定以及深部脑刺激(Deep Brain Stimulation,DBS)-功能磁共振成像(functional Magnetic Resonance Imaging,fMRI)联用下对大脑神经环路激活模式的研究有着重要意义31-33。此外,碳纳米材料电极还可以进行稳定且高选择性的体内神经化学物质的电化学监测。如在大脑损伤后,常发生扩散性去极化现象,破坏了神经化学物质(如N+、Ca2+、K+和谷氨酸盐)的稳态,产生兴奋毒性蔓延,利用碳纳米管包覆的碳纤维电极可监测到与这一现象的发生密切相关的抗坏血酸的释放34。
本文将主要综述近年来基于石墨烯和碳纳米管的神经电极技术的发展及应用,并对未来纳米碳基神经电极的发展方向进行展望。
2 基于碳纳米材料的柔性电极
2.1 柔性石墨烯电极
石墨烯由碳原子按六边形蜂窝状排列而成,具有良好的电学35、力学36和化学性质37,同时石墨烯的柔性使其与周围组织具有较高的力学匹配性,这种匹配性可以极大地减小对神经组织的损伤,可被用来替代传统导电材料硅和金属,用于发展新型神经界面。
多孔性石墨烯电极具有较大的比表面积、低阻抗和高电荷注入能力,有利于实现高质量的皮层记录和刺激9,16,32。Lu等9直接在聚酰亚胺基底上,采用激光热解聚酰亚胺制备了图案化的三维多孔石墨烯泡沫,并以Cr/Au作为金属引线和接触垫,负型光刻胶SU-8作为封装层,得到了具有多孔性和高表面粗糙度的柔性石墨烯神经电极阵列(如图1a所示),其阻抗值比相同尺寸的金电极大约低两个数量级;使用硝酸处理可得到化学掺杂的石墨烯,进一步降低了阻抗值,同时电荷注入极限(Charge Injection Limit,CIL)由2 mC·cm-2提高到3.1 mC·cm-2。之后,将电极置于大鼠感觉皮层表面,可记录到感觉诱发电位;并利用电极刺激运动皮层,可引起踝关节和膝关节的屈曲。Apollo等12通过湿法纺丝制备氧化石墨烯纤维,并在220 °C下退火处理,得到液晶氧化石墨烯(Liquid Crystal Graphene Oxide,LCGO)纤维,以派瑞林C(Parylene-C)作为绝缘层,并用激光将纤维末端烧蚀成刷子样,以增加表面粗糙度和纳米孔隙度,得到了具有高电荷注入能力的神经电极(如图所1b示)。研究人员用此电极对剥离的大鼠视网膜内的神经节细胞进行体外刺激,同时进行全细胞膜片钳记录。之后,在电极表面涂覆水溶性蔗糖形成微针,辅助柔性电极植入猫视觉皮层,蔗糖随后溶解,并记录到神经活动(如图1c所示)。

图1 柔性石墨烯电极Fig.1 Soft graphene electrodes.
石墨烯还可与其他材料结合制备神经电极,从而集成多种材料的优势。Ryu等38制备了以聚(3,4-乙烯二氧噻吩)(poly(3,4-ethylenedioxythiophene,PEDOT)-Au-ZnO纳米线复合材料作为记录位点,Au-石墨烯作为引线的神经探针(如图1d所示)。其中,ZnO纳米线和导电聚合物PEDOT涂层的结合提高了电极的有效表面积和电荷储存能力,降低了阻抗。为比较Au和Au-石墨烯作为电极引线的性能差异,将电极引线部分反复折叠30次,发现仅有Au引线的电极阻抗明显升高,而Au-石墨烯电极引线在反复折叠100次后阻抗变化不大,证明石墨烯的加入可以增加电极的抗弯折性,Au-石墨烯的结合保证了电极的柔性和导电性。同时,此电极可在胡须刺激下记录到LFP信号。
石墨烯不仅可以用于构筑基于平面阵列结构和微丝结构的电极,由于石墨烯的高载流子迁移率39-41和界面电容39,还可以作为沟道材料用于制造基于高跨导场效应晶体管(field-effect transistors,FET)的柔性器件,以实现对电信号的高灵敏度检测39。Blaschke等42在柔性聚酰亚胺基底上沉积金作为源极和漏极,之后将CVD法生长的石墨烯薄膜转移至其上作为沟道,并以SU-8作为封装层,制备了高密度集成的基于溶液栅石墨烯场效应晶体管的柔性器件(如图1e所示)。器件在反复弯曲下,跨导没有明显变化。在此器件上培养HL-1心肌细胞,细胞的电活动会引起晶体管栅压的改变,实现了高信噪比的细胞动作电位记录。之后,研究人员应用溶液栅石墨烯场效应晶体管柔性器件进行荷包牡丹碱诱导的癫痫发作间期的信号记录,并将器件放置于大鼠初级视觉(primary visual,V1)皮层,记录到了自发电活动和视觉诱发电位。
2.2 柔性碳纳米管电极
小尺寸的神经电极有利于提高神经信号记录和刺激的空间分辨率,然而,对于传统金属电极来说,随着电极尺寸减小,其阻抗会上升,继而影响信号的记录。碳纳米管具有高比表面积43,44、良好的导电和力学性能,可以被用来构筑或修饰柔性电极,以提高电极尖端的电化学表面积,并降低电极阻抗15。
资本市场中CPA审计寻租活动并不产生新的社会经济利益,只是重新划分与转移既得的社会经济利益,使得其从一个主体流向其他主体。在这个过程中,不仅耗费社会经济资源,而且扭曲了正常的资源配置和收入分配格局。具体表现为:
柔性碳纳米管纤维可通过碳纳米管溶液、气凝胶和碳纳米管阵列纺制而成45,且纤维直径可控46。Durand及其合作者30,47研究了柔性碳纳米管纤维电极用于外周神经的记录。他们将垂直排列的多壁碳纳米管阵列进行高速纺丝得到了碳纳米管纤维电极(直径10-20 μm),用于大鼠舌咽神经和迷走神经的电学记录。电极由3.5 μm厚的Parylene-C作为绝缘层,将电极一端缠绕在钨丝上进行辅助植入,之后移出钨丝,电极对周围神经组织具有力学顺从性,因而降低了神经损伤和炎症反应。利用此电极可进行长期神经记录,在10周的时间段内,其阻抗在1 kHz下保持在18 ± 8 kΩ,同时信噪比超过10 dB。此外,研究者将碳纳米管纤维电极植入大鼠胫神经,刺激不同脚趾,可记录到不同幅值的复合神经动作电位,此电极的刺激具有对神经纤维的空间选择性。
当减小神经植入物在两个维度上(厚度和宽度)的尺寸时,可提高其力学顺从性并减少巨噬细胞的附着11,48。Zhang等11利用层层(layer-by-layer,LBL)自组装法制备了柔性多层碳纳米管:聚苯乙烯磺酸钠(poly(sodium4-styrenesulfonate),PSS)/聚乙烯醇(poly(vinyl alcohol),PVA)复合物电极,其中电极位点大小为100 μm2(如图2a所示),电极厚度约3 μm。研究人员将电极植入大鼠运动皮层,进行低频信号记录,并通过MRI和光声成像(Photoacoustic Microscopy,PAM),观测电极在脑组织中的植入位置。
Vitale等49利用湿法纺丝制备的碳纳米管纤维电极进行DBS和长期神经记录。碳纳米管纤维电极与溶液界面通过形成双电层控制着电化学过程,电极具有比相同直径铂铱(PtIr)丝更小的阻抗、更高的阴极电荷储存容量(Cathodal Charge Storage Capacity,CSC,372 ± 56 mC·cm-2)和CIL (6.52 mC·cm-2)。电极植入大鼠6周后,PtIr电极周围产生严重的瘢痕组织,而碳纳米管纤维电极炎症反应较PtIr电极显著降低。在DBS实验中,将碳纳米管纤维双极电极(如图2b所示)植入帕金森大鼠模型的脚内核(Entopenducular,EP),之后对大鼠腹腔注射甲基苯丙胺溶液引发旋转行为,通过转圈旋转实验来评估碳纳米管纤维电极用于DBS治疗的效果。在高频刺激(160和175 Hz)下,大鼠旋转速率降低,运动症状减轻(如图2c所示),证明碳纳米管纤维可用于动物模型的DBS治疗。同时,将直径12.6 μm的单根碳纳米管纤维与三根直径12 μm的NiCr丝组装在一起形成四通道电极阵列(tetrodes),其中NiCr的活性位点进行镀金处理,将电极植入大鼠初级运动皮层,此碳纳米管电极可记录到单神经元动作电位(如图2d)和LFP,并进行至少三周的神经记录。

图2 柔性碳纳米管电极Fig.2 Soft carbon nanotubes (CNTs)electrodes.

图3 柔性碳纳米管纤维电极进行长期神经记录33Fig.3 Chronic neural recording with soft CNT fiber electrodes 33.
Lu等33利用直径为15和5 μm的碳纳米管纤维制备了植入式神经电极(如图3a所示),因为电极的抗弯强度正比于尺寸的3次方,而且碳纳米管纤维具有比很多金属低的杨氏模量,该电极的抗弯强度低至1.58 × 102nN·m-1(碳纳米管纤维直径为5 μm)。此电极具有比PtIr电极更优异的电化学界面性质,其电化学过程由电极-电解质所形成的双电层控制,电极具有更大的电荷储存容量和电荷注入极限。研究人员采用梭子辅助植入的方法,可将电极精确定位到目标脑区;同时,采用CNT纤维直径为15 μm的电极实现了对单个神经元4-5个月的长期稳定记录(如图3b所示)。在电极的长期植入过程中,与刚性PtIr电极相比,碳纳米管纤维电极极大地降低了炎症反应。此柔性电极在植入后通过移动可微调记录位点位置,从而可以选择具有特定响应性的神经元,这将有利于神经记录和刺激。实验过程中,随着电极植入深度的变化(从-2160到-6838 μm),可以记录到不同脑区的具有高信噪比的神经元动作电位。
柔性电极虽然与神经组织有较好的力学匹配性,但也为其植入过程带来了挑战。目前用于柔性电极植入的方法主要有在电极表面涂覆可溶解的高聚物50,如明胶51、丝素蛋白52和蔗糖12等,以在电极表面形成刚性涂层;或者将电极附着于微针53或梭子11,33,49,54,55上辅助电极植入,待电极植入后将梭子移出。这两种方法均是通过暂时增强电极刚度从而将柔性电极植入生物组织。Vitale等56提出一种用双层聚二甲基硅氧烷(polydimethylsiloxane,PDMS)微流控装置辅助碳纳米管纤维(carbon nanotube fiber,CNTf)电极植入生物组织的方法(如图4所示)。此方法未改变电极的刚度或尺寸,在整个植入过程中,仅柔性电极进入了脑组织中,极大减小了急性损伤。由Parylene-C包覆的12 μm直径的碳纳米管纤维电极的抗弯刚度为0.23 ×10-9N·m2。将电极植入小鼠脑片的丘脑网状核(thalamic reticular nucleus,TRN)区域,可在光遗传刺激下记录到突触后神经元响应;在体实验中,利用此电极可检测到单个神经元的自发放电活动,从而证明了这一流体驱动的方法可用于柔性神经电极体内和体外植入及神经活动记录。

图4 双层PDMS微流控辅助碳纳米管纤维电极植入装置56Fig.4 Schematics of the two-layer PDMS microfluidic device assisting insertion of flexible CNTf microelectrodes 56.
3 碳纳米材料透明电极
3.1 透明石墨烯电极
石墨烯因其优异的导电性、导热性、可转移性和力学强度而被广泛用于多个研究领域。得益于其宽光谱范围内的高透光性57,石墨烯可用于制备透明神经电极阵列,实现电生理记录、光学成像和光遗传刺激的多功能集成,有助于进行高时间-空间分辨率的神经环路研究。
基于石墨烯的透明电极阵列允许大面积的入射光透过,同时入射光可直接照射位点之下的神经元23;相比之下,对于不透明的金属电极来说,只能刺激电极位点周围的组织,极大地限制了高分辨率的光遗传实验的进行57。Park等23制备了基于四层石墨烯的碳层电极阵列(carbon-layered electrode array,CLEAR),此器件包含16个石墨烯电极位点,Parylene-C作为电极基底和封装层(如图5a所示),其在紫外到红外波段内的透光率超过90%。器件受到光照时产生的光伪迹幅值具有光功率和光刺激持续时间的依赖性,因此,减小光功率可减少或消除伪迹。将CLEAR器件置于Thy1::ChR2转基因小鼠大脑皮层,实现了473 nm蓝光光遗传刺激下的神经电信号记录(如图5b所示);在电极记录位点处,由于石墨烯的宽光谱透光性,可透过CLEAR器件进行皮层血管的荧光成像和光学相干断层(optical coherence tomography,OCT)成像,透明的电极记录位点未对其下组织造成遮挡,可清晰成像。此外,在后续的工作中,此课题组使用16通道透明石墨烯微电极阵列(如图5c所示),进行微皮层电图(microelectrocorticography,μECoG)的记录,在转基因GCaMP6f小鼠皮层上实现了同时的神经电刺激和神经活动成像58。石墨烯的透光性使得电刺激诱发的神经活动可以通过荧光钙成像变得可视化。作者发现石墨烯电极的CIL可达到116.07-174.10 μC·cm-2。作者还发现相比阳极刺激,采用阴极刺激可以引起更强的神经响应,证明了电荷向大脑的更有效传递。这些工作展现了高透光性的神经电极阵列相对非透明金属电极在电生理技术、光学成像和光遗传实验中的优势。
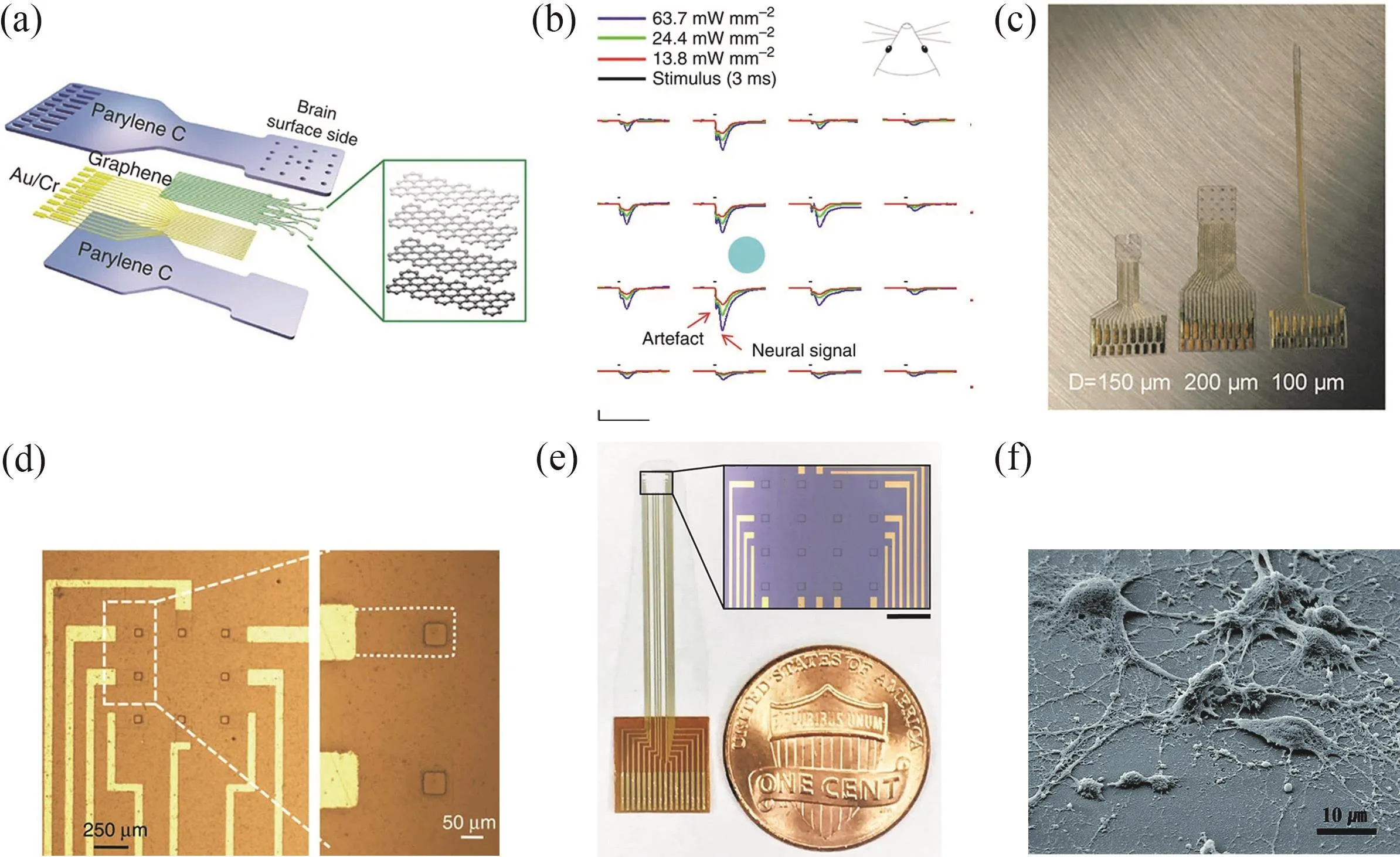
图5 透明石墨烯电极Fig.5 Transparent graphene electrodes.
Kuzum等14利用透明柔性石墨烯神经电极阵列实现了同步光学成像和电生理记录。电极以聚酰亚胺作为柔性基底,p型掺杂的石墨烯作为位点,SU-8作为封装层(如图5d所示),掺杂的石墨烯电极展现了低阻抗和高电荷储存容量。此电极可在海马组织切片上同时进行钙离子成像和电生理记录,而未引入光伪迹。透明的石墨烯电极可以检测到高频电活动,与具有较高空间分辨率但低时间分辨率的钙成像实现了互补。将石墨烯包裹于Ag电极表面,可极大地降低Ag的腐蚀;将包裹着石墨烯的Au电极浸于磷酸盐缓冲液六个月后,拉曼光谱仍显示了石墨烯的特征峰,证明了石墨烯不仅使电极具有低噪声和透光性,同时石墨烯可作为金属微电极的腐蚀保护层,具有长期稳定性。Thunemann等26采用电化学鼓泡法将石墨烯转移至50 μm厚度的聚对苯二甲酸乙二醇酯(polyethylene terephthalate,PET)基底上,石墨烯经过图案化成为电极位点,同时石墨烯表面的清理避免了裂纹的形成和有机物的残留;最后以SU-8作为封装层,得到了具有16个通道的透明石墨烯微电极阵列(如图5e所示)。电极的阻抗小于1.5 MΩ(1 kHz),将电极以5 mm的曲率半径(处于小鼠皮层的自然弯曲范围内)反复弯曲20次,未发现器件的失效。将电极置于小鼠初级躯体感觉皮层表面,可实现从皮层表面到1200 μm深度的中间神经元和血管的双光子成像;同时,利用此电极可进行单脉冲电刺激对侧胡须时LFP和钙离子瞬变信号的同步记录、光遗传调控下LFP信号记录和小动脉扩张的双光子成像,以及胡须刺激下同步血流动力学光学成像和神经电活动记录。
Jeong等59制备了透明的石墨烯/垂直排列碳纳米管杂化电极。电极的透光性允许对神经元进行光学监测和调控;同时,培养在其上的神经元紧密附着在电极表面(如图5f所示)并均匀分布,形成了复杂的神经网络。石墨烯/垂直排列碳纳米管电极构筑了良好的神经界面,可对体外培养的大鼠皮层神经元动作电位进行胞外记录,峰间幅值可达1.6 mV,均方根噪声水平为5.92 μV。
透明电极还可用于记录视网膜电图(electroretinography,ERG)60。Yin等61制备了柔性透明的石墨烯角膜接触镜电极(graphene contact lens electrodes,GRACEs)(如图6a所示),此电极具有宽光谱范围下的透光性和低阻抗,并可与角膜形成共形、紧密的界面,且在常规ERG的记录时间内,佩戴此电极没有对角膜产生明显的损伤。利用该电极,作者实现了多种ERG信号的高质量记录。在全视野ERG (full- field ERG,ffERG)记录中,GREACEs可记录到比商业ERG-Jet电极更高的角膜电位幅值;该电极还可以用于记录多焦ERG(multifocal ERG,mfERG)信号(如图6b所示),得益于共形界面带来的眼睛屈光度的保持。此外,多位点透明石墨烯电极阵列(如图6c所示)实现了具有空间分辨的ERG响应记录,并观察到ERG信号幅值在角膜中央最高,并向颞侧和鼻侧呈递减的现象。
3.2 碳纳米管透明电极
碳纳米管具有优异的电学性能,可形成超薄且光学透明的薄膜,并已发展了多种制备透明导电碳纳米管薄膜的方法62。因此碳纳米管在透明柔性生物电子器件领域具有极大应用潜力。通过浮动催化剂化学气相沉积法(floating catalyst chemical vapor deposition,FCCVD)制备得到的碳纳米管既可进一步纺成纤维46,也可在乙醇中经过致密化形成二维网络,后者可用于制备透明电极。
Zhang等63制备了基于碳纳米管网状薄膜的可拉伸透明电极阵列(如图7a所示),其中,电极以PDMS作为基底,SU-8作为封装层。该电极在400 nm到2.5 μm波长范围内的透光率超过85%,并且在20%的拉伸下透光率保持稳定。碳纳米管薄膜透明电极具有较低的阻抗和较高的电荷储存容量,在反复拉伸下阻抗变化极小。研究中将电极放置于小鼠脾后皮层(Retrosplenial cortex,RSC)表面,实现了光遗传刺激下的电生理记录(如图7b所示),同时,此电极具有比Au电极更小的光伪迹(如图7c所示),可忽略不计。将电极置于大鼠初级视觉皮层,在诱导的癫痫发作下,实现了同步双光子钙成像和ECoG信号记录(如图7d所示)。最后,基于该电极阵列优异的可延展性,作者还实现了麻醉态大鼠创伤性脑损伤下皮层脑电信号的原位、连续实时的检测,展示了该电极阵列在机械活性神经系统(包括创伤性脑损伤、脊髓等)中的应用潜力。
4 基于碳纳米材料的MRI兼容电极
应用于神经系统的电刺激可用于改善癫痫、帕金森、抑郁、听力损失和慢性疼痛等症状16。在电刺激中,电荷注入量不可超过电极材料本身的最大电荷注入密度,以避免发生不可逆法拉第反应64,因为这种在电极-组织界面发生的不可逆法拉第反应会损伤电极和周围组织49,65。因此,对神经刺激应用来说,需要寻找具有低阻抗和高电荷注入能力的神经电极材料64,同时还应考虑电极在体内的长期稳定性问题。
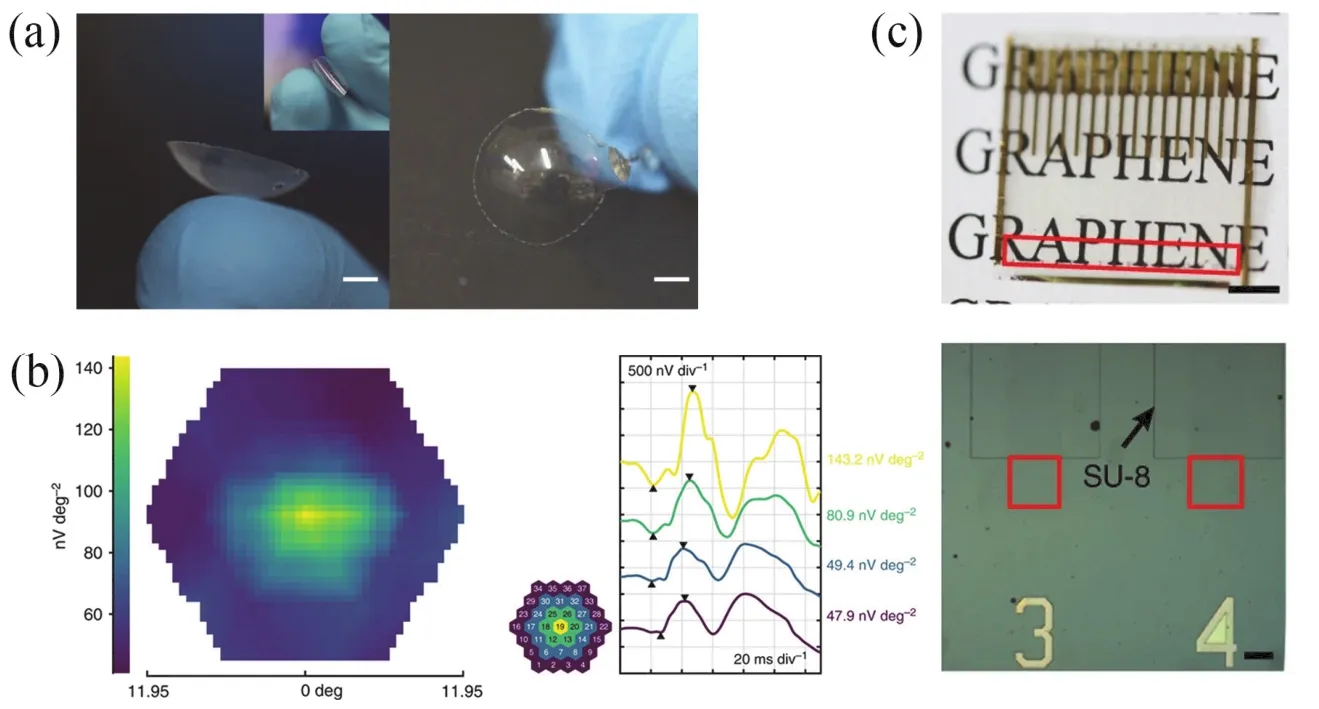
图6 柔性透明的石墨烯角膜接触镜电极61Fig.6 Soft transparent graphene contact lens electrodes (GRACE)61.
功能磁共振成像(Functional Magnetic Resonance Imaging,fMRI)为全脑规模的神经活动绘制和神经环路的探索提供了有利工具66,将其与DBS技术联用可以更好的研究大脑功能和连接模式,以及电刺激的调控效果和机理,这对神经系统疾病的诊疗具有重要意义。伪影是评估医疗器件是否具有MRI兼容性的重要因素67,由神经电极产生的伪影会阻碍MRI对周围组织结构的确定67,并影响对电极位置的判断。一些金属电极与生物组织的磁化率不匹配,会干扰磁场,导致在电极周围产生很大伪影67-70,影响了脑区的MRI信号的获得66;尤其是广泛应用于fMRI的回波平面成像(echo-planar imaging,EPI)序列,因为对磁化率不匹配更加敏感,使得fMRI更易受到植入物引起的场畸变的影响。因此,fMRI-DBS联用的关键是对电极材料和电极尺寸的选择。具有与水/组织相近的磁化率、高电荷注入能力的小尺寸电极,可以有效减小MRI伪影和组织损伤,并提高电刺激分辨率32,可实现DBS下大脑全激活图谱的获得。文献报道石墨烯和碳纳米管可用于制备MRI兼容的神经电极,实现对电极周围组织的MRI可视化及电极位置的确定31。
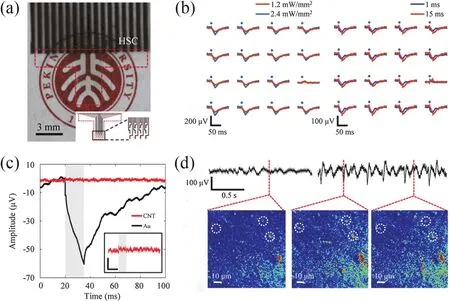
图7 透明碳纳米管电极63Fig.7 Transparent carbon nanotubes electrodes 63.
多孔结构和大比表面积的石墨烯纤维(graphene fiber,GF)具有较高的电荷注入能力,将其作为刺激电极或用于修饰神经电极的刺激位点,可在不损失刺激效率的前提下得到小尺寸电极,从而可以提高神经刺激的空间分辨率和选择性。Zhao等32研制了一种基于GF的高度MRI兼容的DBS电极,这种电极主要由水热法合成的石墨烯纤维以及纤维表面沉积的parylene-C绝缘层所构成(如图8a所示),该电极具有比同尺寸PtIr电极更高的电荷注入能力和高稳定性,同时在9.4 T MRI下具有更小的伪影(如图8b所示)。以帕金森症大鼠的丘脑底核(subthalamic nucleus,STN)为刺激靶点,利用此石墨烯纤维双极电极进行DBS,有效的提高了大鼠运动能力,改善了帕金森症状。作者在帕金森症的模型大鼠中实现了DBS-fMRI的同步联用,以STN为靶点,得到了DBS激活的包括刺激靶点在内的完整fMRI图谱,发现帕金森大鼠运动速度的提高和大鼠运动皮层(motor cortices)、内侧和外侧苍白球(internal globus pallidus,GPi;external globus pallidus,GPe)、丘脑底核和尾状壳核(caudate putamen)的血氧水平依赖(blood-oxygenationlevel-dependent,BOLD)响应正相关,这些结果暗示了DBS的机理有可能是通过正向和反向激活运动回路共同实现的。
Guo等31比较了碳纳米管纤维电极和PtIr电极在3T MRI扫描下的伪影,其中碳纳米管纤维电极具有更小的炎症反应和几乎不可见的MRI伪影。
前述Lu等33的工作发现所制备的碳纳米管纤维神经电极具有很高的MRI兼容性,与PtIr电极相比,碳纳米管纤维电极具有更小的MRI伪影(如图8c所示),可以允许对电极植入位置和周围脑组织的MRI可视化。
5 碳纳米材料神经电极的生物安全性
虽然碳纳米材料在生物电子学领域具有广阔的应用前景,但仍需考虑其生物安全性问题。文献报道具有一定尺寸和结构的石墨烯和碳纳米管可与细胞膜相互作用或被细胞摄取71-73;同时可诱导活性氧(reactive oxygen species,ROS)的产生而具有潜在的细胞毒性73,并且ROS的产生水平具有材料浓度和接触时间的依赖性。当PC12细胞暴露于100 μg·mL-1的石墨烯纳米片4 h后,ROS的水平相比于对照组增长了5倍,说明氧化应激机制参与了细胞毒性的产生过程73。因此,碳纳米材料的毒性问题一直以来受到广泛关注72,74。
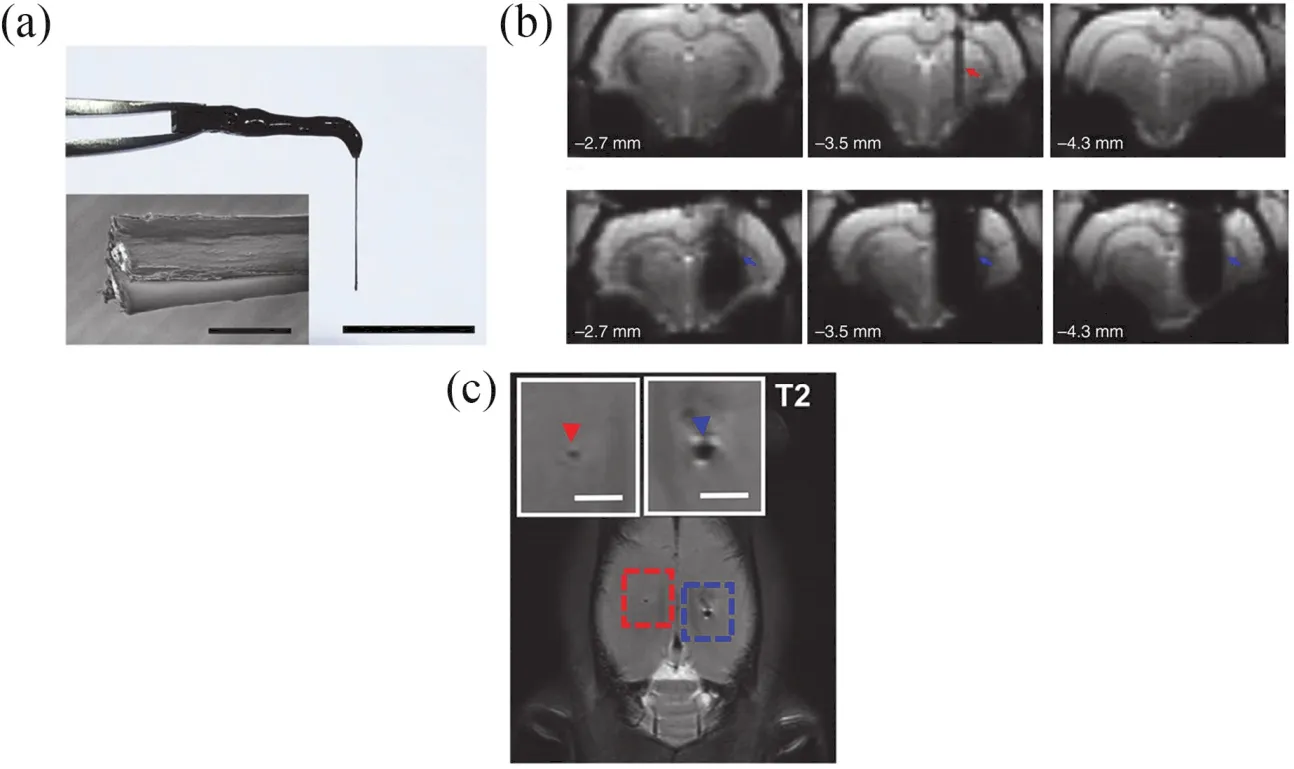
图8 MRI兼容的基于碳纳米材料的神经电极Fig.8 MRI compatible neural electrodes made from carbon nanomaterials.
目前,对于碳纳米材料细胞毒性的报道多是基于石墨烯和碳纳米管的悬浮液。当碳纳米材料以悬浮液形式存在时,具有更高的流动性,可以进入细胞,并分散在细胞质中而具有细胞毒性41,75。碳纳米材料的细胞毒性效应受到诸多因素的影响,包括纯度、尺寸分布、分散和聚集状态、表面功能化以及相关的实验变量(如使用剂量、细胞群)72,76-78。值得注意的是,上述这些因素间存在相互作用,当进行细胞毒性研究时,应当充分考虑这些相互作用。
乳酸脱氢酶(lactate dehydrogenase,LDH)的释放标志着细胞膜的损伤和细胞坏死,Zhang等73发现将PC12细胞暴露于高浓度(100 μg·mL-1)石墨烯纳米片溶液24 h后,LDH的释放量增加,但低浓度(0.01-10 μg·mL-1)石墨烯对LDH的释放没有影响;相比之下,单壁碳纳米管诱导了更严重的LDH的释放,且释放量随浓度的增加而增大;这可能是因为碳纳米管更具有流动性,更容易穿透细胞膜,从而导致细胞膜损伤。
Belyanskaya等76探究了单壁碳纳米管(singlewalled carbon nanotubes,SWCNTs)对神经细胞的影响。将神经元与神经胶质细胞暴露于不同浓度的SWCNTs悬浮液中,其中,30 μg·mL-1的SWCNTs使DNA含量降低了35%,暗示了细胞数量的降低,DNA含量的降低存在着SWCNTs浓度的依赖性,且SWCNTs的团聚程度越大,毒性也越大。
但是,基于碳纳米材料的神经电极未发现明显的细胞毒性,主要是因为用于构筑或修饰神经电极的碳纳米材料以非溶液态形式存在,将其制备成纤维、沉积在基底上或嵌入到其它聚合物基质中时,可避免脱落并降低其在体内扩散及残留的可能性46,79,其危险性也大大降低,未发现相关的毒性效应。如前述Zhang等11工作中,将碳纳米管分散在PSS溶液中,之后通过LBL自组装法在涂覆了PVA的基底上沉积成膜,制备得到CNT:PSS/PVA复合物电极。将电极植入脑组织后再移出,发现其结构保持完整且无明显脱落现象,证明了碳纳米管可牢固附着于基底上。在神经元生长的研究中80,功能化的多壁碳纳米管(multi-walled carbon nanotubes,MWNTs)表面携带正电荷,可在聚乙烯亚胺(polyethyleneimine,PEI)基底上沉积成膜,PEI的存在避免了MWCNTs的剥落。MWNTs基底表现出良好的生物相容性并可促进神经突的生长。Chen等79将PEDOT-碳纳米管沉积到预先溅射了Au的基底上,形成了具有纳米隧道结构的复合物涂层。在此研究中,碳纳米管嵌入到PEDOT基质中,降低了其在体内扩散的可能性。在体外细胞培养实验中,神经元可紧密附着于PEDOT-碳纳米管涂层上,并促进了神经突的生长。此外,将PEDOT-碳纳米管沉积到电极位点,可进行大鼠坐骨神经的急性信号记录。由此可看到,通过优化基于碳纳米材料电极的制备方法,可避免碳纳米材料在生物体内的脱落与扩散,证明了碳纳米材料可用于构筑生物相容性的神经界面。
面对碳纳米材料生物效应的广泛讨论,应该避免对其毒性问题的普遍化或一般化,因为与这些纳米材料相关的风险取决于具体的应用环境72;另外,石墨烯和碳纳米管的结构不同,其与细胞相互作用的机制也不相同73,导致两者对细胞的毒性存在差异。因此,应对石墨烯与碳纳米管的生物相容性进行分别评估24。未来的研究需要根据碳纳米材料的不同物理和化学性质进行生物安全性的全面探索,设计并优化碳纳米材料的制备工艺,以最大限度地降低对人类健康和环境的风险。
6 总结与展望
碳纳米材料为柔性和多模态兼容的神经电极技术的发展注入了新的活力,基于石墨烯和碳纳米管的神经电极实现了同步电生理测量和光学调控以及DBS-fMRI的联用,为大脑神经环路的研究及神经系统疾病的DBS治疗研究提供了有力工具。然而,对于碳纳米材料在基础神经科学研究和临床中的应用来说,仍然存在很多挑战。首先,如何改善碳纳米材料的制备和加工方法,以获得结构、纯度、功能化状态等一致可控的神经电极,从而提高其生物安全性,仍是需要解决的问题。其次,需要发展小尺寸且多位点集成的神经电极,以实现大范围神经活动的检测。此外,迄今为止大多数神经电极的研究是在哺乳动物模型中进行的,因此,还需要考虑到动物模型与人类在力学、形态、组织等方面的异同,并进一步改善神经电极的尺寸和结构。最后,很多临床应用需要植入物在数年的时间尺度内工作,碳纳米材料在这个长时间尺度内的稳定性和安全性也急需评估。因此,基于碳纳米材料的神经电极在面向临床转化前仍需要进行诸多研究工作,以构筑电极与生物组织之间高效且稳定的神经界面,实现高分辨、安全且长期稳定的神经记录和刺激。
