基于上转换纳米粒子的低损伤神经界面技术
2020-12-23邹亮田慧慧
邹亮 ,田慧慧
1中国科学院纳米科学卓越创新中心,国家纳米科学中心,北京 100190
2中国科学院大学,北京 100049
1 引言
光遗传是一种结合光控技术和基因技术的神经调控技术,能够以毫秒级的时间精度对特定类型神经元的电活动实现选择性地激活或抑制1-4。利用基因技术使光敏蛋白基因在特定类型神经元的细胞膜上表达光敏蛋白离子通道或离子泵,通过相应波长激发光照射,能够控制细胞膜结构上的光敏蛋白的激活与抑制,从而实现对神经元活动性的调控,揭示各种神经元在神经环路中的功能和相互联系方式。近年来,随着光控技术和基因技术的进步,光遗传在神经科学领域迅速发展。尽管如此,目前报导的光敏蛋白普遍采用可见光作为激发光2,5-7,这给神经调控带来了许多难题。由于组织对可见光的吸收和散射非常严重8,9,这会导致激发光能量的损失和组织发热,因此为了调控深脑组织神经元的活动,就必须将光纤或者光电器件(如uLED)植入到目标脑区10-15。然而这种侵入式的调控会造成较严重的组织损伤,并且植入光纤的后端通常需要连接外部设备,会在一定程度上限制动物的活动,进而影响动物行为学实验的可靠性。
针对上述难题,研究人员研发出了许多新型光敏蛋白。例如Bedbrook等16研发了一种新型光敏蛋白-ChRger2,虽然这种光敏蛋白的激发光波长仍然位于可见光的蓝光波段,但是由于它的光敏性远大于常用的蓝光激活光敏蛋白ChR2(H134R):一种常用于体内光遗传的增强型光电流单突变体,因此所需的激发光强度很小。利用这种新型光敏蛋白,Bedbrook等成功地通过颅外蓝光照射激活了小鼠右侧次级运动皮层的神经元,对小鼠的转向行为进行了调控。值得注意的是,一方面该研究选取的脑区位于大脑表层,并且对颅骨做了钻薄处理,这种新型光敏蛋白对位于大脑深处神经元的调控能否起作用有待验证,另一方面由于组织对蓝光有很强的散射作用,这种施加激发光的方式难以实现对大脑深处小体积核团的精准照射。由于组织对长波段光的吸收和散射作用较小,在过去的研究中,除了研发新型高光敏性的光敏蛋白之外,在开发能够将激发波长红移的新型光敏蛋白方向也取得了一系列的进展。比如,2008年Zhang等17研发了VChR1光敏蛋白,这种光敏蛋白在黄光(589 nm)照射下就能激发出动作电位。相比于常用的蓝光(473 nm)激发光敏蛋白ChR2和VChR1,实现了激发光红移;黄光在组织中的穿透性强于蓝光,因此激活组织中VChR1所需激光能量更低,降低了组织发热现象。然而这种红移光敏蛋白产生光电流的动力学性能差,难以实现对神经元活动的高频调控,并且它在细胞膜上的表达能力较差。2013年,Lin等18报导了ReaChR光敏蛋白,他们利用这种光敏蛋白实现了颅外红光(655 nm)照射,调控小鼠触须的运动行为。相比于VChR1,该蛋白的激发光波长进一步红移,且在细胞膜上的表达能力得到了提高。还有许多团队在光敏蛋白激发光红移方向做了努力,比如2011年Yizhar等19报导的光敏蛋白C1V1 (E122T)在红光(630 nm)照射下能可靠地触发动作电位,2014年Klapoetke等20报导的光敏蛋白Chrimson能稳定地被红光(660 nm)激活。但到目前为止,以近红外光(NIR,650-1350 nm)为激发光的光敏蛋白尚未有报导。
作为一种替代手段,上转换纳米粒子(UCNPs)可以将低频的NIR转换成高频的可见光用于激活光敏蛋白,间接实现NIR光遗传体系21,22。由于生物组织对NIR的吸收和散射作用较弱23-26,因此UCNPs介导的NIR光遗传体系相比于其他光遗传体系具有许多独特的优势。理论上,将UCNPs引入表达了光敏蛋白的神经元附近,通过照射NIR,即可控制神经元表面离子通道的激活或关闭。然而在活体光遗传实验中,还需要考虑诸多因素。首先,UCNPs的各项参数应当与光遗传实验相匹配:1)激活UCNPs所需的激发光在组织中的穿透能力和吸收性;2)UCNPs的发射光谱与所用光敏蛋白的激发光谱的匹配性,二者重合度越高,越容易实现对UCNPs的激活;3)UCNPs的发光寿命与选用的光敏蛋白对激发光的响应时间的匹配性。其次,在激发光波长等条件一定的情况下,若UCNPs上转换效率较低,则需要使用较大功率的NIR才能得到足够高的上转换荧光能量来激活光敏蛋白,而大功率NIR会导致组织发热,这严重制约了UCNPs在光遗传实验中的应用。因此,如何在保持良好生物相容性的同时提高UCNPs的荧光强度对其在光遗传体系的广泛应用具有深刻意义。本文将着重介绍UCNPs的各项参数如激发波长、发射波长、发光寿命与光遗传实验的匹配性问题以及增强UCNPs的转换效率的方法,主要包括优化UCNPs结构和修饰有机染料两种方法,总结和讨论了UCNPs介导的光遗传工作,并对构建同步进行调控和检测活体大脑电活动的低损伤、双向神经界面进行了展望。
2 UCNPs参数与光遗传实验的匹配
利用UCNPs作为激活光源进行光遗传实验,需要考虑所选用的UCNPs的激发光在组织中的穿透能力与吸收性、UCNPs的发射光与光敏蛋白吸收峰的重合度以及UCNPs的发光寿命与光敏蛋白的响应时间之间的匹配性问题。
2.1 UCNPs的激发光
不同波长的激发光在组织中穿透能力以及组织中的水对其吸收能力均不相同。在近红外光波段范围内,通常波长越长,其在组织中的穿透能力越强,但同时组织中的水对其吸收能力也越强,两种情况在极端情况下都容易导致组织过热,因此在选择激发波长时需要折中考虑。通过在UCNPs的结构中引入不同稀土元素作为敏化剂可以调节其激发波长。例如Yb3+离子的吸收中心为980 nm,以该离子为敏化剂的UCNPs可被980 nm激发光激活,进行上转换过程27。然而,组织中的水对该波长的吸收性相对较强。以Nd3+离子作为敏化剂的UCNPs可在800 nm激发光的照射下进行上转换过程28,29。虽然800 nm激发光在组织中的穿透能力比980 nm弱,但是它在组织中的水吸收系数比980 nm要小几十倍23,28,30。因此,在活体光遗传实验中选择敏化剂离子的时候,需要综合考虑其激发波长在组织中的穿透能力和吸收性。并且UCNPs通过选择不同敏化剂离子调节激发光波长是一个相对独立的过程,不会限制其发射光的设计,该特性为光遗传实验的设计带来了便利。
2.2 UCNPs的发射光
由于光敏蛋白的激发波长不尽相同,调控UCNPs的发射光谱,使之与光敏蛋白的激发光谱相匹配,对高效地进行光遗传实验至关重要。UCNPs的发射光谱主要依赖于激活剂所用稀土元素的特征发射峰31。例如Tm3+离子具有475 nm的发射峰,可用于激活吸收峰为蓝光的光敏蛋白。而Er3+离子的最强发射峰为543 nm27,32,Ho3+离子的发射峰为541 nm33,可以激活对绿光甚至黄光敏感的光敏蛋白。除此之外,Er3+离子还有651 nm的发射峰27,32,可用于激活对红光敏感的光敏蛋白。因此,Tm3+、Er3+和Ho3+的发射峰波段范围可以匹配许多光敏蛋白的激发光谱。尽管Er3+和Ho3+的发射峰接近黄光,但是用它们激活以黄光为激发光的光敏蛋白效率较低,而近期报道以Eu3+离子作为激活剂的UCNPs具有590和616 nm发射峰34,35,能高效地激活以黄光为激发光的光敏蛋白。如果UCNPs的发射光谱与光敏蛋白的吸收光谱匹配度较低,激活光敏蛋白所需的激光能量就要更高,甚至无法激活光敏蛋白。因此在活体光遗传实验中选择激活剂离子的时候,需要考虑该激活剂离子的发射光谱与所选光敏蛋白的激发光谱之间的匹配度,以实现高效地调控神经电活动。
2.3 UCNPs的发光寿命
最后,不同光敏蛋白对激发光的响应时间不同,在时间精度上能达到毫秒级1-4。而稀土离子的发光响应也具有一定寿命,即从激发态返回到基态所用平均时间31,其本征衰减曲线从微秒级到毫秒级不等。如果稀土离子的发光寿命超出光敏蛋白的响应时间过多,则会导致激发调控神经活动能跟随的激发光脉冲频率降低。反之,如果UCNPs的发光寿命远小于光敏蛋白的响应时间,则会导致光敏蛋白难以激活。因此在UCNPs介导光遗传实验的设计过程中,稀土离子的发光寿命和光敏蛋白的响应时间相匹配也是一个需要考虑的因素。在材料合成过程中,通常可通过调节掺杂剂浓度36-38、UCNPs尺寸39,40和结构中能量传递过程41,42来调节UCNPs的发光寿命,使之与相应的光敏蛋白匹配。
3 增强UCNPs转换效率的方法
如前所述,在光遗传实验中,增强UCNPs的转换效率能有效降低激发光能量,从而降低组织热损伤。其中增强UCNPs转换效率主要可以通过设计壳结构保护纳米颗粒表面和修饰有机染料提升纳米颗粒光吸收能力两种方式实现。如果能够结合两种方式的优点,则能达到更好的增强效果。
3.1 通过设计核壳结构增强UCNPs转换效率
UCNPs的表面态对其转换效率影响很大,由于UCNPs的比表面积较大,其表面有较多的杂质、配体和溶剂分子,从而导致多光子弛豫效应,使UCNPs表面掺杂离子猝灭而减少发光中心发光离子的数量,从而造成能量损失。除此之外,UCNPs内部的掺杂离子会通过能量转移过程将激发能量传递给表面猝灭位点,产生非辐射弛豫,降低转换效率。因此,抑制表面猝灭能有效地提高UCNPs的转换效率。目前,利用基质材料作钝化壳是一种常用的抑制表面猝灭的手段。如2007年Yi等43报导了一种核-钝化壳结构的UCNPs,他们在NaYF4:Yb核的表面包裹一层NaYF4作为钝化壳。实验结果表明,与未包裹钝化壳的UCNPs相比,这种核-钝化壳结构的UCNPs的转换效率提高了30倍。通过相似的原理,Mai等44在2007年、Ansari等45在2016年对NaYF4:Yb/Er UCNPs做了钝化壳处理,都成功地增强了UCNP的转换效率。2008年Schäfer等46报导的KYF4:Yb/Er UCNPs经过钝化壳处理后,转换效率显著提升(图1a,b)。
除此之外,在钝化壳中掺入合适浓度的敏化剂或者敏化剂和激活剂得到的活性壳不仅能抑制UCNPs的表面猝灭效应,而且还能增强UCNPs对NIR能量的吸收和传递能力,从而进一步增大UCNPs的转换效率。2009年,Vetrone等47把NaGdF4:Yb活性壳包裹到NaGdF4:Yb/Er表面,相比于之前提及的用钝化壳包裹UCNPs抑制表面猝灭提高转换效率的方法,这种方法得到的绿色荧光和红色荧光分别增强了3倍和10倍(图1c,d),这是由于加入的Yb3+离子能够存储激活能,随后又能高效地将能量传递给核中的激活剂。还有许多诸如此类应用壳结构抑制表面猝灭的研究工作都成功实现了对UCNPs转换效率的显著提升48-54。

图1 各种增强上转换效率方法的荧光强度和发射谱对比Fig.1 Enhanced upconversion efficiency of different kinds of core-shell UCNPs.
3.2 通过修饰有机染料增强UCNPs转换效率
虽然通过壳的保护以及敏化剂和激活剂的掺入可以在很大程度上提升UCNPs的转换效率,但UCNPs中的镧系离子光吸收截面小和激发峰窄的本质特性导致许多激发光没有被捕获,这限制了荧光亮度的进一步增强。有机染料的光吸收截面比镧系离子大3到4个数量级,研究发现,对UCNPs修饰有机染料之后能有效提高UCNPs捕获外界激发光子的能力,从而进一步提高UCNPs的转换效率。2012年,Zou等55首次实现了对UCNPs修饰有机染料,他们的实验证明经染料修饰后的UCNPs在很宽的波长范围内都具有吸收能力,并且相比于未经染料修饰的UCNPs,转换效率增强了~3300倍。随后研究人员对UCNPs修饰不同的荧光基团,提高UCNPs转换效率,如2015年,Wu等56对UCNPs分别修饰了商业有机染料IR-783和IR-820以及他们团队自己合成的IR-808和IR-845有机染料,经实验对比,修饰了IR-808染料的UCNPs在在相应激发光照射下,其荧光亮度比没有修饰有机染料的UCNPs提高了200倍,而修饰了IR-845、IR-783、IR-820染料的UCNPs相比于没有修饰染料的UCNPs,荧光亮度分别提高了100倍、80倍和70倍。按照相同方法,2017年Lee等57也实现了修饰有机染料增强UCNPs的上转换效率。
3.3 结合两种方法增强UCNPs转换效率
如前所述,在UCNPs的设计过程中,如果能够将设计壳层结构保护纳米颗粒表面和修饰有机染料提升纳米颗粒光吸收能力两种方式结合到一起,有望达到更好的增强转换效率的效果。修饰了有机染料的核壳结构UCNPs结合了核壳结构的优势和染料分子优良的光捕获能力,极大程度地提高了UCNPs的转换效率。其主要的增强原理是在经过有机染料修饰过的核壳结构UCNPs体系中,有机染料可以高效地吸收红外光,将这些能量传递给壳中的敏化剂,随后这些敏化剂会将这些能量输送到核内的敏化剂,最后这些能量被核内敏化剂附近的激活剂捕获进行上转换。2015年,Chen等58报导的染料修饰的核壳结构UCNPs,通过这种多级能量传递方式,实现了转换效率~100倍的提升(图1e,f)。修饰了有机染料的核壳结构UCNPs的上转换效率远大于普通UCNPs,这给UCNPs在光遗传领域的应用带来了契机。2016年Wu等59发现经IR-806修饰过的核壳结构UCNPs的转换效率很高,仅需1.5 W·mm-2的NIR (800 nm)就能激活表达了ReaChR光敏蛋白的海马神经元。但是此实验只在细胞层面验证了UCNPs在光遗传领域的应用,在活体中的近红外光调控神经活动实验有待进一步开展。
4 UCNPs在光遗传领域的应用实例
相比于可见光,组织对NIR的吸收和散射要弱很多,因此NIR在组织中的穿透性优于可见光。UCNPs可以将组织穿透性好的NIR转换成可激活光敏蛋白的可见光,因此将UCNPs应用到光遗传实验中,可以实现颅外激光照射调控深脑神经元活动。对此,研究人员开展了一系列工作,拓展了光遗传在脑科学中的应用。
4.1 UCNPs的体外光遗传应用
2015年,Hososhima等60首次将UCNPs应用到光遗传实验,他们在含有UCNPs的聚合物薄膜上培养表达了C1V1光敏蛋白的细胞,当用NIR (980 nm)照射培养细胞的薄膜基底时,薄膜中的UCNPs发出绿色荧光并激活培养在薄膜上的细胞,使其产生动作电位。该工作首次实现了将UCNPs与光遗传实验相结合,通过用生物相容性好的聚合物薄膜包裹UCNPs的方法巧妙地避免了纳米粒子与细胞直接接触导致的细胞毒害作用。然而相比与前面介绍到的2016年Wu等59的染料敏化核壳结构的UCNPs-仅需1.5 W·mm-2的NIR (800 nm)激活光敏蛋白,该工作中所用的激光功率高达58 W·mm-2,如此高功率的NIR照射会导致细胞温度升高,不仅会影响细胞活性,而且会激活细胞膜上自然存在的热敏蛋白,影响试验结果。为了提高转换效率,2015年Shah等61合成了核壳结构UCNPs,他们将核壳结构的UCNPs与PLGA混合形成基底,研究转染了ChR2的神经细胞是否能被NIR激活。实验结果表明,这种核壳结构的UCNPs在8 W·mm-2的NIR (980 nm)照射下发出的蓝色荧光足够激活ChR2光敏蛋白,并且能在10 Hz脉冲NIR照射条件下稳定获得重复出现的动作电位(图2)。虽然这些工作证明了UCNPs发出的荧光能够激活表达了光敏蛋白的细胞,但是由于体外培养环境与活体环境的差异巨大,UCNPs介导的活体光遗传还要解决很多难题,例如:1)将包含UCNPs的聚合物薄膜植入组织时,植入的体积太大会给组织带来很大损伤,植入体积太小荧光强度不足以激活光敏蛋白;2)活体实验中NIR需要穿透皮肤、颅骨、脑组织等等,这些都会导致NIR的光强变弱,因此增大激发光能量不可避免,而这可能会导致温度升高,对组织造成伤害。
4.2 UCNPs的活体光遗传应用
2016年Bansal等62首次将UCNPs用于活体光遗传实验。该工作首先对转染了ChR2的线虫做饥饿处理,随后将饥饿的线虫暴露到他们合成的UCNPs (Si外壳,发射蓝色荧光)溶液中使线虫摄取UCNPs,最后通过施加准连续NIR (980 nm)光照射线虫,成功调控了线虫的运动方向(图3),并且没有发现明显的组织过热和纳米粒子毒性的副作用。除此之外,2017年Ai等63在幼年斑马鱼模型中,也通过用NIR (808 nm)照射UCNPs发射蓝色荧光,成功激活ChR2光敏蛋白。值得注意的是,线虫和幼年斑马鱼的身体透明度相对较高,对光的透过性好,因此对于UCNPs在组织穿透性较差的啮齿类动物中的光遗传应用还有待进一步探索。
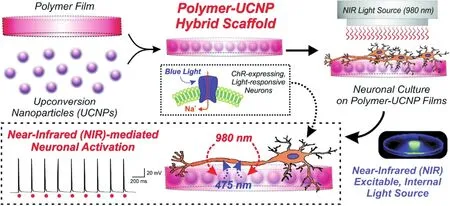
图2 用包裹UCNPs的聚合物薄膜实现光遗传激活神经元的示意图61Fig.2 Schematic diagram depicting the generation and application of polymer-UCNP hybrid scaffolds for optogenetic neuronal activation 61.

图3 UCNPs介导的NIR光遗传调控线虫运动行为62Fig.3 Modulation of movement behavior in C.elegans by UCNP-mediated NIR optogenetics 62.
2017年Lin等64首次将UCNPs应用到啮齿动物光遗传实验(图4a,b,c)。他们通过掺杂Tm3+离子或Er3+离子,得到了发射荧光波长与ChR2和C1V1光敏蛋白相匹配的核壳结构UCNPs。他们将分散有此UCNPs的溶液加入微玻璃管,待溶剂挥发后剪断微玻璃管并密封好,随后将钨丝电极与此光学器件绑到一起,最后将此器件植入大鼠脑组织,通过颅外施加980 nm 的NIR,在功率为7 mW·mm-2和4.4 mW·mm-2时,分别成功激活了发射波长为470 nm和540 nm的UCNPs,并相应激活了V1M脑区(1 mm深)的ChR2和C1V1光敏蛋白,记录到了相应的动作电位,实现了同时对神经活动的调控和神经信号的检测。但是值得注意的是,此实验是在老鼠麻醉状态下进行的;所选脑区距离脑表仅1 mm,经过选用合适的光敏蛋白,通过颅外照射可见光即能对该深度的神经元进行调控;且微玻璃管包裹虽然能够使UCNPs与细胞隔离,降低对细胞的毒性,但玻璃管和所用钨丝电极都是刚性的,会对组织造成一定程度的损伤以及炎症反应,因此生物相容性有待进一步提高。同年,Wang等65利用相同方法制备了负载有UCNPs的光学器件,通过埋植该器件实现了颅外施加NIR (980 nm,5 mW·mm-2)调控自由活动老鼠VTA脑区(4.5 mm深)、皮层纹状体脑区(3 mm深)和视觉皮层脑区(1 mm深)的神经活动。其实验结果证实负载UCNPs的光学器件植入组织后没有引发严重的免疫反应,并且NIR照射时皮肤的温度没有显著升高。这说明该方法可以用于自由活动老鼠深脑光遗传实验。通常来说,相比于激活兴奋性光敏蛋白,激活抑制性光敏蛋白需要更高能量的荧光照射,这就要求UCNPs具有更高的转换效率66。2018年,Lin等67通过核壳壳结构进一步增强了UCNPs的转换效率,与之前所用核壳结构UCNPs相比,转换效率提升了~3倍。利用相同方法,他们实现了将UCNPs用于神经活动抑制的实验,并同时成功地检测到了神经元的动作电位(图4d,e,f,g)。他们通过体外NIR (980 nm,6 mW·mm-2)照射自由活动老鼠,成功激活了大鼠STN脑区(7.8 mm深)和小鼠次级运动皮层(0.5 mm深)中神经元细胞膜表面的抑制性光敏蛋白-eNpHR3.0,记录到了大鼠相应脑区中的电生理信号,并且实现了调控自由移动小鼠的运动功能。

图4 植入负载UCNPs的微玻璃管实现NIR光遗传调控老鼠神经活动Fig.4 NIR neuromodulation in mice/rats by micro-optrodes containing UCNPs.
为了减小刚性器件与柔性组织力学性能不匹配带来的损伤,构建更稳定的神经调控界面,2018年Chen等68直接注射含有UCNPs的溶液到脑组织,实现了颅外照射NIR (980 nm,96W·mm-2)激活光敏蛋白,调控小鼠VTA脑区的神经活动(图5a,b,c)。他们所用UCNPs为SiO2包裹的核壳结构UCNPs。SiO2的包裹解决了UCNPs对细胞的毒害作用,因此在细胞毒性表征实验中没有发现显著的细胞毒害作用。并且由于没有引入大尺寸刚性材料,实验中没有发现严重的免疫反应,这体现了该方法良好的生物相容性。此研究还发现,SiO2包裹的UCNPs注射到体内一个月后还能稳定停留在注射位点附近,没有发现很明显的扩散,这证明该方法可以实现在一定时间期限内稳定调控动物神经活动(图5d)。相比于前述用高光敏性光敏蛋白进性颅外可见光照射调控小鼠活动的实验而言,该工作中UCNPs是定点注射的,其发射光只会调控注射位点附近神经元的活动性,因此这种给光方式的空间精度更高;相比于用微玻璃管负载UCNPs植入脑区的工作,这种注射UCNPs的方法无需将刚性器件植入脑组织,因此对组织造成的损伤更小,具有更良好的生物相容性。之后,2019年Miyazaki等21将一种已实现商品化的微米尺寸上转换颗粒注射到脑组织之后,通过颅外施加NIR(976 nm)照射成功激活了小鼠mPFC和dSTR脑区中表达了C1V1光敏蛋白的神经元,并且调控了自由移动小鼠的运动行为(图6)。为了研究此方法的稳定性,Miyazaki等将这种上转换颗粒注射到脑组织,两个月后通过MRI实验结果发现注射的上转换颗粒没有发生明显的扩散。这可能是因为这种上转换颗粒是微米尺寸的,相比于纳米尺寸颗粒,其扩散性要小许多。因此,通过合理优化上转换材料的结构、组成、尺寸以及使用方法等参数,基于上转换材料的光遗传技术有望实现长期稳定地利用NIR调控动物深部脑区神经活动。
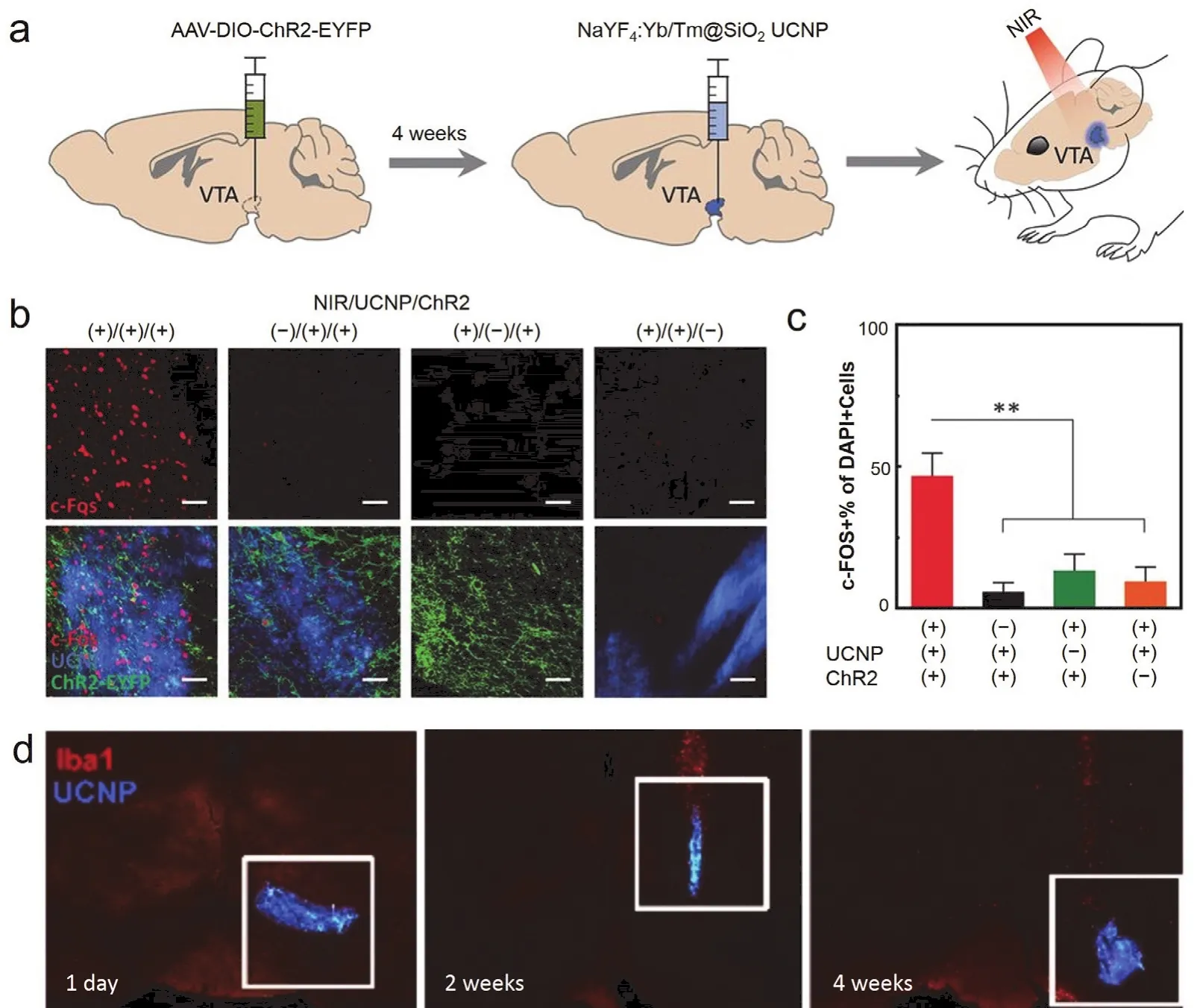
图5 注射含有UCNPs的溶液实现NIR光遗传调控小鼠神经活动68Fig.5 NIR neuromodulation in mice by injecting solution containing UCNPs 68.
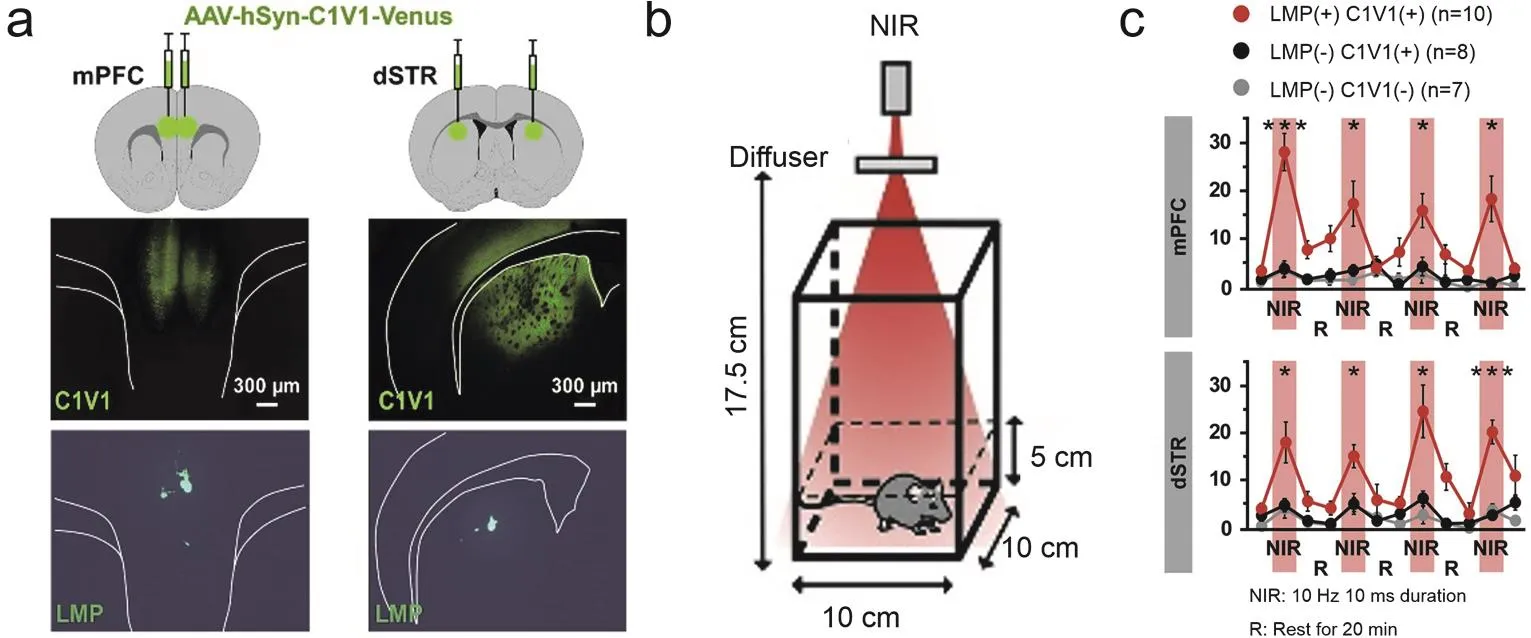
图6 注射含有上转换微粒的溶液实现NIR光遗传调控小鼠神经活动21Fig.6 NIR neuromodulation in mice by injecting solution containing lanthanide micro-particles (LMPs)21.
5 总结与展望
UCNPs可以将组织穿透性好的NIR转换成与光敏蛋白匹配的可见光,将UCNPs与光遗传技术相结合,从而实现颅外照射NIR激活深脑中表达了光敏蛋白的神经元,对自由移动动物的行为进行调控。相比于传统光遗传技术,基于UCNPs的光遗传技术不需要在动物组织中植入光纤或微型LED等光学设备,因此,UCNPs介导的光遗传实验对动物组织的损伤更小。同时由于不需要用连接连接线埋植在动物脑中的光学设备和外部光源设备,因此在行为学实验中动物的活动更能反映动物的真实状态,提高动物行为学的可靠性,这些对研究人员了解神经环路的结构与功能非常有益。因此用UCNPs介导的NIR光遗传技术备受研究人员青睐,近年来发展迅速。尽管如此,转换效率低、组织发热、纳米粒子对细胞的毒害作用、纳米粒子在组织内的稳定性差等问题限制了该体系的广泛应用。通过设计壳结构避免表面猝灭效应,修饰有机染料提高光吸收能力等手段可以提高UCNPs转换效率。转换效率的提高能降低所需激发光的能量,因此同时也能减轻组织发热的问题。通过对UCNPs表面修饰生物兼容材料或者将UCNPs包裹到柔性生物兼容聚合物中,能够避免UCNPs与细胞直接接触,从而解决UCNPs对细胞的毒害问题。与此同时,UCNPs被聚合物包裹后植入组织,其空间位置将被严格限制,不再扩散,因此可以长期稳定发挥作用。
高时空精度地调控和检测神经活动对了解神经元之间如何交流以及行为功能如何发生是非常重要的69-73。但是目前将UCNPs介导的小损伤光遗传技术与神经电极技术,尤其是柔性神经电极技术结合的研究工作较少;2015年Liu等74研发了一种可注射网状柔性神经电极,相比于金属丝电极或者硅电极,这种柔性电极与大脑力学性能更匹配,能构建更稳定的神经界面,有利于长期检测神经元活动。2019年Guan等75研发了一种操作简便的自组装柔性神经流苏电极,这种电极在聚乙二醇(PEG)聚合物的熔融液中自组装后固化得到直径为几十微米的针状电极,即能顺利植入脑组织,随后PEG降解,神经电极恢复柔性。这种柔性神经电极可以与大脑构建优良的神经界面,实现对神经元动作电位长期稳定地检测。将这种柔性电极与UCNPs介导的光遗传结合,有望构建稳定的双向神经界面,实现小损伤长期检测与调控神经活动,这对脑科学基础研究和神经疾病治疗等具有重要的应用价值。
