太子参电热干燥工艺的试验研究
2020-12-23蒋静怡贺潇宇庞文生
蒋静怡 ,魏 丹,贺潇宇,庞文生,胡 娟 ,2
((1.福建中医药大学药学院,福州350122;2.福建中医药大学附属第二人民医院,福州350003))
太子参系石竹科植物孩儿参Pseudostellaria heterophylla(Miq.)Pax ex Pax et Hoffm.的干燥块根,具有益气健脾,生津润肺的功效[1]。太子参含有糖类、苷类、环肽类、氨基酸等多种成分,主要有降低血糖、血脂[2],改善胰岛素抵抗,心肌保护、免疫调节,抗氧化等药理作用[3],其中发挥降低血糖、血脂、改善胰岛素抵抗,心肌保护、增加免疫、抗疲劳等作用的化学成分为太子参多糖[4],因此太子参多糖含量在太子参质量评价中占重要地位。
太子参药材的主产区为福建柘荣、安徽宣州、贵州施秉[5],主要有自然干燥和电热干燥两种方式。自然干燥受天气的影响较大,采收季节如遇阴天下雨,太子参得不到及时干燥,导致霉变腐烂造成参农经济损失。已有学者对太子参干燥方式进行研究[6-8],蒸制后干燥、微波真空干燥、远红外干燥等方式,操作复杂,耗能多,成本高,不适用于实际生产;70°C~90°C 的热风烘干方法可作为黔产太子参晒干方式的有益补充;课题组前期研究发现 50°C6 h-60°C17~18 h干燥的太子参样品外观性状较好[9],超过75°C烘干容易导致颜色变深,甚至发红,远低于黔产太子参所需的最佳温度。探究其原因,太子参规格大小对电热烘干工艺参数影响甚大。本文研究单个最粗部位直径0.25 cm及以上重量占比≤40%,规格为小统太子参,确定其电热烘干的最佳工艺参数。
1 材料与方法
1.1 仪器
DHG-9140A型电热恒温干燥箱 (上海精宏实验设备有限公司);CN-V3-3003型电子计数天平(厦门巨林仪器有限公司);UV-3200型紫外分光光度计(上海美谱达仪器有限公司);AE240S型分析天平 (梅特勒-托利多有限公司);DK-98-ⅡA型水浴锅(天津市泰斯特仪器有限公司);80-2型台式低速离心机 (上海医疗器械 (集团)有限公司);HE83型水分测定仪(梅特勒-托利多仪器(上海)有限公司)。
1.2 试剂
对照品:D-无水葡萄糖 (批号:110833-201908,中国食品药品检定研究院,分子式:C6H12O6,纯度:99.9%,CAS:50-99-7);分析纯试剂:浓硫酸(批号:180922,西陇化工股份有限公司)、苯酚 (批号:20161018,西陇化工股份有限公司)、无水乙醇(批号:20200104,国药集团化学试剂有限公司)。
1.3 药材
太子参药材购自福建柘荣。
1.4 实验方法
1.4.1 分段式变温干燥实验
取预处理后的新鲜太子参药材5 kg,平均分为5组,每组平均分为3份,每份0.5 kg。5组分别放置于实验前热风循环烘箱调整到需要的温度(35、40、45、50、55°C),并让烘箱空载运行1 h以上,使实验用的烘箱的温度稳定在实验所需的温度。为保证受热情况一致,只铺一层,药材均匀平铺于不锈钢网上后置于烘箱内,平铺厚度为0.9 cm左右,期间不需翻动,每隔1 h取出样品测量其质量,每次测量时间不超过40 s。烘至前后两次样品重量差接近时,分别升高温度为45、50、55、60、65°C,烘至药材含水量≤14%即可。
1.4.2 干基含水率及干燥速率的测定
样品的含水量占该样品不含水部分的百分率称为干基含水率(g/g),计算方法为干基含水率=100%·(m-n)/n(样品质量 mg,烘后质量 ng)。
干燥速率即单位时间内蒸发的水分含量,计算公式为 Vt=(Mt-Mt-1)/△t, 式中 Vt为 t时刻样品干燥速率(g·g-1·h-1),Mt、Mt-1 分别为 t、t-1 时刻时样品的干基含水率(g/g),△t为时间间隔(h)。
1.4.3 外观品相的测定
按文献方法[9],对不同温度下干燥后太子参进行外观品相评分。
1.4.4 水分及多糖含量测定
采用2020版《中国药典》一部通则0832(第二法)中的方法测定水分含量;按文献方法[10],测定多糖含量。
1.4.4.1标准曲线的绘制
精密称取D-无水葡萄糖16.37 mg,加水溶解并定容至200 mL容量瓶中,混匀,得浓度为81.85μg/mL的对照品储备液。分别精密吸取对照品储备液3.0、4.0、5.0、6.0、7.0、8.0、9.0 mL 置于 10 mL 容量瓶中,加水定容至刻度线,得葡萄糖浓度为24.56、32.74、40.93、49.11、57.30、65.48、73.67 μg/mL 的系列标准溶液。分别精密吸取各对照品溶液l mL,置10 mL具塞试管中,精密加入5%苯酚溶液l mL,摇匀;迅速加入硫酸溶液5 mL,摇匀。置沸水浴中加热20 min,取出,置冰浴中冷却5 min。于486 nm以试剂空白为参比测定吸光度。以葡萄糖浓度(μg/mL)为横坐标,吸光度为纵坐标,绘制标准曲线。
1.4.4.2供试品溶液的制备
取本品粉末(过三号筛)约1.000 g,置于索氏提取器中,精密称定,加入90%乙醇100 mL,95℃水浴加热3 h,弃去乙醇溶液,药渣挥干乙醇。药渣连同纸筒置于圆底烧瓶中,准确加入100 mL蒸馏水,称重;100℃水浴加热回流提取2 h,冷却至室温,加水补重,混匀,离心(转速为每分钟4000转)15 min。精密量取上清液2 mL,置15 mL离心管中,精密加入无水乙醇10 mL,摇匀,冷藏1 h,取出,离心(转速为每分钟4000转)20 min,弃去上清液,(必要时滤过),沉淀加80%乙醇洗涤2次,每次8 ml,离心,弃去上清液,沉淀加热水溶解,转移至100 mL量瓶中,放冷,加水至刻度,摇匀,即得供试品溶液。
1.4.4.3多糖含量的测定
精密量取供试品样品溶液各1 mL,分别置10 mL具塞试管中,照标准曲线制备项下的方法,自“精密加入5%苯酚溶液l mL”起,依法测定吸光度,从标准曲线上读出供试品溶液中含葡萄糖的重量,计算,即得(多糖含量以无水葡萄糖计)。实验重复3次。
1.4.5 分段式变温干燥工艺的优选
采用综合评分法[11]优选分段式变温干燥工艺,以干燥速率、外观品相和多糖含量为评价指标,且干燥速率越高,外观品相评分越高,多糖含量越高则干燥工艺越好。在数据处理时引用指标隶属度,即指标隶属度=(指标值-指标最小值)/(指标最大值-指标最小值)。根据各指标对太子参药材的重要性,考虑以干燥速率占20%、外观品相占30%、多糖含量占50%的权重,实验综合评分=干燥速率隶属度×20%+外观品相隶属度×30%+多糖含量隶属度×50%,总分为1.00分。
2 结果
2.1 干燥温度对太子参干燥速率的影响
图1(a)显示了太子参分段变温干燥曲线,相同时间下,温度越高,干燥时间越短;不同温度下,随着时间的增加,太子参的干基含水率逐渐下降;升温前太子参的干基含水率随时间的增加而降低缓慢,升温后干基含水率下降速度较升温前有所增加,而后随着干燥时间的增加,干基含水率下降速度减慢。图1(b)显示了在分阶段变温干燥条件下,提高温度,可增大太子参干燥速率,从而使太子参干燥速率可以在相当长含水率范围维持高位。这是因为温度升高,物料内部水分驱动力增大,加快水分溢出,增快干燥速率。

图1 干燥特性曲线
2.2 干燥温度对太子参外观品相的影响
对不同温度干燥后的太子参进行颜色、表面皱缩程度、断面质地、断面颜色对比分析,结果见表1,外观品相最好的为 45°C8 h-55°C12 h 烘干及 50°C6 h-60°C10 h烘干,评分均为16分;外观品相最差的是55°C5 h-65°C7 h,评分为 14 分;断面颜色和干燥温度基本无关,温度对太子参表面颜色、表面皱缩程度及断面质地影响较大,温度越高,表面颜色越深,皱缩程度越大,断面质地越好。

表1 不同温度干燥太子参外观品相评分表
2.3 干燥温度对太子参水分及多糖含量的影响
2.3.1 标准曲线及回归方程的建立
如图2所示,以吸光值对葡萄糖浓度进行线性回归,得到回归方程:y=0.009x+0.0026(24.56~73.67 μg/mL,R2=0.9993);表明方程的线性非常好。
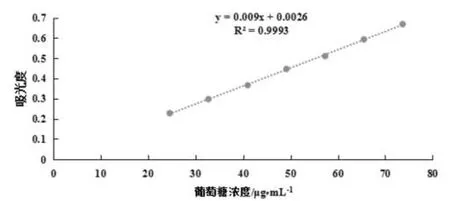
图2 葡萄糖标准曲线
2.3.2 重复性试验
精密称取同一太子参样品,按 “1.4.4.1”和“1.4.4.2”项下方法,重复测定6次,从标准曲线上读出供试品溶液中含葡萄糖的量,计算RSD为2.1%,表明该方法重复性良好。
2.3.3 稳定性试验
精密量取同一太子参样品溶液,按标准曲线项下方法显色,分别在 0、10、20、30、40、50、60、120 min 时测定吸光度,实验重复6次,计算得RSD为1.9%,表明样品溶液在2 h内非常稳定。
2.3.4 加样回收率试验
精密称取同一太子参样品约1.000 g,按“1.4.4.1”项下方法制备供试品溶液6份,各取1 mL,分别置6个10 mL具塞试管中,精密加入对照品溶液1.0 mL,照标准曲线制备项下的方法,自“精密加入5%苯酚溶液l mL”起,依法测定吸光度,从标准曲线上读出供试品溶液中含葡萄糖的重量,回收率分别为96.55%、97.38%、99.21%、97.30%、96.32%、96.98%。样品平均回收率为97.29%,RSD为1.06%,表明本法准确可行。
2.3.5 水分及多糖含量的测定
如表2所示不同温度干燥后,太子参药材水分含量在12.62%~13.76%之间,均符合2020年版中国药典不超过 14.0%的规定,55°C5 h-65°C7 h烘干样品的水分含量最低,为12.62%;水分含量与温度高低呈负相关趋势。不同温度干燥后,多糖含量在12.19%~16.12%之间,多糖含量最高的干燥工艺为45°C8 h-55°C12 h,含量为 16.12%;而 35°C12 h-45°C25 h、40°C8 h-50°C22 h、50°C6 h-60°C10 h、55°C5 h-65°C7 h干燥样品多糖含量差异不显著,含量分别为12.62%、12.91%、13.50%、12.19%;其中,55°C5 h-65°C7 h 干燥样品多糖含量最低。
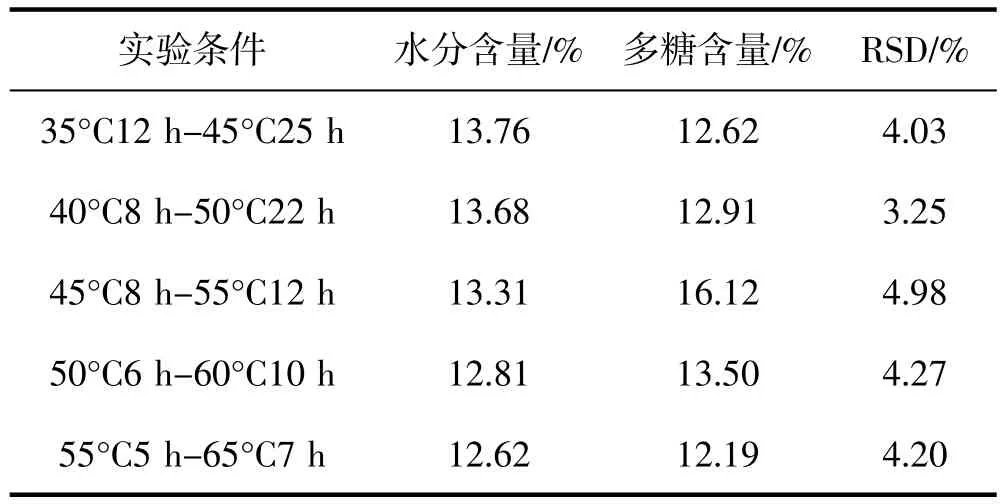
表2 不同温度干燥太子参样品水分及多糖含量测定结果
2.4 分段式变温干燥工艺的优选
对不同温度干燥后太子参样品进行综合评价,结果如表3所示,太子参不同温度干燥工艺的综合评分差异较大,综合评分最高的是45°C8 h-55°C12 h烘干样品,其综合评分为0.885,综合评分最低的是55°C5 h-65°C7 h烘干样品,其综合评分为0.2。
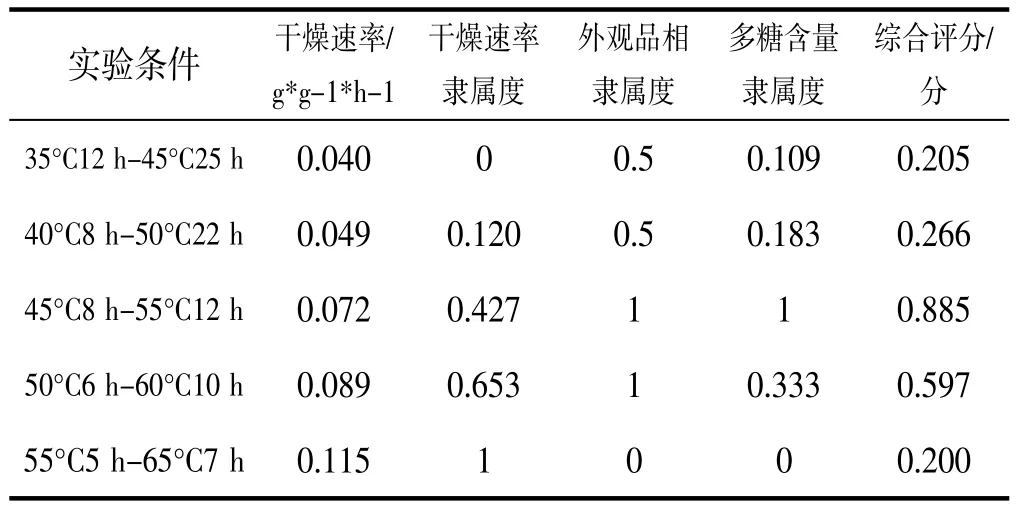
表3 综合评分
3 讨论
太子参电热干燥过程中,温度对干燥时间和药材质量有重要影响。试验条件下,35°C12 h-45°C25 h干燥表面皱缩程度小,但干燥时间长;55°C5 h-65°C7 h干燥时间缩短,但表面皱缩程度大,多糖含量低。
本次实验所用新鲜太子参的直径范围为0.3~0.7 cm,直径平均值为0.425 cm,干燥后直径平均值为0.381 cm,根据太子参等级规格划分为小统,其最佳干燥工艺参数为45°C8 h-55°C12 h。由于太子参药材大小的差异,干燥温度和时间不尽相同。结合本课题组前期研究,太子参药材规格为中统时,其最佳工艺参数为 50°C6 h-55°C15 h;规格为大统时,其最佳干燥工艺参数为 50°C6 h-55°C18 h。
