蛋黄磷脂与大豆磷脂调节失血应激性糖脂紊乱作用比较
2020-12-22尹明雨刘启军张宗毅唐史杰松冈亮辅奚印慈王锡昌
尹明雨,刘启军,张宗毅,唐史杰,松冈亮辅,奚印慈,王锡昌*
1(上海海洋大学 食品学院,上海,201306) 2(上海海洋大学,食品科学技术研究室,上海,201306)
磷脂是生物体膜和细胞膜中的主要成分,对于细胞内外物质进出与代谢物的排泄等生理过程起着至关重要的作用[1]。磷脂在促进神经信号传导、提高大脑活力、延缓机体衰老、防止血管硬化和抗血栓等方面都有显著作用,故其被誉为“脑金”、“血管清道夫”[2]。卵磷脂还可以强化胆汁胆固醇的排泄,参与调节脂蛋白代谢的转录因子和酶的表达及活性,其具有特殊的溶解性,可将血管壁上黏连的总胆固醇乳化成微粒,进而机体或者组织将胆固醇乳化成更容易分解的微粒[3-4]。
磷脂进入生物体之后,可以经各种磷脂酶作用水解成甘油、脂肪酸、磷酸和各种氨基醇等[5]。大量研究表明磷脂酰胆碱具有兴奋大脑神经细胞、强化大脑神经突触迅速发达的效能,且对于改善认知功能障碍方面有显著的作用。SHI等[6-7]研究发现海洋磷脂能够显著改善由顺铂、万古霉素引起的肾毒性,降低线粒体损伤以及细胞凋亡情况。目前大量的研究工作集中在磷脂生物活性以及乳化特性等方面,但是关于磷脂进入生物体后的对创伤性失血引起的应激性高血糖与糖脂代谢紊乱影响的研究相对较少。
因此,本研究通过构建失血创伤模型,分析并比较蛋黄磷脂(egg yolk phospholipid,EPLs)和大豆磷脂(soybean phospholipid,SPLs)在24 h断续采血过程调节机体糖脂代谢特点,进一步比较EPLs与SPLs消化吸收特性以及两者之间的差异。本研究可为后续磷脂类保健品以及生物活性探究实验提供重要的数据基础,为磷脂代谢功能特性的进一步揭示提供理论依据。
1 材料与方法
1.1 药品与试剂
蛋黄卵磷脂(EPLs),日本丘比株式会社;大豆卵磷脂(SPLs),日本富士和光株式会社;酪蛋白、β-玉米淀粉、纤维素、混合矿物质、混合维生素,日本Oriental酵母工业株式会社;蔗糖,日本和田制糖株式会社;玉米油,日本J-Oil Mills株式会社。
主要试剂:37 种脂肪酸甲酯标准品、十九烷酸及十九烷酸甲酯标准品,上海安谱科技股份有限公司;正己烷、三氟化硼-甲醇,色谱级;三氯甲烷、甲醇、MgCl2、NaOH、、硼酸、盐酸、浓H2SO4、石油醚(30~60 ℃)等均为分析纯。
1.2 实验动物与饲料
15只SD大鼠(3周龄、雄性、45~55 g、SPF级),上海捷斯捷生物有限公司。将大鼠分别单独饲养于塑料笼具中,饲养环境为温度(23±2)℃、相对湿度(50±10)%、明暗周期12 h(明期为8∶00 AM~8∶00 PM)。饲料及水均为自由摄取,笼具及垫料定期清洗更换,适应性喂养6周。
1.3 仪器与设备
H01-B电子天平,北京和田兴业仪器有限公司;RACE GC ULTRA气相色谱仪,美国Thermo Fisher 公司;HWS-24电热恒温水浴锅,上海恒科学仪器有限公司;旋转蒸发仪,德国 IKA集团;FJ200-SH数显高速分散均质机,上海标本模型厂;DW-40L508超低温冰箱、4 ℃冰箱,艾本德(上海)国际贸易有限公司;H2050R高速冷冻离心机,长沙湘仪有限公司。
1.4 磷脂脂肪酸
总脂的提取:分别称取EPLs和SPLs 0.5 g于烧杯中,按FOLCH 等[8]提取方法得到总脂。脂肪酸组成分析[9]:称取提取的脂肪0.1 g(精确到0.001 g),加入5 mL 0.5 mol/L NaOH-甲醇溶液和100 μL 10 mg/mL 十九烷酸内标储备液,轻轻振摇溶解,混合均匀。接入冷凝回流装置,打开冷凝水,在100 ℃水浴中煮沸冷凝回流振摇10 min,直至烧瓶内油滴消失;再加入3 mL 14%三氟化硼甲醇溶液,100 ℃冷凝回流5 min;加入2 mL 正己烷,100 ℃冷凝回流2 min;然后将烧瓶从水浴中取出,关掉冷凝水,待冷凝管中无液滴滴下时取下冷凝回流装置,迅速加入10 mL 饱和NaCl 溶液,充分振荡,分层澄清后吸取上清液,用0.22 μm 有机相滤膜过滤于进样瓶,待气相色谱分析。
气相色谱条件:色谱柱为Agilent SP-2560 毛细管柱(100 m×0.25 mm,0.2 μm),升温程序起始70 ℃,以50 ℃/min 升至140 ℃保持1 min,4 ℃/min 升至180 ℃,保持1 min,3 ℃/min 升至225 ℃,保持30 min;进样口温度260 ℃;进样量1 μL,分流比45∶1,柱流量1 mL/min,载气为N2。
定性定量分析:采用37 种脂肪酸甲酯混合标准品与样品对比保留时间进行定性分析,内标法定量分析。
1.5 实验动物分组设计
15只雄性 SD 大鼠使用商业饲料适应喂养6周,将其随机分为3组,即对照组、卵黄组、大豆组,每组5只。实验过程中按照油重比(1 g/kg)进行灌胃:对照组灌胃玉米油,卵黄组灌胃80%玉米油+20% EPLs,大豆组灌胃玉米油80%+20% SPLs。
灌胃前进行体重称量和尾部采血,之后1、2、4、6、12和24 h再次进行采血称重。每次采血后都对采血处进行消毒处理。实验具体步骤见图1。
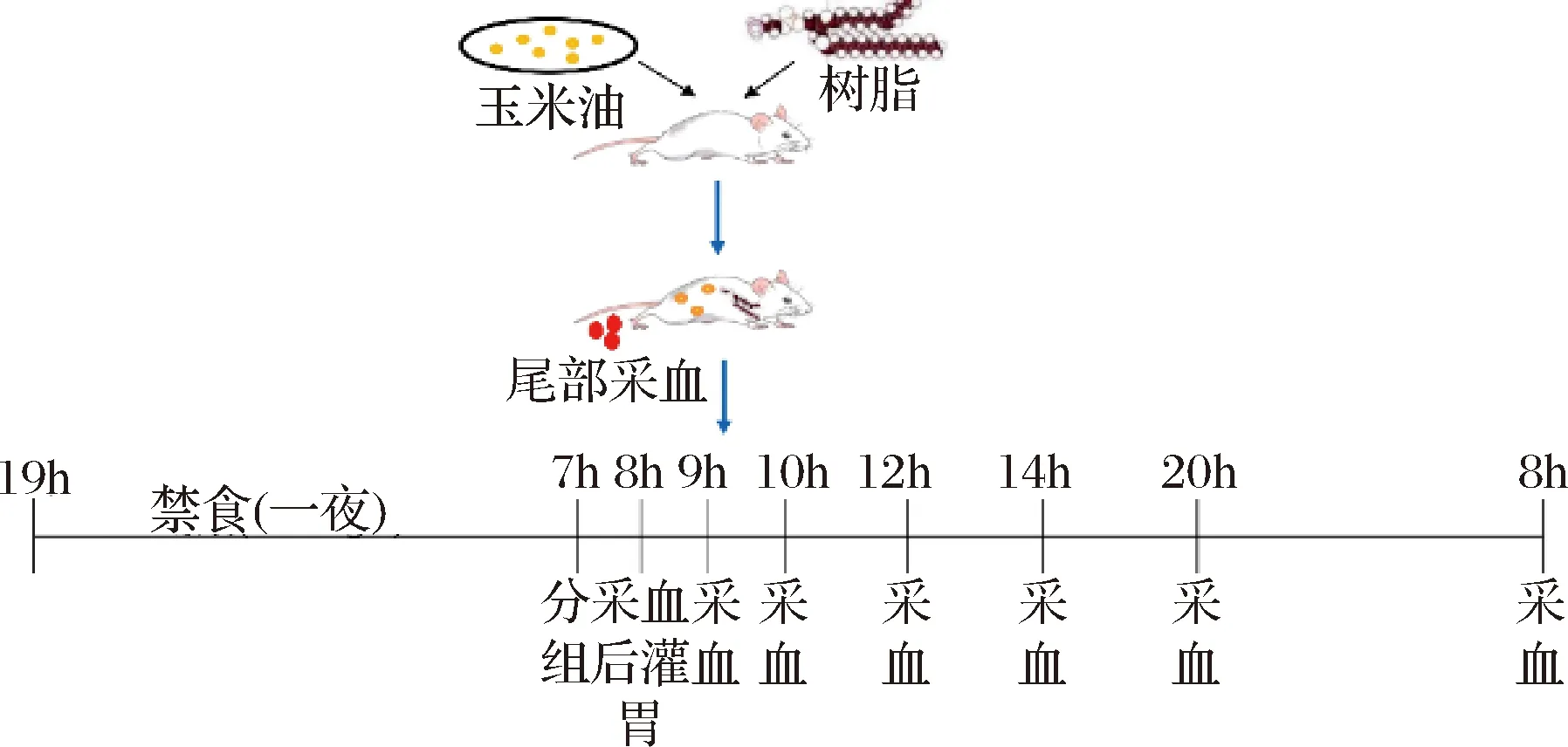
图1 实验示意图Fig.1 Experimental schematic
1.6 SD大鼠喝水量与体质量的测定
试验期间观察大鼠的进食、排泄以及活动状况,每次采血前称量1次体质量和鼠喝水瓶质量并记录。
1.7 SD大鼠血糖水平测定
每次采完血,取1滴血样滴入血糖仪测定鼠血糖情况,待仪器数值稳定后,读取数值并记录。
1.8 SD大鼠血清中磷脂水平测定
大鼠尾部取血,采得血液于1.5 mL离心管静置30 min后,采用4 ℃,1 500×g离心15 min,取上清液于-80 ℃留存待测。使用鼠用磷脂含量检测试剂盒测定血清中磷脂含量。
1.9 数据统计分析
采用SPSS 19.0软件进行统计分析,方差分析采用ANOVA分析,数据进行正态分布检验,符合正态分布的多重比较采用Duncan法,不符合正态分布的采用Kruskal-Wallis检验,P<0.05,差异显著。作图采用软件Prism 6.0软件(GraphPad)绘制,数据以Mean±SD表示。
2 结果与分析
2.1 磷脂主要脂肪酸组成
EPLs与SPLs为动物源与植物源磷脂典型代表。研究表明,膳食n-3多不饱和脂肪酸以及多不饱和脂肪酸(polyunsaturated fatty acid,PUFA)可以改善神经元发育,调节脂质代谢紊乱等生理活性[10]。由表1可知,2种磷脂脂肪酸组成成分较相似,但EPLs所含脂肪酸种类更为丰富,并且具有特殊功能活性的二十二碳六烯酸(docosahexaenoic acid,DHA)。EPLs中C16∶0、C18∶0 和C18∶1 N9C的含量显著高于SPLs(P<0.05)。C18∶2 N6C在SPLs中的含量极显著高于EPLs(P<0.01)。大量关于动物源磷脂成分检测结果与本文结果相似,CHE等[11]发现海参与鱿鱼卵的磷脂脂肪酸中PUFA含量与改善认知能力和对肾脏毒性存在关联。WEN 等[12]研究结果表明,磷脂能够通过抑制细胞凋亡与线粒体损伤改善机体氧化应激状态。周盛敏等[13]发现不饱和中链脂肪酸可以通过上调肝脏内基因蛋白过氧化物酶体增殖物,激活受体α和长链酰基辅酶A脱氢酶表达,从而有效降低小鼠的体重,改善小鼠的脂质代谢和肝脏甘油三酯水平,进而调节脂质代谢状态。EPLs和SPLs中不饱和脂肪酸丰富,具有调节脂质代谢紊乱得潜能,与血糖与磷脂代谢关系密切。
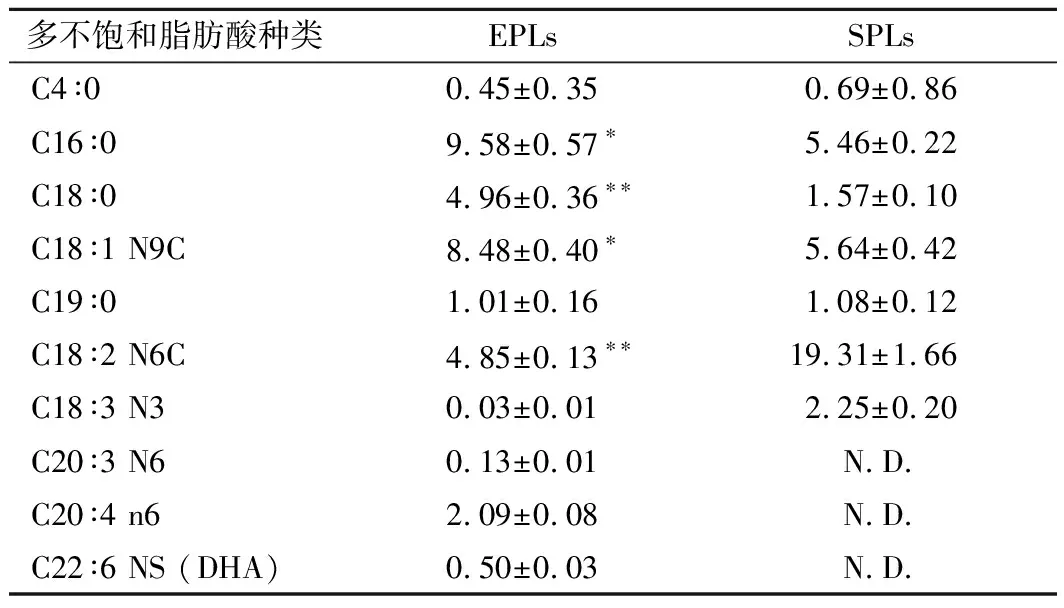
表1 蛋黄磷脂和大豆磷脂主要脂肪酸组成 单位:mg/g
2.2 体质量变化情况
由图2可知,在24 h的采血实验过程中,体质量逐渐降低。在0~6 h间断采血过程中,对照组体质量下降速度最大,卵黄组体质量下降速度最低。可见磷脂干预具有改善体重下降的趋势。24 h,卵黄组体质量(418.9±6.7)g显著高于对照组(410.6±27.1)g和大豆组(410.5±27.1)g。EPLs改善体质量变化能力优于SPLs。多次采血使SD大鼠出现口干乏力、食欲不振等症状,这种结果使体质量快速下降,补充磷脂后,可能是磷脂消化代谢促进能量的代谢,刺激机体能量的补充,也可能磷脂作为一种膳食油脂激发大鼠的食欲。DALMAZZO等[14]研究结果表明,由高脂饮食带来的体质量快速增长中,EPLs效果优于SPLs,本文结果与其较为一致。
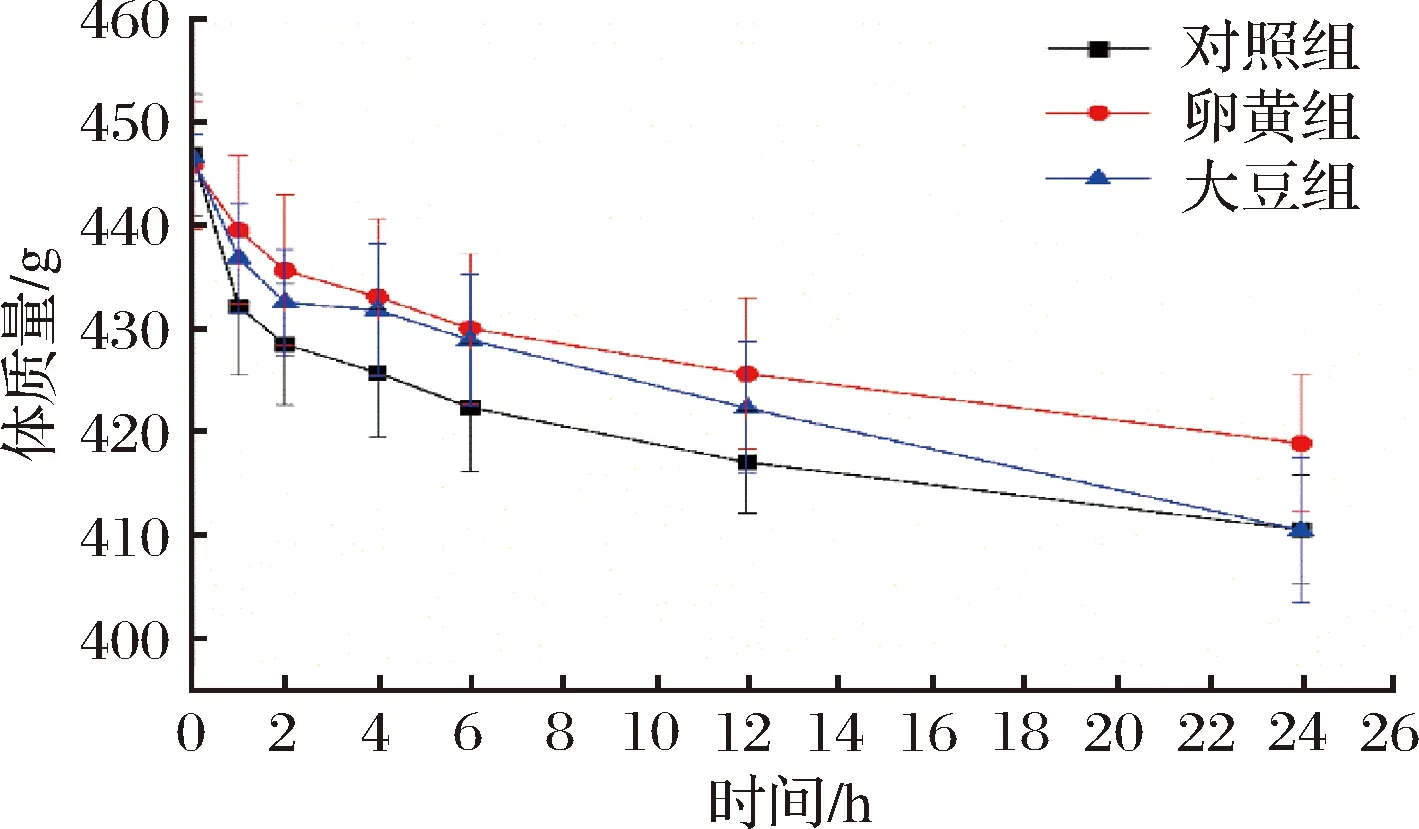
图2 SD大鼠体质量变化Fig.2 Change of body mass SD rats
2.3 喝水量变化情况
由图3可知,随着采血次数的增加,刺激机体对水的摄入。喝水总量的总体趋势是增加的,0~4 h期间,EPLs补充提高机体饮水量,SPLs也有相同趋势。对照组在0~6 h内饮水量显著下降,由此可知,磷脂干预能够改善机体由失血引起得体液缺失,刺激机体饮水。6 h后,对照组喝水量增速显著高于卵黄组和大豆组(P<0.05)。但喝水不能解决根本性的问题,要补充血容量、输血补液[15],即补充电解质、维持外周循环血量。后续血容量与电解质研究也非常值得关注。
2.4 血糖变化情况
血糖来源主要有2种:食物中的糖类、蛋白质和脂肪;自身存储的肝糖原和肌糖原[16]。机体失血后大多处于紊乱的糖脂代谢状态,首先由于创伤所导致机体代谢状态增加,以尽快修复损伤,恢复正常状态。另一方面又会出现应激性的血糖紊乱状态,使能量代谢过程存在障碍[17-18]。应激状态下机体血糖会大量分解提供热量和功能。
由图4可知,对照组血糖在整个过程中呈现先降低再升高最后恢复平稳的趋势,卵黄组与之相似。大豆组血糖含量先升高再降低最后恢复平稳(P<0.05)。卵黄组血糖恢复平稳时间最短,EPLs对于由创伤引起的应激高血糖状态具有良好的平复作用,SPLs没有显著效果。机体受到创伤后,可能是由于磷脂参与脂质代谢部分转化成血糖,避免血糖含量异常变化,造成机体代谢异常紊乱。
2.5 磷脂变化情况
人体出现严重创伤而且血液大量丢失之后,损伤伴随不同程度感染或应激[19]会出现血容量降低与缺血缺氧状态[20],导致血液中TNF-α、IL-1、IL-6相关炎性因子出现继发性的增高[21-24],进而出现应激性高血糖状态与脂质代谢紊乱[25-27]。磷脂是细胞膜的重要组成成分,参与体细胞的形成与脂肪酸消化吸收,对正常生理功能至关重要[17,28-29]。由图5可知,在0~1 h期间对照组磷脂含量急剧下降,而卵黄组和大豆组因外源添加磷脂,改善了磷脂含量的降低。1 h 后,磷脂含量出现上升再恢复正常的状态。与对照组和大豆组相比,卵黄组磷脂含量在6 h达到最大值(P<0.01)。大豆组磷脂含量变化波动平缓。这可能是因为血糖代谢异常,磷脂通过脂质代谢避免血糖含量的异常变化对机体产生应激与损伤,因此出现先升高再降低的变化趋势。创伤性失血后,SPLs能控制血清中磷脂含量稳定,磷脂代谢相对稳定,缓解应激性紊乱造成的损伤。
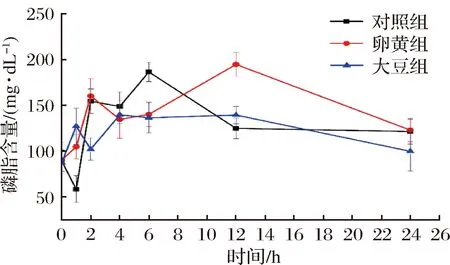
图5 SD大鼠血清中磷脂变化情况Fig.5 Changes of phospholipids in serum of SD rats
3 结论
本研究结果显示,外源蛋黄和大豆磷脂干预,显著改善应激性失血引起的血糖以及磷脂紊乱,抑制体质量快速下降。但是由于本研究条件所限,对于具体的糖脂代谢酶以及氧化应激状态并未监测,后期会继续深入研究, 对本研究的结果进行深入验证。
综上所述,创伤失血后糖脂代谢出现紊乱,机体体质量与饮食均会出现异常。如果在早期使用磷脂,能够改善损害状态,帮助机体恢复正常状态。磷脂在改善由失血引起得糖脂代谢紊乱具有潜在的治疗作用。
