三七重楼生化汤对成纤维细胞功能的影响及机制研究
2020-12-22俞蕾媛盛少琴潘弘毅刘佳俐范梦梦潘鸿燕
俞蕾媛 盛少琴 潘弘毅 刘佳俐 范梦梦 潘鸿燕
1.浙江中医药大学第二临床医学院 杭州 310053 2.浙江中医药大学附属第二医院 3.浙江中医药大学第三临床医学院 4.云和县中医院
剖宫产后瘢痕缺损(previous cesarean scar defect,PCSD)是指剖宫产切口愈合不良,形成缺损。再次妊娠时,若孕囊种植于缺损处,则可导致大出血、子宫破裂,甚至孕产妇死亡[1]。目前临床上尚缺乏治疗PCSD的可靠方法,因此如何有效防治疗PCSD成为临床迫切需要解决的难点。剖宫产术后子宫切口愈合是一个多细胞参与的复杂过程,由于平滑肌组织再生能力较弱,大部分愈合以纤维性修复为主。创伤愈合早期,富含毛细血管的肉芽组织可在短时间内填补创面,维持组织器官完整性,同时可以预防感染,其形成有赖于成纤维细胞的迁移、黏附、增殖及愈合相关蛋白的分泌[2-3]。因此,促进成纤维细胞的迁移、黏附、增殖及愈合相关蛋白的分泌,将有助于促进子宫切口愈合。
中医认为本病多由血瘀所致,兼夹气血亏虚,治疗当以益气养血、化瘀生新为主,辅以清热解毒。三七重楼生化汤(Sanqi Chonglou Shenghua Decoction,SCD)为我科经验方,该方由生化汤加味而成,具有抗炎抑菌、化瘀生新之效,可改善机体的血液循环状态,促进创面的愈合。临床研究已证实,该方对剖宫产术后子宫切口愈合不良、恶露不绝、子宫复旧不良等均有良好疗效[4-5]。但作为中药复方方剂,其药效机制尚不明确。故本研究拟体外培养小鼠成纤维细胞,探讨SCD对成纤维细胞功能及对细胞因子分泌的影响,为临床药理研究提供理论依据。
1 材料和方法
1.1 细胞 小鼠成纤维细胞系L929由浙江中医药大学附属第二医院中心实验室馈赠。选择含10%胎牛血清、100U·mL-1青霉素、100mg·L-1链霉素的杜氏改良伊格尔培养基(dulbecco's modified eagle medium,DMEM),于37℃、5% CO2恒温培养箱中培养。定期观察细胞生长情况,每2d换液一次。
1.2 主要药品与试剂 SCD组方包括三七3g、重楼3g、当归20g、桃仁10g、川芎10g、益母草30g、黄芪10g、生姜6g、甘草6g,药物由浙江中医药大学附属第二医院药剂科提供。以上药物以去离子水常规煎煮2次,浓缩后过滤除菌、分装,-20℃保存备用。前期研究中采用细胞增殖检测实验筛选出SCD最佳浓度,分为低、中、高3个浓度梯度,分别为1.25、2.5、5mg·mL-1。DMEM高糖培养基、胰酶、胎牛血清均购于美国Gibco公司(批号:C11995500BT、25200056、10091-141);磷酸缓冲盐溶液(phosphate buffer saline,PBS)、青霉素链霉素溶液均购于杭州诺森德生物技术有限公司(批号:C10010、C15140);β-肌动蛋白(β-actin)小鼠单克隆抗体、转化生长因子-β1(transforming growth factor-β1,TGF-β1)兔多克隆抗体、血管内皮生长因子-A(vascular endothelial growth factor-A,VEGF-A)兔单克隆抗体、细胞外调节蛋白激酶1/2(extracellular regulated protein kinases 1/2,ERK1/2)兔多克隆抗体、磷酸化细胞外调节蛋白激酶1/2(phospho-extracellular regulated protein kinases 1/2,p-ERK1/2)兔多克隆抗体、山羊抗兔二抗(goat anti rabbit IgG)、山羊抗小鼠二抗(goat anti mouse IgG)均购于美国Abcam公司 (批号:ab8226、ab179695、ab52917、ab17942、ab47339、ab205 718、ab205719); 二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量试剂盒购于碧云天生物技术有限公司(批号:P0012);细胞增殖检测试剂盒(cell counting kit-8,CCK-8)购于日本东仁公司(批号:CK04)。
1.3 主要仪器 CO2细胞培养箱、生物安全柜为美国Thermo Fisher公司产品;倒置显微镜购于日本Olympus公司;实时无标记细胞分析仪购于美国ACEA公司;酶标仪购于美国BioTek公司;电泳仪为美国Bio-Rad公司产品;凝胶成像仪购于美国Protein Simple公司。
1.4 细胞增殖检测
1.4.1 实时细胞分析技术(real time cellular analysis,RTCA) 在96孔电子培养板中加入培养基获取基线数据,取对数生长期的L929细胞,按5×103个/孔细胞数接种于96孔培养板中,室温静置30min后置于RTCA仪上,37℃、5% CO2条件下连续监测24h。吸出原培养基,分别予低、中、高浓度SCD(1.25、2.5、5mg·mL-1),对照组予等体积培养基,继续监测24h,获取细胞指数(cell index,CI)。
1.4.2 CCK-8法 取对数生长期的L929细胞,按5×103个/孔细胞数接种于96孔板中,37℃、5% CO2孵育24h。吸出原培养基,分别予低、中、高浓度SCD(1.25、2.5、5mg·mL-1),对照组予等体积培养基,继续培养24h。更换培养基,每孔加入10μL的CCK-8试剂,37℃孵育2h,酶标仪测定450nm处的吸光度(optical density,OD)。
1.5 细胞黏附检测
1.5.1 RTCA 96孔电子培养板中加入培养基获取基线数据,取对数生长期的L929细胞,按2×104个/孔细胞数接种于培养板中,同时予低、中、高浓度SCD(1.25、2.5、5mg·mL-1),对照组予等体积培养基,37℃、5% CO2条件下连续监测5h获取CI。
1.5.2 CCK-8法 取对数生长期的L929细胞,按2×104个/孔细胞数接种于培养板中,同时加入低、中、高浓度SCD(1.25、2.5、5mg·mL-1),对照组予等体积培养基,37℃、5% CO2孵育5h后更换培养基,每孔加入10μL的CCK-8试剂,37℃孵育2h,酶标仪测定450nm的OD。
1.6 细胞迁移检测 采用划痕实验检测细胞迁移。取对数生长期的L929细胞,按2×105个/孔细胞数接种于6孔板中,37℃、5% CO2条件下培养24h,以200μL移液器吸头在培养板孔内划线,PBS洗涤3次,更换为含0.5%血清的培养基并加入低、中、高浓度(1.25、2.5、5mg·mL-1)SCD,对照组予等体积培养基,分别于12、24、36h拍照记录细胞迁移情况,以Image J图像处理软件进行定量分析。
1.7 Western blot检测愈合相关蛋白表达 取对数生长期的L929细胞,按3×105个/孔细胞数接种于6孔板中,培养24h后分别用低、中、高浓度SCD(1.25、2.5、5mg·mL-1)干预,对照组予等体积培养基。37℃、5% CO2培养24h后吸出培养基,PBS洗涤3次,加入放射免疫沉淀法缓冲液(radioimmunoprecipitation assay buffer,RIPA)后在冰上充分裂解。4℃下12 000r/min离心10min,收集上清液,BCA法测定总蛋白浓度。聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分离后,转至聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF),室温封闭2h,加入一抗4℃孵育过夜。次日,加入二抗室温孵育2h,洗膜后电化学发光(electrochemiluminescence,ECL)试剂显色。以β-actin为内参,对蛋白质条带的灰度进行半定量分析。
1.8 统计学分析 应用SPSS 22.0统计软件进行统计学分析。计量资料以±s表示,两组间比较采用非配对双尾t检验;多组间比较采用单因素方差分析,方差齐时进一步两两比较采用最小显著差异(least significant difference,LSD)法,方差不齐时采用Dunnett法。以P<0.05为差异有统计学意义。
2 结果
2.1 各组细胞增殖比较 CCK-8结果示:与对照组比较,SCD各浓度组L929细胞增殖能力显著提升(P<0.01)。与低浓度组比较,中、高浓度组促增殖作用更显著(P<0.01)。与中浓度组比较,高浓度组促增殖作用更显著(P<0.05)。见图1A。
RTCA结果示:SCD干预后CI在短暂下降后上升。干预30h,与对照组比较,SCD低浓度组CI显著增高(P<0.01)。干预36h,各组CI差异无统计学意义(P>0.05)。干预42h,与对照组、SCD低浓度组比较,中、高浓度组CI显著增高(P<0.01),但中、高浓度组间差异无统计学意义(P>0.05)。干预48h,与对照组比较,SCD中、高浓度组CI显著增高(P<0.01),但中、高浓度组间差异无统计学意义(P>0.05);与低浓度组比较,高浓度组CI显著增高(P<0.05)。见图1B、表1。
2.2 各组细胞黏附比较 CCK-8结果提示,与对照组比较,SCD各浓度组L929细胞黏附能力显著提高(P<0.01),但各浓度组间差异无统计学意义(P>0.05)。见图2A。
RTCA结果提示,与对照组比较,干预各时点SCD各浓度组L929细胞黏附能力显著提高(P<0.01),但各浓度组间差异无统计学意义(P>0.05)。见图2B、表2。
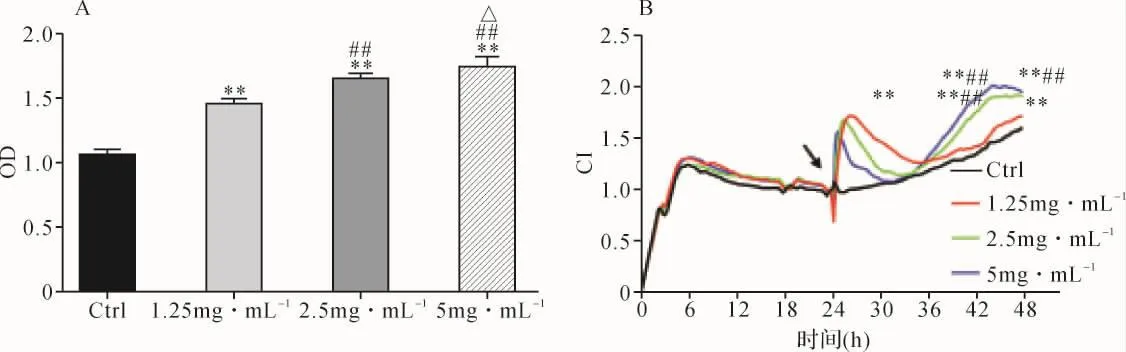
图1 各组细胞增殖比较Fig.1 Comparison of cell proliferation in each group
表1 RTCA各时间点各组细胞增殖比较(±s,n=3)Tab.1 Comparison of cell proliferation at different time points of RTCA(±s,n=3)
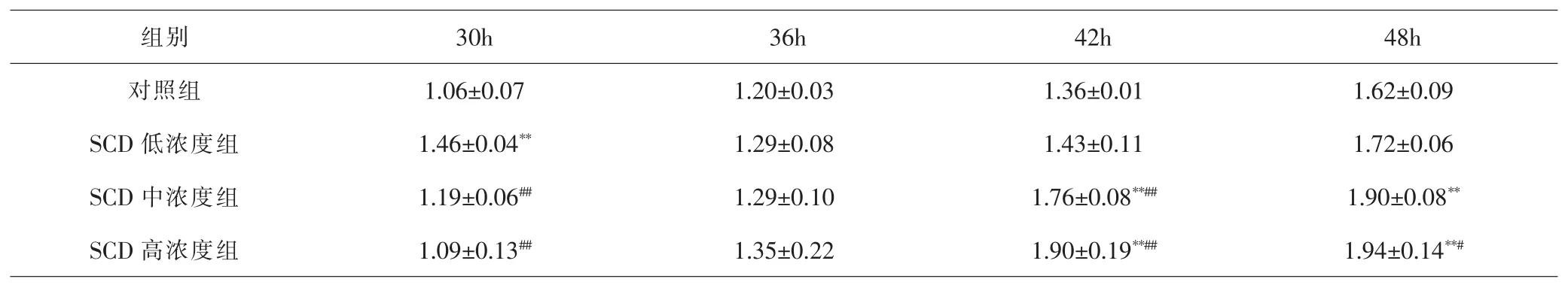
表1 RTCA各时间点各组细胞增殖比较(±s,n=3)Tab.1 Comparison of cell proliferation at different time points of RTCA(±s,n=3)
注:与对照组比较,**P<0.01;与SCD低浓度组比较,#P<0.05,##P<0.01Note:Compared with control group,**P<0.01;compared with SCD low dose group,#P<0.05;##P<0.01
组别 30h 36h 42h 48h对照组 1.06±0.07 1.20±0.03 1.36±0.01 1.62±0.09 SCD 低浓度组 1.46±0.04** 1.29±0.08 1.43±0.11 1.72±0.06 SCD 中浓度组 1.19±0.06## 1.29±0.10 1.76±0.08**## 1.90±0.08**SCD 高浓度组 1.09±0.13## 1.35±0.22 1.90±0.19**## 1.94±0.14**#
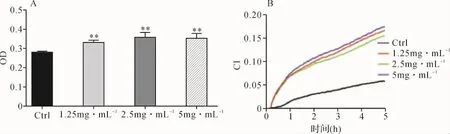
图2 各组细胞黏附比较Fig.2 Comparison of cell adhesion in each group
表2 RTCA各时间点各组细胞黏附比较(±s,n=3)Tab.2 Comparison of cell adhesion at different time points of RTCA(±s,n=3)
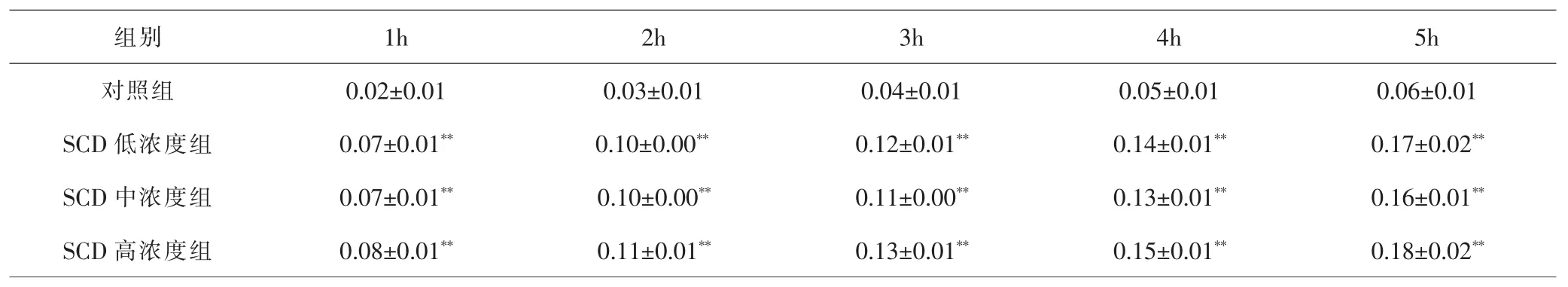
表2 RTCA各时间点各组细胞黏附比较(±s,n=3)Tab.2 Comparison of cell adhesion at different time points of RTCA(±s,n=3)
注:与对照组比较,**P<0.01Note:Compared with control group,**P<0.01
组别 1h 2h 3h 4h 5h对照组 0.02±0.01 0.03±0.01 0.04±0.01 0.05±0.01 0.06±0.01 SCD 低浓度组 0.07±0.01** 0.10±0.00** 0.12±0.01** 0.14±0.01** 0.17±0.02**SCD 中浓度组 0.07±0.01** 0.10±0.00** 0.11±0.00** 0.13±0.01** 0.16±0.01**SCD 高浓度组 0.08±0.01** 0.11±0.01** 0.13±0.01** 0.15±0.01** 0.18±0.02**
2.3 各组细胞迁移比较 干预12h,各组划痕愈合百分比差异无统计学意义(P>0.05)。干预24h,与对照组比较,SCD中、高浓度组划痕愈合百分比显著增加(P<0.05,P<0.01);且与低、中浓度组比较,高浓度组愈合百分比增加更明显(P<0.01)。干预36h,与对照组比较,SCD各浓度组划痕愈合百分比均显著增加(P<0.05,P<0.01)。与低浓度组比较,SCD中、高浓度组划痕愈合百分比显著增加,差异有统计学意义(P<0.05,P<0.01)。与中浓度组比较,SCD高浓度组划痕愈合百分比显著增加,差异有统计学意义(P<0.01)。见图3、表3。
2.4 各组细胞VEGF、TGF-β1、ERK1/2、pERK1/2蛋白表达比较 各组细胞TGF-β1及ERK1/2表达差异无统计学意义(P>0.05)。与对照组比较,SCD中、低浓度组VEGF、p-ERK1/2的表达差异无统计学意义(P>0.05)。与对照组、SCD中、低浓度组比较,高浓度组VEGF、p-ERK1/2表达显著增加(P<0.01)。见图4。
3 讨论

图3 各组成纤维细胞迁移比较(40×)Fig.3 Comparison of fibroblasts migration in each group(40×)
表3 各组划痕愈合百分比(±s,n=3)Tab.3 Percentage of wound area in each group (±s,n=3)

表3 各组划痕愈合百分比(±s,n=3)Tab.3 Percentage of wound area in each group (±s,n=3)
注:与对照组比较,*P<0.05,**P<0.01;与SCD低浓度组比较,#P<0.05,##P<0.01;与SCD中浓度组比较,△△P<0.01Note:Compared with control group,*P<0.05,**P<0.01;compared with SCD low dose group,#P<0.05,##P<0.01;compared with SCD medium dose group,△△P<0.01
组别 12h 24h 36h对照组 13.46±2.50 22.56±1.06 31.89±2.05 SCD 低浓度组 13.57±1.37 25.27±2.47 39.06±4.27*SCD 中浓度组 14.82±2.12 26.05±2.11* 44.60±2.94**#SCD 高浓度组 16.03±2.43 39.32±1.32**##△△ 53.17±1.26**##△△

图4 各组细胞VEGF、TGF-β1、ERK1/2、pERK1/2蛋白表达比较Fig.4 Comparison of VEGF,TGF-β1,ERK1/2,pERK1/2 expression in each group
PCSD 是剖宫产术后的远期并发症之一,严重影响妇女的身体健康及生活质量,同时会对再次妊娠带来子宫破裂和憩室妊娠的巨大风险。目前临床上尚缺乏治疗PCSD的可靠方法,因此如何有效预防PCSD、促进子宫切口愈合成为临床上亟需解决的难题。与其他类型的创伤愈合同样,剖宫产术后子宫切口愈合也是一个复杂有序的生物学过程,涉及多种细胞和生长因子。目前认为,创伤愈合遵循三个基本阶段,即炎症阶段、增殖阶段和重塑阶段。成纤维细胞参与创伤愈合全过程,在细胞外基质(extracellular matrix,ECM)沉积与重塑、伤口收缩中发挥重要作用[6-7]。组织损伤时,成纤维细胞在炎症因子的介导下迁移到损伤部位并黏附于ECM上,增殖并合成分泌ECM和生长因子(VEGF、TGF-β1等)以促进伤口愈合,其生物学行为直接决定了组织修复的速度与质量。
中医认为创伤可致局部气血瘀滞、经络阻塞,故治疗首先需要祛瘀,否则“瘀血不去,新血不生”。“腐去肌生,肌平皮长”是创伤愈合的自然规律,故亦可予“去腐生肌”类药物治疗,加速坏死组织清除及肉芽组织生长[8]。三七重楼生化汤是我科自拟经验方,其中三七活血化瘀、和营止血,可以抑制受损组织释放自由基并能改善局部血液循环[9];重楼清热解毒、消肿止痛,具有抑菌、抗炎、抗氧化的功效[10]。临床研究证实该方对PCSD具有良好疗效,但其作用机制尚不明确。本研究选取小鼠成纤维细胞L929作为研究对象,通过CCK-8、RTCA检测细胞增殖及黏附,结果提示:SCD干预后L929细胞增殖呈动态变化,在最初6h内低浓度SCD能促进L929细胞增殖;干预12~24h中、高浓度能促进L929细胞增殖,且SCD浓度越高,促进增殖作用越明显。黏附实验结果表明,SCD具有促黏附作用,但不同浓度间差异无统计学意义。划痕实验结果显示,在最初12h各组细胞迁移差异无统计学意义;干预24h,中、高浓度SCD表现出促进迁移的作用,且高浓度促进作用更强;随着干预时间达到36h,低、中、高浓度SCD均具有促进迁移的作用,且SCD浓度越高,作用越显著。由此推测,SCD可以促进成纤维细胞增殖、迁移、黏附,且其作用具有一定时间与浓度依赖性。干预后短时间内,药物浓度间差异并不显著,而随时间推移,逐渐表现出浓度依赖性,这一发现对临床用药时间间隔、剂量选择具有指导意义。
VEGF是一种高度特异性的促血管内皮细胞生长因子,可刺激血管生成并增加血管通透性,在创伤愈合过程中有利于营养物质及代谢产物的运输,从而改善伤口局部微环境;其非血管作用包括激活成纤维细胞,促进胶原蛋白沉积[11-12]。TGF-β1具有强烈促伤口愈合作用,可通过经典的转化生长因子-SMAD(transforming growth factor-SMAD,TGF-SMAD) 蛋白途径促进成纤维细胞合成和胶原分泌,有助于减少创面面积;同时还可促进成纤维细胞增殖和向肌成纤维细胞分化,提高创面张力,加速伤口闭合[13-14]。本研究通过Western blot技术检测SCD干预后成纤维细胞VEGF、TGF-β1蛋白的表达,结果提示低、中、高浓度SCD均不影响TGF-β1蛋白表达;高浓度SCD可显著提高VEGF蛋白水平,而低、中浓度SCD促进VEGF分泌的功效不明显。上述结果提示SCD可能通过上调VEGF表达来改善成纤维细胞的血供和氧供状态,同时刺激成纤维细胞的增殖、黏附、迁移,从而促进剖宫产切口愈合。
丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)信号通路广泛参与细胞病理生理效应[15]。研究证实,MAPK信号通路特别是ERK1/2的活化,对组织损伤后应激反应至关重要[16-17]。包括VEGF在内的组织损伤相关因子可激活ERK1/2信号通路,并通过促进细胞定向迁移、黏附、增殖等发挥促进创面愈合的作用。本研究发现低、中浓度SCD均不改变ERK1/2蛋白磷酸化水平,而高浓度SCD干预后,成纤维细胞ERK1/2蛋白的磷酸化水平明显上调,该结果提示SCD激活的成纤维细胞增殖、迁移、黏附可能与ERK1/2蛋白磷酸化增强有关,而ERK1/2蛋白磷酸化水平提高可能是VEGF表达上调的结果。
综上所述,本研究提示SCD能够明显提高成纤维细胞的增殖、黏附及迁移能力,并能上调愈合相关蛋白VEGF的表达,进而活化ERK1/2蛋白,发挥促进PCSD伤口愈合的功效,然而其确切机制仍不清楚,后续将进一步深入研究,为SCD的开发、应用提供实验依据,也为PCSD的防治提供更多可靠的方法。
