香草扶正合剂对Lewis肺癌模型小鼠癌细胞自噬的影响
2020-12-22王硕廖文宇程权丁志山傅华洲
王硕 廖文宇 程权 丁志山 傅华洲
1.浙江中医药大学第四临床医学院 杭州 310053 2.浙江大学医学院附属杭州市第一人民医院3.浙江中医药大学医学技术学院
肺癌是全球癌症相关死亡最主要的原因,严重危害人类健康[1]。目前,临床上治疗肺癌的方法有手术、化疗、靶向治疗和免疫治疗等,但各种疗法均有其不足之处,手术是早中期肿瘤患者的首选治疗方案,然而部分患者确诊时已为晚期,丧失手术机会,手术难有获益;化疗、放疗是传统的肿瘤治疗方案,但其副作用较强,体质较差的患者难以耐受;靶向治疗有较好的疗效,但有选择性,且易发生耐药;免疫治疗是未来肿瘤治疗的趋势,但可选择药物较少,且许多药物的副作用不容忽视。随着现代医学的不断进步及对中医药的深入研究,中医药在肿瘤治疗中的作用及重要性越来越明显。以中医药为主的多学科综合治疗,为肺癌的治疗开辟了新的路径。临床上,中医药治疗是安全有效的肺癌治疗方法之一,其在治疗肺癌方面的优势在于增加带瘤生存时间,提高患者生存质量,还可以作为放、化疗的辅助治疗,起到增效减毒、减轻患者不良反应、提高患者对放化疗的耐受性等作用[2]。研究证实,包括人参皂苷在内的多种中药有效成分能调控肿瘤细胞自噬,抑制肿瘤的发生和发展[3]。香草扶正合剂(Xiangcao Fuzheng Mixture,XCFZ)为浙江大学医学院附属杭州市第一人民医院院内协定方,自2016年起用于肺癌的治疗和辅助治疗,并作为浙江省中医药防治重大疾病攻关计划项目开展临床研究。XCFZ是由人参、细梗香草等多种具有扶正抗癌功效的中药组成的复方制剂,含多种有效成分,笔者推测其抗肿瘤机制可能与自噬相关,因此本研究拟探讨XCFZ的抗肿瘤作用及其对癌细胞自噬的影响,为临床运用并推广XCFZ提供基础研究依据。
1 材料和仪器
1.1 实验动物 健康雄性无特定病原体(specific pathogen free,SPF)级C57BL/6小鼠60只,6周龄,体质量(20±2)g,由浙江中医药大学动物实验中心提供[实验动物使用许可证号:SYXK(浙)2013-0184]。所有小鼠均在SPF级环境下隔离饲养。
1.2 细胞 C57BL/6荷瘤小鼠肿瘤组织制取的Lewis肺癌单细胞悬液,由浙江中医药大学医学技术学院实验室提供。
1.3 药物和试剂 XCFZ具体组成:细梗香草15g,人参10g,猪苓10g,茯苓30g,麸炒白术12g,薏苡仁30g,防风10g,石斛12g,蝉蜕6g,甘草8g。细梗香草又名满山香(Lysimachia capillipes Hemsl.),产自龙岩市新罗区(批号:20180710);人参、茯苓、麸炒白术、薏苡仁、防风、石斛购于杭州华东中药饮片有限公司(批号:190705、190622、190622、190918、19091009、190809);蝉蜕、猪苓购于上药凯伦医药股份有限公司 (批号:190303、190303);甘草购于浙江佐力百草中药饮片有限公司(批号:20190201)。以上中药饮片全部由杭州市第一人民医院中药房提供,并经浙江大学田景奎教授鉴定为正品。中药饮片由杭州市第一人民医院中药房代煎,抽滤后旋蒸浓缩。根据等效剂量系数折算法计算药品稀释浓度,得到XCFZ终浓度为:低剂量0.93g·mL-1,中剂量1.86g·mL-1(相当于临床用药剂量),高剂量3.72g·mL-1。顺铂注射液购于江苏豪森药业集团有限公司(批号:81209),稀释至0.64mg·mL-1。自噬相关基因Beclin1、自噬相关蛋白5(autophagy related 5,Atg5)、微管相关蛋白1轻链3-β(microtubule associated protein 1 light chain3-β,LC3b)一抗均购于日本MBL公司(批号:006、004、015);β-actin一抗、羊抗兔IgG、羊抗鼠IgG均购于美国Immunoway公司(批号:B2801、B0201、B0201);BeyoRTTMⅡ cDNA合成试剂盒购于上海碧云天生物科技有限公司(批号:12018190503);Power UpSYBR Green Master Mix购于美国ABI公司(批号:00787264)。
1.4 主要仪器 聚丙烯酰胺凝胶垂直电泳槽、电泳转印仪均为美国Bio-Rad公司产品;Tanon 5200全自动化学发光图像分析系统购于上海天能科技有限公司;2720 Thermal Cycler PCR仪购于美国赛默飞公司;7500 Real-Time PCR System购于美国ABI公司;H-7650型透射电子显微镜为日本HITACHI公司产品。
1.5 方法
1.5.1 动物造模、分组及给药 小鼠适应性饲养7d后随机抽取8只作为空白组,剩余小鼠共同造模,造模方法参考文献[4]。从造模成功的小鼠中选取40只状态良好的荷瘤小鼠,随机分为5组,每组8只,分别为模型组、XCFZ低剂量组、XCFZ中剂量组、XCFZ高剂量组、顺铂组即阳性对照组。造模成功后开始给药。模型组以双蒸水0.2mL·d-1灌胃;XCFZ低、中、高剂量组分别以XCFZ低、中、高剂量0.2mL·d-1灌胃;顺铂组以顺铂溶液0.1mL·(2d)-1腹腔注射,同时以双蒸水0.2mL·d-1灌胃。各组小鼠每天固定时间给药,给药14d。停药24h后称重,脱颈处死小鼠,完整剥离瘤体,迅速取1mm3体积瘤体标本浸入pH=7.4的2.5%戊二醛中;记录小鼠瘤质量和去瘤后体质量并计算抑瘤率,抑瘤率(%)=(1-实验组平均瘤体积/模型组平均瘤体积)×100%。部分瘤体于-80℃冻存,其余部分固定于4%多聚甲醛中。
1.5.2 肿瘤组织病理形态学观察 取出固定的肿瘤组织,冲洗后梯度乙醇脱水,二甲苯透明,石蜡包埋,4μm切片,脱蜡后苏木精-伊红(hematoxylin-eosin,HE)染色,封片,光镜下观察肿瘤组织形态学改变。
1.5.3 透射电镜观察瘤组织自噬小体 取出固定完成的瘤体标本,磷酸缓冲液冲洗,1%锇酸固定,乙醇、丙酮逐级脱水,Epon812包埋过夜,70nm超薄切片,铀、铅双重染色,电镜下观察肿瘤组织细胞的自噬小体。
1.5.4 Western blot检测肿瘤组织Beclin1、Atg5、LC3b蛋白表达 提取肿瘤组织总蛋白,二喹啉甲酸法测蛋白浓度,加入上样缓冲液后变性,制胶,电泳,转膜,先后加入一抗、二抗孵育,洗膜后电化学发光显影,Adobe Photoshop CS6软件分析条带灰度值。
1.5.5 实时荧光定量PCR(Real-time quantitative PCR,RT-qPCR)技术检测肿瘤组织相关蛋白mRNA表达水平 Trizol法提取肿瘤组织总RNA,空白组取肺组织,检测RNA浓度及纯度后,使用BeyoRTTMⅡ cDNA合成试剂盒进行逆转录,按Power Up SYBR Green Master Mix说明书,使用7500 Real Time PCR System进行扩增,分别检测Beclin1、Atg5、LC3b、Unc-51样自噬激活激酶1(Unc-51 like autophagy activating kinase 1,ULK1)、B细胞淋巴瘤-2(B-cell lymphoma-2,Bcl-2)、Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)mRNA表达水平。所有引物都由上海生工生物工程有限公司合成,序列见表1。用Relative Quantification Study法分析,以2-△△Ct计算mRNA相对表达量。
1.6 统计学分析 采用在线SPSS分析软件(https://spssau.com/front/spssau/index.html)进行统计学分析,符合正态分布的计量资料以±s表示。多组间比较采用单因素方差分析,两两比较采用最小显著性差异法。以P<0.05为差异有统计学意义。

表1 引物序列Tab.1 Primer sequences
2 结果
2.1 各组小鼠瘤质量、抑瘤率和去瘤后体质量比较 与模型组比较,各给药组瘤质量降低(P<0.01),顺铂组抑瘤率最高,其次为XCFZ中剂量组。与模型组比较,XCFZ中剂量组去瘤后体质量升高(P<0.05),顺铂组降低(P<0.05);与顺铂组比较,XCFZ低、中、高剂量组去瘤后体质量升高(P<0.05,P<0.01)。见表2。
2.2 各组小鼠肿瘤组织形态学观察 光镜下模型组肿瘤细胞排列紧密、紊乱,核染色深,核分裂现象多见,异型性明显,肿瘤细胞坏死、核仁固缩少见;XCFZ各剂基组核分裂现象和异型细胞较少,多见肿瘤细胞核仁固缩现象,多见细胞间空洞和孤立细胞,细胞坏死和核碎裂现象亦较多。顺铂组核分裂现象和异型细胞少见,可见瘤细胞较小,大片坏死细胞和碎裂的细胞核,核仁固缩和细胞间空洞亦多见。见图1。
2.3 各组小鼠肿瘤组织细胞超微结构比较 各组均可观察到双层或多层膜包裹的自噬小体,自噬小体内可见核的碎片和细胞器。模型组自噬体少见,且细胞结构较为完整。XCFZ各剂量组可见大片自噬体,细胞结构破坏严重,细胞质明显减少,胞内可见大量空泡。顺铂组细胞结构破坏最为严重,自噬体较多,且自噬体内容物降解严重。见图2。
表2 各组小鼠瘤质量、抑瘤率和去瘤后体质量的影响(±s,n=8)Tab.2 Comparison of tumor quality,tumor inhibition rate and weight after tumor removal in each group (±s,n=8)

表2 各组小鼠瘤质量、抑瘤率和去瘤后体质量的影响(±s,n=8)Tab.2 Comparison of tumor quality,tumor inhibition rate and weight after tumor removal in each group (±s,n=8)
注:与模型组比较,*P<0.05,**P<0.01;与顺铂组比较,△P<0.05,△△P<0.01Note:Compared with model group,*P<0.05,**P<0.01;compared with cisplatin group,△P<0.05,△△P<0.01
组别 瘤质量(g) 抑瘤率(%) 去瘤后体质量(g)模型组 1.64±0.26 0 19.35±1.81 XCFZ 低剂量组 1.03±0.28** 39.22 19.64±0.91△XCFZ 中剂量组 0.73±0.31** 57.08 21.25±1.39*△△XCFZ 高剂量组 1.03±0.13** 39.17 19.77±0.95△顺铂组 0.64±0.29** 62.55 17.32±1.77*
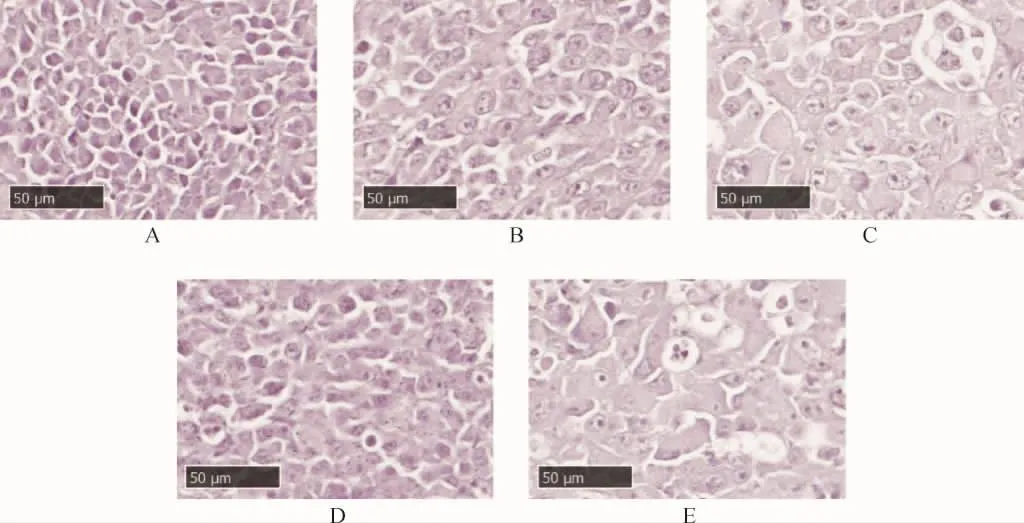
图1 各组小鼠肿瘤组织病理学观察(HE染色,400×)Fig.1 Histopathological observation of tumor in each group(HE staining,400×)
2.4 各组小鼠肿瘤组织自噬相关蛋白Beclin1、Atg5、LC3b表达比较 与模型组比较,XCFZ低、中剂量组和顺铂组Beclin1表达升高(P<0.05,P<0.01);与XCFZ中剂量组比较,XCFZ高剂量组Beclin1表达降低(P<0.01)。与模型组比较,XCFZ中、高剂量组和顺铂组Atg5表达升高(P<0.01);与XCFZ中剂量组比较,XCFZ低、高剂量组Atg5表达降低(P<0.01);与顺铂组比较,XCFZ中剂量组Atg5表达升高(P<0.05)。与模型组比较,XCFZ低、中、高剂量组和顺铂组LC3b表达升高(P<0.01);与XCFZ中剂量组比较,XCFZ低、高剂量组LC3b表达降低(P<0.01);与顺铂组比较,XCFZ中剂量组LC3b表达升高(P<0.01)。见图3。
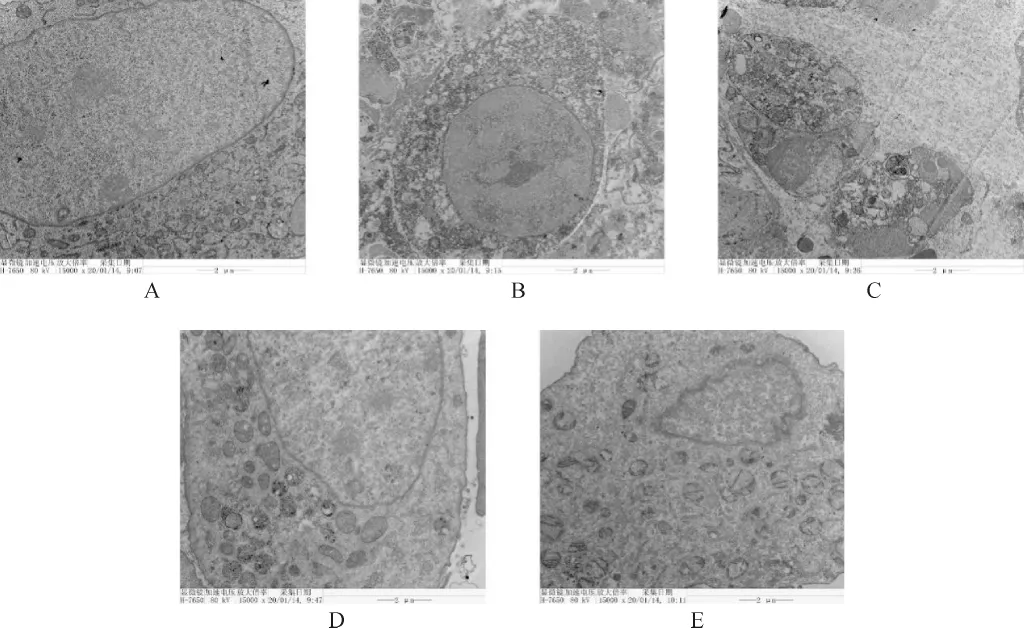
图2 各组小鼠肿瘤组织细胞超微结构观察(15 000×)Fig.2 Ultrastructural observation of tumor cells in each group(15 000×)

图3 各组小鼠肿瘤组织Beclin1、Atg5、LC3表达水平比较Fig.3 Comparison of expression level of Atg5,Beclin1 and LC3 in each group
2.5 各组小鼠肿瘤组织相关蛋白mRNA表达比较 与模型组比较,XCFZ低、中、高剂量组和顺铂组Beclin1 mRNA表达升高 (P<0.01); 与XCFZ中剂量组比较,XCFZ低、高剂量组Beclin1 mRNA表达降低(P<0.01);与顺铂组比较,XCFZ中剂量组Beclin1 mRNA表达升高(P<0.05)。与模型组比较,XCFZ中、高剂量组和顺铂组Atg5 mRNA表达升高(P<0.01);与XCFZ中剂量组比较,XCFZ低、高剂量组Atg5 mRNA表达降低(P<0.01); 与顺铂组比较,XCFZ中剂量组Atg5 mRNA表达差异无统计学意义(P>0.05)。与模型组比较,XCFZ低、中、高剂量组和顺铂组LC3b mRNA表达升高(P<0.05,P<0.01);与XCFZ中剂量组比较,XCFZ低剂量组LC3b mRNA表达降低(P<0.01);与顺铂组比较,XCFZ中剂量组LC3b mRNA表达差异无统计学意义(P>0.05)。与模型组比较,XCFZ低、中、高剂量组和顺铂组Bax/Bcl-2升高 (P<0.01); 与XCFZ中剂量组比较,XCFZ低、高剂量组Bax/Bcl-2降低(P<0.01);与顺铂组比较,XCFZ中剂量组Bax/Bcl-2差异无统计学意义(P>0.05)。与模型组比较,XCFZ低、中、高剂量组和顺铂组ULK1 mRNA表达升高(P<0.05);与XCFZ中剂量组比较,XCFZ低剂量组ULK1 mRNA表达降低(P<0.01);与顺铂组比较,XCFZ中剂量组ULK1 mRNA表达差异无统计学意义(P>0.05)。见图4。

图4 各组小鼠肿瘤组织Beclin1、Atg5、LC3b、ULK1 mRNA表达和Bax/Bcl-2比较Fig.4 Comparison of the expressions of Beclin1,Atg5,LC3b,ULK1 mRNA and Bax/Bcl-2 in each group
3 讨论
XCFZ由扶正康复液(又名人参二苓汤)加味细梗香草而成。扶正康复液为浙江省名中医傅华洲教授的经验方,作为浙江大学医学院附属杭州市第一人民医院院内协定方,自2012年起广泛用于大病及手术后康复、肿瘤放化疗的辅助治疗,临床疗效明显,并已经有较多的临床研究和基础研究报道[5-6]。2016年,傅华洲教授根据细梗香草体外抗肿瘤研究结果[7]和民间使用经验,在扶正康复液基础上加味细梗香草,组成XCFZ并作为肺癌治疗和辅助治疗的专用方,目前已立项为浙江省中医药防治重大疾病攻关计划,准备进一步深入研究。
《内经》云:“邪之所凑,其气必虚。壮人无积,虚人则有之。脾胃虚弱,气血两虚,四时有感,皆能成积。”肿瘤虽多虚实夹杂,但其本质是虚证;且此类患者多脾胃虚弱,阳气不足,气机不畅,多有痰饮水湿等病理产物,故痰湿交阻而成癥积,宜用平补、调补之法辅以消法。XCFZ以兼具扶正抗癌功效的细梗香草为君,人参、茯苓、薏苡仁、白术共为臣药,均有益气健脾之功效,且人参可大补元气,茯苓利水渗湿,白术利水燥湿,薏苡仁利水渗湿又可解毒散结,符合肿瘤患者久病体虚、正气不足且多痰湿的病机特点。猪苓味甘淡,性平,能渗泄水湿,可辅助人参、茯苓、薏苡仁、白术4味,增强祛湿化痰之功效;蝉蜕疏散风热、宣散透发,又可利水以攻邪;石斛益胃生津、清热滋阴而不滋腻,能防止方中参、术之温性太过,反致化热助邪;体虚者多表虚不固,易感六淫之邪,故以防风祛风固表以防外邪;甘草补益脾胃、调和诸药,为佐药。诸药合用,符合肿瘤患者肺脾两虚、癌毒滞结的基本病机特点,故能随证取效。
本研究通过建立Lewis肺癌移植瘤模型,结果提示XCFZ抑瘤作用明显,而且中剂量组在各剂量组中效果最佳。本研究中XCFZ的稀释浓度是根据等效剂量系数折算法计算的,XCFZ中剂量相当于临床用药剂量,高剂量和低剂量浓度分别为中剂量的2倍和0.5倍。XCFZ临床用药剂量为傅华洲教授根据前人经验、中药性质和多年门诊经验调整而来,其剂量较为符合肺肿瘤患者的病情。低剂量XCFZ的抑瘤效果降低,可能是中药剂量依赖性的体现;高剂量XCFZ的抑瘤效果降低,可能与药物代谢产物的毒性作用相关,有待进一步研究。本研究中XCFZ中剂量在各剂量组中效果最佳,提示中剂量可能更有利于药效的发挥,亦可为目前临床用药剂量提供依据。与顺铂组和模型组比较,XCFZ中剂量组可升高小鼠去瘤后体质量,提示XCFZ中剂量可能对荷瘤小鼠机体具有保护作用。
自噬是真核细胞程序性死亡的一种方式。研究认为,自噬活性降低可能与人类癌症的发生有关[8],而诱导肿瘤自噬可起到抑瘤效果[9]。ULK1是DNA结合转录调节子调控的转录共激活因子的负调节大分子复合物之一,活化ULK1是自噬的重要启动步骤[10]。自噬体延伸需要两个泛素样结合体系,即Atg5-Atg12结合体系和LC3结合体系,Atg5可能是Atg12偶联的唯一目标[11];而LC3是酵母Atg8的自噬体直向同源物,在自噬溶酶体的形成中起着至关重要的作用,目前已被公认为自噬标志物。LC3一般以可溶性LC3Ⅰ的形式存在,当自噬发生时,LC3和自噬小体表面的磷脂酰乙醇胺结合,转变为脂溶性的LC3Ⅱ,而LC3Ⅱ的表达与自噬活性呈正比[12]。Beclin1与酵母Atg6基因同源,参与自噬小体形成,在自噬中发挥核心作用,其过表达可诱导自噬,并在抑制肿瘤方面起着重要作用[13]。本研究结果表明,XCFZ中剂量可升高Atg5、Beclin1、LC3Ⅱ的蛋白表达 水 平和Atg5、Beclin1、LC3b、ULK1的mRNA表达水平,提示XCFZ可能通过诱导细胞自噬,从而抑制肿瘤生长。
诱导癌细胞凋亡也是抑制肿瘤生长的重要方式。Beclin1-Bcl-2是自噬与凋亡间第一个确定的分子连接,Beclin1是一种促凋亡蛋白,其表达水平升高可引起Bax与Bcl-2解聚,进而促进凋亡[13-14]。Atg5过表达可增加肿瘤细胞对各种凋亡诱导因素的敏感性[15]。XCFZ可升高Beclin1、Atg5蛋白及mRNA表达水平,并使Bax/Bcl-2 mRNA的比值升高,提示XCFZ的抑瘤机制还可能与自噬相关凋亡有关,可能通过刺激Beclin1蛋白表达,导致Bax与Bcl-2的解聚,从而诱导癌细胞凋亡;并通过促进Atg5的表达,增加肿瘤细胞对凋亡的敏感性。
综上所述,本研究中XCFZ和顺铂对自噬相关蛋白及mRNA表达水平的影响具有相同趋势,表明两者的抑瘤机制存在相似之处。但对小鼠肿瘤细胞超微结构的观察显示,XCFZ可明显减少瘤细胞胞质,提示其抑瘤机制可能与顺铂不同,有待进一步研究。
