清热活血药对急性脑缺血再灌注大鼠MAPK通路的影响
2020-12-21陈宝鑫张昕洋贺立娟徐榛敏刘雪梅
陈宝鑫,傅 晨,张昕洋,贺立娟,徐榛敏,刘雪梅
急性脑梗死(acute ischemic stroke,AIS)是临床最常见的脑血管疾病,约占全部脑血管病的85%,2018年10月发布的《中国脑卒中防治报告(2018)》[1]指出我国40岁及以上人群的脑卒中患病率由2012年的1.89%上升至2016年的2.19%,现患和曾患人数达1 242万人,每年死于脑卒中的病人高达196万人。炎症反应在急性脑梗死过程中起着关键作用,其不仅参与脑缺血的病理生理过程,而且被认为是引发加重脑损伤的主要因素之一[2]。中医学者大多认可瘀血存在于中风病的全过程,既是重要致病因素,又是病理产物。中风火热论由金元时期刘完素大力倡导,云:“六气之中,火热占二,余风、湿、燥、寒诸气经传变皆能化热生火”“中风偏枯者,由心火暴盛而水衰不能制,则火实克金,金不能平木,则肝木胜,而兼于火热,则卒暴僵仆”。本团队长期从事中医药治疗中风病研究,认为火热与瘀血蕴积是急性脑梗死加重、恶化的主要病因病机。选择苦碟子注射液作为清热活血药的代表药物进行研究,主要成分为腺苷和黄酮类物质,具有活血止痛、清热祛瘀的作用,对急性脑梗死的疗效优于目前常用的其他药物[3]。有Meta分析显示,常规治疗基础上加用苦碟子注射液可以提高急性脑梗死的疗效,明显改善病人神经功能损害程度[4]。本团队前期临床研究证实苦碟子注射液可较早、较显著地降低病人血清白细胞介素-6(IL-6)、白细胞介素-18(IL-18)、基质金属蛋白酶-9(MMP-9)水平,升高白细胞介素-10(IL-10)水平,降低神经元特异性烯醇化酶(NSE)和S100B水平,具有一定的疗效[5]。有实验研究证实,苦碟子注射液可下调大脑中动脉缺血(MCAO)大鼠Toll样受体-4(TLR-4)依赖性核因子-κB(NF-κB)信号通路发挥功能,降低细胞凋亡,保护大脑免受缺血性损伤[6-7]。丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路是细胞内重要的信号传导通路,在脑缺血级联反应损伤过程中起着关键作用。MAPK信号通路主要包括细胞外信号调节激酶(extracellular regulated protein kinases,ERK)、c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)和p38。MAPK信号通路和NF-κB信号通路具有相关性,磷酸化p38(p-p38)和磷酸化ERK(p-ERK)活化后由胞质转位到核内,激活NF-κB,下调p38 MAPK信号通路可抑制NF-κB的过度激活[8]。因此,本研究从NF-κB上游的MAPK通路入手,探讨清热活血药对急性脑梗死的保护作用机制。
1 材料与方法
1.1 实验动物 健康雄性SD大鼠,无特定病原体(SPF)级,体重(230±20)g,购自维通利华实验动物技术有限公司,许可证号SCXK(京)2016-0006。在北京中医药大学东方医院实验中心饲养,大鼠自由进食、饮水,控制室温在18~26 ℃,相对湿度40%~70%,每日光照时间12 h。
1.2 药物与试剂 苦碟子注射液(通化华夏药业有限责任公司生产,国药准字Z20025450),RIPA buffer(R0278,sigma),蛋白酶抑制剂(11697498001,Roche),BCA蛋白定量试剂盒(23225,Thermo),LDS Sample Buffer 4×(NP0007,Thermo),SDS-PAGE预制胶10%(14100312,Thermo),预染蛋白(LC5925,Life),电泳缓冲液(NP0001,Thermo),转膜液(NP0006-1,Thermo), phopho-p38 MAPK兔多克隆抗体(9211,CST), p38 MAPK兔多克隆抗体(9212,CST),phopho-JNK兔多克隆抗体(4668,CST),JNK兔多克隆抗体(9252,CST),phopho-ERK兔多克隆抗体(9101,CST),ERK兔多克隆抗体(9102,CST),羊抗兔二抗(A11011,Invitrogen),脱脂奶粉(232100,BD),ECL超敏发光液(WBKLS0500,Millipore),IL-6试剂盒(MD120792,MDL),MMP-9试剂盒(MD120284,MDL)。
1.3 仪器 MCAO栓线(A4-243250,北京西浓科技有限公司),MultiSkan3酶标仪(Thermo),垂直电泳系统(121201-0899 Thermo),转膜系统(153BR6581,Biorad),凝胶成像分析仪(5000P91DW,Gene)。
1.4 动物模型 采用10%水合氯醛(35 mg/kg)对大鼠进行腹腔注射麻醉,仰卧固定于手术台上,颈部正中切开,逐层分离组织,暴露左侧颈总动脉(CCA)、颈外动脉(ECA)、颈内动脉(ICA),永久结扎CCA近心端、ECA根部,微动脉夹暂时夹闭CCA的远心端,在CCA结扎处远心端剪一斜口,经此斜口插入顶端光滑成球面的直径0.24 mm的尼龙线,经CCA分叉处通过ICA入颅至大脑前动脉(ACA)的起始部,从而闭塞大脑中动脉(MCA)的起始部,造成MCA供血相关区的梗死。尼龙线插入深度为(18.5±0.5)mm,结扎CCA远心端以固定尼龙线和防止出血,逐层缝合皮肤,尼龙线末端暴露在体外。栓塞1.5 h后,拔出尼龙线24 h,模拟急性脑缺血再灌注模型。假手术组除插线10 mm外,其余步骤同模型组。采用Zea Longa神经症状评分[8],选取评分1~3分的大鼠,共39只进入实验。
1.5 分组与给药 实验大鼠随机分为3组:假手术组、模型组(缺血1.5 h再灌注24 h)、清热活血药治疗组,每组13只。清热活血药治疗组给予腹腔注射苦碟子注射液,手术后2 h给药1次,以后每隔12 h给药1次,共给药3次。给药剂量按照体表面积进行换算,dB(mg/kg)=dA×(RB/RA)×(WA/WB)1/3,其中dB是大鼠的千克体重剂量,dA是人的千克体重剂量,WA、WB是已知人和大鼠的体重,RA、RB是体型系数(RA=0.1,RB=0.09)。由此计算出大鼠给予苦碟子注射液3.6 mL/kg(本团队先前发表的文章也证实此剂量安全有效[6-7]),假手术组和模型组给予等体积的生理盐水。
1.6 神经功能评价 每组取10只大鼠进行神经功能评价。采用Garcia JH评分[9]评价大鼠神经功能,功能正常评分最高,为18分;功能损伤最严重评分最低,为3分。
1.7 脑梗死体积 各组大鼠在MCAO造模后24 h取材,使用10%水合氯醛腹腔注射进行麻醉,迅速断头取脑,-20 ℃冰箱内冷冻10 min,首先去除嗅球和脑干部分,然后自额极开始行2 mm厚连续冠状切片,均匀切成5片。将切片放入5 mL 1%的2,3,5-氯化三苯基四氮唑(2,3,5-triphenyl tetrazolium chloride,TTC)染液中,37 ℃避光水浴15 min。待显色完全,10%多聚甲醛固定脑片30 min,拍照。采用Image J分析软件对TTC染色照片进行统计分析,脑梗死体积百分比=(各脑切片梗死面积×切片厚度之和)/(各脑切片的面积×切片厚度之和)。每组10只,其中清热活血药治疗组死亡2只。
1.8 蛋白免疫印迹法(Western Blot) 取各组大鼠缺血侧大脑皮层,加适量含有cocktail蛋白酶抑制剂的裂解液提取组织总蛋白,BCA法测定蛋白浓度。余蛋白加入适量样品还原剂、4×上样缓冲液,95 ℃金属浴5 min蛋白变性,-80 ℃保存或直接进行实验。使用SDS-PAGE分离,转移至PVDF膜上,5%脱脂奶粉封闭1 h。加入用5%脱脂奶粉配制的一抗,p-p38兔多克隆抗体(1∶1 000),p38兔多克隆抗体(1∶2 000),磷酸化-JNK(p-JNK)兔多克隆抗体(1∶1 000),JNK兔多克隆抗体(1∶4 000),磷酸化p-ERK1/2兔多克隆抗体(1∶2000),ERK1/2兔多克隆抗体(1∶1000),4 ℃孵育过夜,PBST漂洗,5 min×3次,加入二抗,山羊抗兔IgG-HRP(1∶2 000),室温摇床孵育1 h。PBST洗膜,增强化学发光(ECL)显影曝光。每组3只,实验重复3次。Image J软件分析蛋白电泳条带的光密度值。
1.9 酶联免疫吸附实验(ELISA) 取各组大鼠缺血侧大脑皮层,ELISA法检测IL-6、MMP-9。按照试剂盒进行操作。①加样:分别设标准孔、待测样品孔、空白孔。标准孔7孔,依次加入100 μL不同浓度的标准品。空白孔加100 μL 标准品稀释液,余孔加待测样品100 μL,37 ℃温育1 h,弃液;②各孔加检测工作液A 100 μL,37 ℃温育1 h,弃液,洗板3次;③各孔加检测工作液B 100 μL,37 ℃温育30 min,弃液,洗板3次;④各孔加入TMB底物溶液90 μL,37 ℃避光孵育10~20 min;⑤各孔加终止溶液50 μL,终止反应;⑥酶标仪450 nm波长测量各孔的光密度值(OD值)。
2 结 果
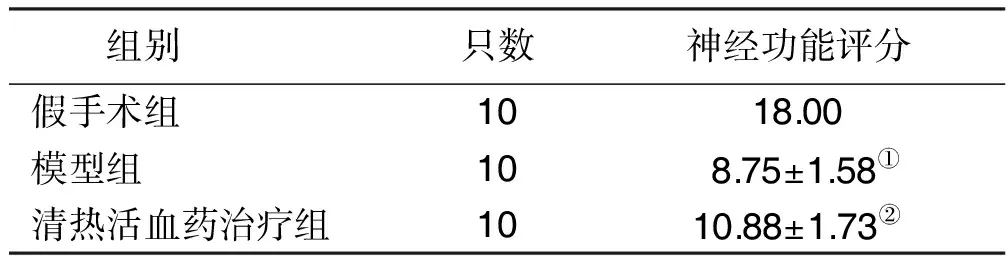
2.1 各组神经功能缺损程度比较 模型组与假手术组神经功能缺损程度比较差异有统计学意义(P<0.01);与模型组比较,清热活血药治疗组神经功能缺损程度改善(P<0.05)。提示清热活血药可以改善MACO大鼠神经功能缺损程度。详见表1。
表1各组大鼠神经功能评分比较
单位:分
2.2 各组脑梗死体积比较 TTC染色发现,模型组和清热活血药治疗组的脑组织可见明显白色梗死灶。与模型组比较,清热活血药治疗组白色梗死区减小,脑梗死体积明显减小(P<0.01)。结果见表2、图1。
表2 各组大鼠脑梗死体积比较(±s) 单位:%

图1 各组大鼠脑组织TTC染色观察脑缺血形态
2.3 各组MAPK蛋白表达水平比较 与假手术组比较,模型组大鼠缺血侧大脑皮层中p-p38、p-ERK1/2蛋白表达水平明显增高(P<0.01);与模型组比较,清热活血药治疗组p-p38、p-ERK1/2的蛋白表达水平明显降低(P<0.01),而对JNK蛋白表达差异无统计学意义(P>0.05)。详见表3、图2。
2.4 各组缺血侧皮层炎性因子表达水平比较 与假手术组比较,模型组大鼠缺血侧大脑皮层中IL-6、MMP-9表达均明显升高(P<0.01);与模型组比较,清热活血药组IL-6、MMP-9表达均明显降低(P<0.01)。详见表4。

表3 各组大鼠缺血侧皮层MAPK蛋白表达水平比较
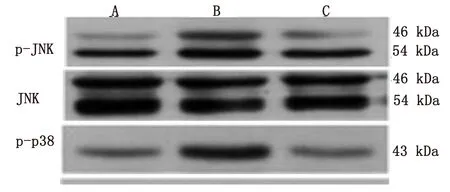
图2 各组缺血侧皮层MAPK及其磷酸化蛋白表达电泳图
表4 各组缺血侧皮层炎性因子表达水平比较(±s)
3 讨 论
脑缺血缺氧激活大量炎症细胞,如小胶质细胞、星形胶质细胞、巨噬细胞等,炎症细胞产生大量的炎症相关因子,如IL-6、MMP-9,这些因子又会通过相关细胞信号通路对炎症细胞起到反馈调节作用,加剧脑细胞的损伤,并破坏了血脑屏障及细胞外基质,而血脑屏障的破坏引起大脑的二次损伤,放大了瀑布式的炎症级联反应。IL-6是临床和实验研究最多的炎性因子。脑缺血发生后,IL-6水平随着时间推移而增加,脑缺血3 d达高峰,7 d时仍显著增高,甚至持续到缺血14 d。IL-6与病人病情严重程度、中风严重性、梗死体积、不良预后密切相关[10-11]。基质金属蛋白酶(MMPs)攻击血管环绕的细胞外基质,促进神经细胞死亡。在脑缺血的早期阶段,MMP-9破坏血脑屏障,导致渗漏、白细胞浸润、脑水肿甚至出血[12]。MMP-9水平的升高可作为脑卒中死亡和预后不良的预测因子[13]。本实验结果发现,脑缺血大鼠的皮层IL-6、MMP-9明显升高,清热活血药可以降低IL-6、MMP-9水平,这也与本课题组前期研究结果有一致性,前期发现临床急性脑梗死病人入院3~5 d,苦碟子注射液可明显降低血清IL-6和MMP-9水平,至第14天,与基础治疗组比较,仍可明显降低血清MMP-9[5]。
MAPK属于丝氨酸/苏氨酸(Ser/Thr)蛋白激酶。主要包括ERK、JNK和p38,其各自介导不同的MAPK信号通路,调节细胞内基因转录,参与细胞增殖、分化、凋亡等生理过程,介导生长发育、炎症反应等生命活动[14-15]。研究发现,在脑梗死早期p38即被激活,在神经元和神经胶质细胞中大量存在。激活后的p38可促进内皮细胞炎性介质和黏附因子的表达,导致血脑屏障的破坏。而产生的炎性介质进一步激活p38,形成正反馈的恶性循环。p-p38是p38信号通路中介导炎症反应的活性物质。Sugino等[16]研究发现蒙古沙鼠全脑缺血后,海马CA1区JNK、p38被激活,大剂量的p38抑制剂SB203580能够适度抑制JNK激活,降低细胞凋亡,提示p38在脑缺血期间的海马神经元存活和死亡中起重要作用。研究发现,脑梗死会引起时间依赖性的ERK激活,应用ERK抑制剂可以有效降低梗死区炎症细胞因子的表达和细胞的死亡,发现ERK信号通路可以通过上调MMP-9蛋白的表达来增加血脑屏障的通透性,加重脑损伤。ERK1/2信号通路可通过MAPK激酶(MEK)激活MMP-9,加剧血脑屏障的损伤,从而加重炎症反应[17]。本研究结果发现,清热活血药能够降低磷酸化的p38、ERK蛋白表达,降低IL-6、MMP-9的表达,说明其可能是通过抑制MAPK蛋白表达,进而降低炎症反应相关因子IL-6、MMP-9的表达,从而发挥对脑梗死的调节作用。
本课题组认为缺血性中风病病人素体阴虚、复感外邪,致气机不畅、血失气煦、内生瘀血;邪从热化,蕴积化生火热,火热内炽,邪热内陷,煎熬津液,燔灼阴血,生痰生瘀,加重阴虚之候,上述过程相互诱导、促进、加重、恶化,是中风病急性期的重要病因和基本病机。瘀血是中风病急性期的始动病因和病理产物,火热是进展恶化的重要因素,二者相兼致病,难治难愈。因此,火热与瘀血蕴积可能是急性脑梗死加重恶化的主要病因病机。本研究发现清热活血药对MAPK信号通路的调节作用主要针对p38和ERK1/2的磷酸化,进而影响其下游的炎症相关因子的表达。另一方面,从结果中可以发现清热活血药对MAPK信号通路的调节具有选择性,具有多靶点调控的特点,而其发挥调节作用的关键蛋白p38和ERK1/2将有可能成为脑梗死治疗的潜在的靶环节。
