不同来源白细胞微粒诱导巨噬细胞极化的比较研究
2020-12-21赵明镜王保福金秋硕韩小婉
李 洋,赵明镜,王保福,刘 颖,金秋硕,韩小婉,李 彤,孟 慧
微粒(microparticles,MPs)是细胞外囊泡的一种,也被称为微囊泡,是细胞在活化或凋亡的过程中由细胞膜出芽脱落形成的直径在100~1 000 nm的小囊泡,携带来源于其母细胞的mRNA、microRNAs(miRNAs)、受体及特异性蛋白等,主要通过膜融合、内吞、配体与受体结合的方式将其携带的特异蛋白或遗传物质传递给靶细胞,影响靶细胞的功能[1-2]。研究发现,微粒能够诱导内皮功能障碍,参与血管炎症、凝血、血栓形成和钙化等病理进程,促进动脉粥样硬化(atherosclerosis,AS)的发生发展[1,3-4]。其中白细胞微粒(leukocyte-derived microparticles,LMPs)几乎参与AS的所有病理进展,临床研究发现AS病人斑块中的微粒大部分是LMPs,而LMPs中又以巨噬细胞来源的微粒居多[5],且泡沫细胞比正常的巨噬细胞释放更多的微粒[6]。巨噬细胞极化是巨噬细胞在不同微环境的刺激下定向分化为多种亚型的过程[7]。在AS发生发展中,巨噬细胞主要以M1型(促炎型)和M2型(抗炎型)存在,M1型和M2型巨噬细胞之间的动态平衡,不仅决定了炎症的最终转归,而且与AS斑块的稳定性和疾病的轻重程度密切相关[7-8]。那么,巨噬细胞和泡沫细胞作为AS炎症病理机制的核心环节,二者来源的微粒是否参与巨噬细胞M1型和M2型的失衡,二者作用是否有差异,尚未见文献报道。本课题组前期研究显示,颈动脉粥样硬化(CAS)人群的LMPs与巨噬细胞亚型具有一定关系,可能参与调节巨噬细胞极化。因此,本研究通过对巨噬细胞来源的微粒(macrophage-derived microparticles,M-MPs)和泡沫细胞来源的微粒(foam cell-derived microparticles,FC-MPs)诱导巨噬细胞极化进行探讨,以期为后续AS的临床与基础研究提供思路及方法。
1 材料与方法
1.1 材料 细胞:人单核细胞系(THP-1)细胞购于中国医学科学院协和细胞资源中心;试剂:RPMI 1640培养基(索莱宝,货号31800)、胎牛血清(FBS,GIBCO,货号10099-141C)、佛波酯(PMA,Sigma,货号P1585)、氧化低密度脂蛋白(ox-LDL,广州奕元,货号YB-002)、无外泌体血清(宇玫博生物,货号UR50202)、饱和油红O染色剂(索莱宝,货号G1260)、绝对计数用微球试剂盒(Beckman,货号7547053)、PKH26荧光染料(Umibio,货号UR50202)、DAPI封片剂(中杉金桥,货号ZLI-9557);Annexin-Ⅴ(BD,货号550474)、CD206(BD,货号550889)、CD11b(BD,货号562793)、CD11c(BD,货号555392)、CD68(abcam,货号ab213363)。主要仪器:培养箱(日本SANYO公司生产)、医用离心机(北京白洋医疗器械有限公司生产)、4 ℃离心机(德国Eppendorf公司生产)、Cytoflex LX流式细胞仪(美国Beckman Coulter公司生产)、TCS SP8X激光共聚焦显微镜(德国Leica显微系统有限公司生产)。
1.2 方法
1.2.1 巨噬细胞及泡沫细胞的诱导及鉴定
1.2.1.1 细胞培养及诱导 THP-1细胞使用含10%血清的RPMI 1640培养基进行培养,每两天换液1次,每4天传代1次,传至3~5代后取对数生长期细胞进行诱导。根据课题组前期预实验,使用含100 ng/mL PMA的无血清RPMI 1640培养基培养1×106个/mL THP-1细胞24 h可将THP-1诱导为M0型巨噬细胞(静息型)[9-11],再以含3%无外泌体血清和80 μg/mL ox-LDL的培养基培养48 h可将巨噬细胞诱导为泡沫细胞[12],以M0型巨噬细胞加入含3%无外泌体血清和无ox-LDL的RPMI 1640培养基诱导48 h作为对照。
1.2.1.2 巨噬细胞CD68免疫组化鉴定 将诱导得到的M0型巨噬细胞用4%多聚甲醛固定15 min,然后用磷酸缓冲盐溶液(PBS)洗3次,每次5 min,再用3%过氧化氢(H2O2)孵育10 min后加山羊血清室温下封闭15 min,加CD68抗体(浓度1∶100)4 ℃过夜孵育,次日加入增强液及二抗后使用二氨基联苯胺(DAB)显色,再用乙醇梯度各脱水3 min、二甲苯透明、中性树胶封片。
1.2.1.3 泡沫细胞油红O染色 油红O 存储液和去离子水以3∶2比例进行稀释,滤纸过滤后室温下放置10 min待用。弃去泡沫细胞培养液,用PBS 轻缓漂洗1~2 遍,去除残余培养基,4%多聚甲醛固定15 min。在上述泡沫细胞加入油红O染液染色15 min,弃去染液,加入PBS漂洗2~3遍后加入60%异丙醇,分色数秒钟,去除非特异性染色,最后加入苏木素染液对细胞核进行复染(镜下观察细胞核着色后即可终止,避免过度着色),显微镜下观察细胞脂质蓄积。
1.2.2 不同来源LMPs的提取及鉴定 依据1.2.1中的方法诱导巨噬细胞及泡沫细胞,分别收集两种细胞的上清液,以4 ℃、1 600 g离心5 min,取上清液去沉淀以去除细胞碎片,再以4 ℃、16 000 g离心40 min进行第二步离心,弃上清,将沉淀用200 μL无血清RPMI 1640培养基重悬,得到M-MPs和FC-MPs[13]。
鉴定微粒大小:运用 Cytoflex流式细胞仪通过前向角(FSC)/侧向角(VSSC)确定 100 nm和1 000 nm微珠的位置,圈定100~1 000 nm之间的区域,即为微粒的门。M-MPs与FC-MPs悬液各取10 μL,分别加入5 μL Annexin-Ⅴ(微粒特征性蛋白)[14]避光孵育20 min,然后加入RPMI 1640稀释10倍,充分混匀后分别上机检测。同样电压条件下分布于微粒门内且Annexin-Ⅴ阳性表达的囊泡即为M-MPs与FC-MPs。
1.2.3 不同来源LMPs的数量及标志物的差异
1.2.3.1 微粒计数 取10 μL M-MPs与FC-MPs悬液,加入5 μL Annexin-Ⅴ避光孵育20 min后加入10 μL的绝对计数微球与90 μL的PBS,充分混匀后上机检测,分别计算FC-MPs与M-MPs个数[6],n=3。绝对计数微球设门见图1。

图1 绝对计数微球设门
1.2.3.2 M-MPs与FC-MPs标志物 各取10 μL M-MPs与FC-MPs加入5 μL Annexin-Ⅴ与CD11b(巨噬细胞特征性蛋白)[15]避光孵育20 min后流式细胞仪检测,n=5。
1.2.4 不同来源的LMPs与巨噬细胞结合的示踪实验 计数后将微粒悬液浓度调整为1×109个/mL,加入PKH26荧光染料避光孵育10 min,4 ℃、16 000 g离心40 min,弃掉多余染料,取沉淀,用RPMI 1640培养基重悬后加入诱导好的M0型巨噬细胞爬片中培养24 h,PBS洗3遍,4%细胞固定液固定15 min后再次用PBS洗3遍后DAPI封片,激光共聚焦于561 nm波长下观察并拍照[16]。
1.2.5 不同来源LMPs对巨噬细胞极化的影响 将M-MPs和FC-MPs分别通过绝对计数微球测得浓度,并将两种LMPs浓度调整为1×106个/mL、1×107个/mL及1×108个/mL,加入提前诱导好的M0型巨噬细胞中,对照组只加RPMI 1640培养基。实验分为3组:对照组、M-MPs组(1×106M-MPs组、1×107M-MPs
组及1×108M-MPs组)、FC-MPs组(1×106FC-MPs组、1×107FC-MPs组及1×108FC-MPs组)。24 h后收集各组巨噬细胞,3 000 r/min离心5 min(2次),取沉淀用200 μL的PBS重悬后加入5 μL人Fc-block避光封闭10 min,再加入CD11b、CD11c、CD206抗体(CD11b+CD11c+CD206-为M1亚型,CD11b+CD11c-CD206+为M2亚型)[15,17-20]避光孵育20 min,孵育结束后再次以3 000 r/min离心5 min洗脱未结合的抗体,加入200 μL PBS重悬巨噬细胞,流式细胞仪检测各组巨噬细胞的表型。
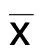
2 结 果
2.1 巨噬细胞和泡沫细胞的诱导及鉴定 正常THP-1细胞为悬浮生长的圆形细胞,经PMA诱导24 h后分化为贴壁的圆盘形或梭形等多形态的巨噬细胞。详见图2A、2B。对诱导后的细胞进行CD68免疫组化鉴定,结果显示,巨噬细胞细胞质CD68抗原特异性染成棕黄色,为阳性反应,空白对照组无特异性染色。详见图2C、图2D。由此可以看出,THP-1在PMA诱导24 h后分化为巨噬细胞。对泡沫细胞及同期生长的巨噬细胞进行油红O染色,两组细胞比较可见泡沫细胞内有大量红色脂质颗粒,巨噬细胞不着色。详见图2E、2F。说明80 μg/mL ox-LDL诱导48 h可将巨噬细胞诱导为泡沫细胞。
2.2 不同来源的LMPs大小及形态鉴定 微粒是直径在100~1 000 nm的微小囊泡,为明确实验所获得的沉淀是否是微粒,本研究使用流式细胞仪对其进行鉴定,圈定100~1 000 nm的区域为微粒的门。微粒在形成过程中会有大量的磷脂酰丝氨酸外翻,是微粒表面表达的特异性标志物,可作为微粒鉴定的标准之一,因此,选择Annexin-Ⅴ标记微粒。流式结果显示,在100~1 000 nm的门中,存在大量Annexin-Ⅴ阳性表达的囊泡。详见图3。以上结果可说明离心获取的沉淀为微粒。

图2 巨噬细胞和泡沫细胞的鉴定
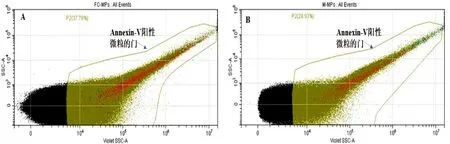
图3 MPs大小鉴定
2.3 M-MPs与FC-MPs数量及标志物的差异
2.3.1 M-MPs与FC-MPs数量的差异 用Annexin-Ⅴ标记微粒后结果显示:与巨噬细胞相比较,相同培养条件下泡沫细胞能够产生更多数量的FC-MPs,M-MPs平均数量为3.4×106个/μL,FC-MPs平均数量为6.9×106个/μL,差异有统计学意义(P<0.05)。详见图4。
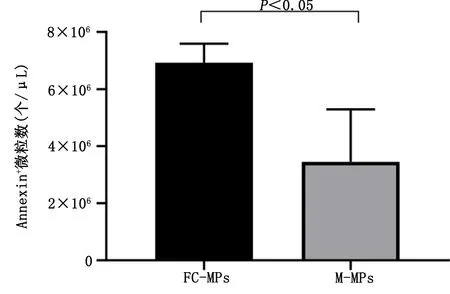
图4 FC-MPs与M-MPs数量比较
2.3.2 M-MPs和FC-MPs标志物CD11b的表达 用Annexin-Ⅴ+CD11b+标记巨噬细胞来源的微粒。相同浓度的M-MPs与FC-MPs进行比较后发现,FC-MPs虽有升高,但M-MPs和FC-MPs的CD11b水平差异无统计学意义(P>0.05),详见图5。
2.4 不同来源的LMPs与巨噬细胞结合示踪结果 在激光共聚焦显微镜下观察发现,用红色荧光染料标记的M-MPs和FC-MPs均与巨噬细胞紧密接触或已进入巨噬细胞内,提示两种微粒均与巨噬细胞发生作用。详见图6。

图5 M-MPs与FC-MPs的CD11b表达水平比较
图6 不同来源的LMPs与巨噬细胞结合示踪结果(×400)
2.5 不同来源LMPs对于巨噬细胞表型的影响
2.5.1 M-MPs对巨噬细胞表型的影响 不同亚型的巨噬细胞表面携带的标志物有明显异同,CD11b+CD11c+CD206-为巨噬细胞M1亚型,CD11b+CD11c-CD206+为巨噬细胞M2亚型。与对照组相比,1×107个/mL和1×108个/mL浓度M-MPs诱导的巨噬细胞M1型百分比明显升高,差异有统计学意义(P<0.01)。且1×107个/mL组和1×108个/mL组M1型百分比高于1×106个/mL组(P<0.01)。M-MPs诱导的巨噬细胞M2型百分比与对照组相比,差异无统计学意义(P>0.05);但1×108个/mL组较对照组有降低趋势(P=0.085)。与对照组巨噬细胞M1/M2比值相比,M-MPs 3个浓度组的M1/M2比值差异均无统计学意义(P>0.05),但1×108个/mL组较对照组M1/M2比值有升高趋势(P=0.077)。详见表1、图7。
2.5.2 FC-MPs对巨噬细胞表型的影响 与对照组比较,FC-MPs的1×107个/mL和1×108个/mL两个浓度所诱导的巨噬细胞M1亚型百分比明显增高(P<0.05)。与FC-MPs 1×106个/mL组相比,1×107个/mL和1×108个/mL FC-MPs组M1型巨噬细胞有明显升高趋势(P=0.057,P=0.053)。FC-MPs的3个浓度组均可使M2型巨噬细胞百分比降低,且FC-MPs 1×108个/mL浓度组与对照组比较差异有统计学意义(P<0.05)。在M1/M2比值方面,FC-MPs 1×108个/mL组具有明显的升高作用且有独特的优势,1×108个/mL组的M1/M2比值与对照组、1×106个/mL组及1×107个/mL组相比均明显升高,差异均有统计学意义(P<0.01)。详见表1、图8。
2.5.3 相同浓度的M-MPs与FC-MPs对巨噬细胞亚型的影响 对同一浓度下M-MPs与FC-MPs诱导的巨噬细胞M1、M2及M1/M2比值相比较发现,同一浓度下FC-MPs诱导的M2型巨噬细胞百分比更低,M1/M2比值更大,但差异无统计学意义(P>0.05)。详见表1。
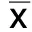
表1 不同来源的LMPs对巨噬细胞表型的影响(±s,n=5)
④P<0.05,⑤P<0.01。

图7 不同浓度的M-MPs对巨噬细胞亚型表达的影响
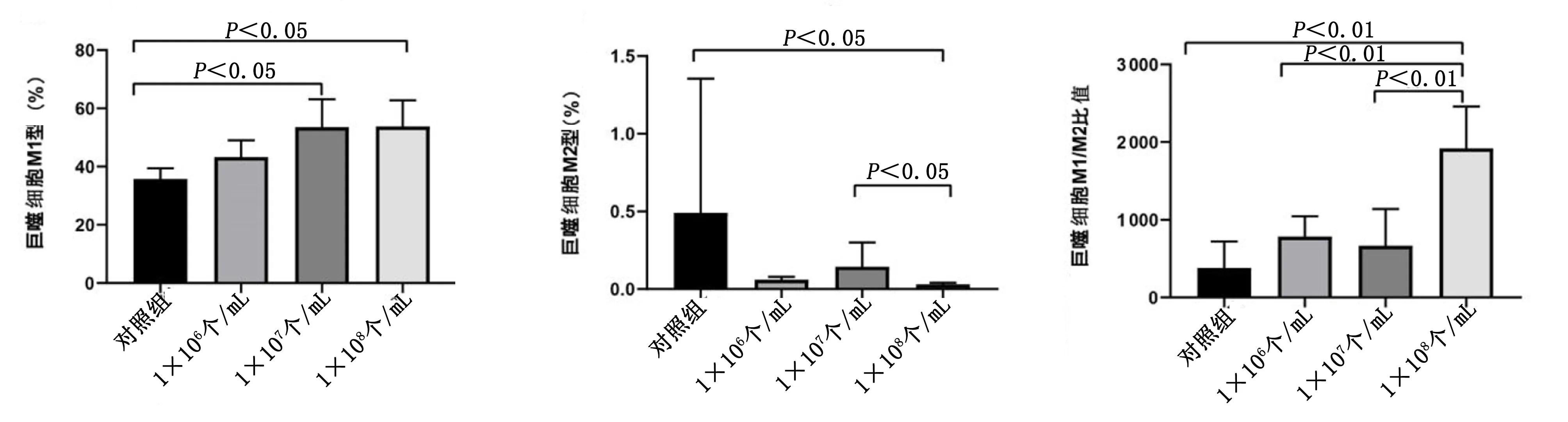
图8 不同浓度的FC-MPs对巨噬细胞亚型表达的影响
3 讨 论
微粒可由白细胞、红细胞、血小板、内皮细胞、平滑肌细胞和肿瘤细胞等几乎所有细胞产生,并释放到血浆、尿液、汗液、唾液、泪液等不同体液和体外培养细胞的培养基中,是一种新型的“液体活检”指标[2,21],在肿瘤、心血管疾病、糖尿病和肾病方面得到广泛研究。查阅文献可知,目前研究较多的内皮细胞微粒、血小板微粒和LMPs均可导致AS,而AS是多种心血管疾病发生发展的病理基础[1,22-24]。
LMPs来源于粒细胞、单核/巨噬细胞和淋巴细胞,具有促进炎症反应、修饰内皮功能、促凝血、促进血栓形成及促进易损斑块内新生血管形成的作用[5,25],几乎参与AS形成的所有阶段。在AS的发生发展过程中,当巨噬细胞内的胆固醇流入增加、清除减少时,巨噬细胞会转化为泡沫细胞,产生大量的炎症因子如肿瘤坏死因子(TNF-α)、前列环素E2(PGE2)、白细胞介素-6(IL-6)、白细胞介素-1β(IL-1β)和白细胞介素-18(IL-18)[26-27],同时释放微粒,微粒又可继续刺激巨噬细胞与泡沫细胞产生更多的微粒和炎性因子,形成恶性循环,加重AS的病变[28]。在本研究中,巨噬细胞和泡沫细胞均能产生大量的微粒,泡沫细胞产生的微粒平均数量为6.9×106个/μL,而巨噬细胞产生的微粒平均数量为3.4×106个/μL,数量相差2倍。Niu等[6]研究发现,AS病人血浆中的白细胞来源的细胞外囊泡数量显著高于正常人;体外实验发现,巨噬细胞源性泡沫细胞产生的囊泡比正常巨噬细胞多;Krankel等[29]研究也发现了类似的结果。由于微粒是在细胞活化或凋亡时产生的,所以,这种数量上的差异可能与巨噬细胞和泡沫细胞的活化状态有关,预示着FC-MPs具有更强的致炎性。
已知微粒携带来源于其母细胞的DNA、RNA、受体和特异性蛋白,主要通过膜融合、内吞、配体与受体结合的方式作用于靶细胞,影响靶细胞的功能,参与多种病理生理过程[21,30]。本研究使用PKH26染料分别标记M-MPs及FC-MPs后与巨噬细胞共培养24 h后发现,M-MPs和FC-MPs均可与巨噬细胞紧密接触或已进入巨噬细胞内,提示两种微粒均与巨噬细胞发生结合,而这种结合是M-MPs和FC-MPs对巨噬细胞产生作用的基础。但微粒具体是通过何种方式与巨噬细胞结合还需要进一步的研究,如采用活细胞成像技术对微粒与巨噬细胞的结合过程进行动态观察。
研究发现,AS斑块中存在促炎型巨噬细胞(其亚型有M1型、M4型和Mox型)和抗炎型巨噬细胞[其亚型有M2型、M(Hb)型和Mhem型],两类亚型分别以M1型(经典活化型)和M2型(替代活化型)为主要代表[7-8]。M1型巨噬细胞大量分泌IL-6、IL-1β、TNF-α、白细胞介素-23(IL-23)、白细胞介素-12(IL-12)等炎性因子,促进AS发展;M2型巨噬细胞表达和分泌高水平的白细胞介素-10(IL-10)、CD163、DC-SIGN(CD209)、清道夫受体、甘露糖受体(CD206)和精氨酸酶,抑制炎症反应,促进组织修复,稳定斑块[8]。M1型和M2型巨噬细胞之间的动态平衡,不仅决定了炎症的最终转归,而且与AS斑块的稳定性和疾病的轻重程度密切相关[7]。
查阅文献得到巨噬细胞共表达的表型标记物有CD45、CD11b、CD86、CD14和CD68等,M1型巨噬细胞表型标记物有CD11c、IL-6、IL-12和TNF-α等,M2型巨噬细胞标记物有CD206、CD16、IL-4受体α链(IL-4Rα)和IL-10等[15,17-20]。因此,本研究采用CD11b+CD11c+CD206-和CD11b+CD11c-CD206+分别作为M1型和M2型巨噬细胞的表面标记物[15,17-20]。结果显示,M-MPs与FC-MPs均可诱导巨噬细胞向促炎表型,即M1型极化,说明两种微粒均可促进炎症过程,加重AS的发展。同时FC-MPs比M-MPs更能抑制巨噬细胞向M2型极化,巨噬细胞M2型表达降低意味着其抑制炎症反应、稳定斑块的功能下降,且FC-MPs导致巨噬细胞M1/M2型比值更高、失衡更明显。有文献报道,泡沫细胞产生的细胞外囊泡(FC-EVs)与巨噬细胞产生的细胞外囊泡(M-EVs)之间有269个蛋白具有差异,其中FC-EVs的大部分差异是由于表达增加导致的[6]。而微粒属于细胞外囊泡的一类,同样携带有其母细胞的遗传信息及蛋白质等物质,Garzetti等[31]对M1型和M2型巨噬细胞产生的微粒内容物进行研究发现,M1型和M2型巨噬细胞来源的微粒携带不同的mRNAs,可诱导巨噬细胞极化为与微粒母细胞相同的表型。这些结果提示M-MPs与FC-MPs的蛋白质或mRNAs表达的差异性可能是造成二者导致巨噬细胞极化程度不同的原因。
综上所述,本研究通过THP-1细胞诱导巨噬细胞与泡沫细胞,分别提取二者产生的微粒诱导巨噬细胞,观察M-MPs与FC-MPs对巨噬细胞极化的影响。结果发现,两种微粒均可与巨噬细胞结合,促进巨噬细胞向M1型极化,说明M-MPs与FC-MPs均可促进巨噬细胞向促炎型转化,促进炎症反应。但相同条件下,泡沫细胞能够比巨噬细胞产生更多的微粒,且FC-MPs抑制巨噬细胞向M2型极化更显著,说明FC-MPs数量更多,抑制抗炎作用和促进M1/M2型失衡更明显,预示着FC-MPs具有更高的促炎效能。以上结果提示,在进行AS的研究中,多种因素可以促进巨噬细胞极化,除传统病理因素外,LMPs是非常强的影响巨噬细胞极化的因素,为LMPs作为AS的临床标志物提供了实验依据。同时LMPs中代表性的M-MPs和FC-MPs的作用既有联系又有区别,在临床与基础研究中要特别关注FC-MPs在AS中的独特作用和价值。
