芍药苷抑制NF-κB/YY1信号通路改善TNF-α诱导人脐静脉内皮细胞炎症反应的实验研究
2020-12-21范晓迪史大卓白瑞娜
陈 莉,范晓迪,史大卓,白瑞娜
血管内皮损伤是高血压[1]、脑梗死[2]、冠心病[3]等多种心脑血管疾病的共同病理基础,为动脉粥样硬化(atherosclerosis,AS)病变的起始阶段。内皮细胞损伤可引起白细胞黏附聚集、血小板活化、炎症介质和炎性因子释放及血栓形成等多种病理改变[4-5]。因此,保护血管内皮功能成为防治动脉粥样硬化性疾病的重要研究方向。既往研究显示,核因子-κB(NF-κB)活化可诱导内皮细胞的炎症反应,加剧血管内皮损伤,促进AS的发生发展[6-7]。YY1为锌指蛋白家族亚组成员之一的多功能转录因子,在炎症反应和免疫反应中发挥着重要作用[8-9]。NF-κB可通过结合到YY1的启动区以调控其表达,发挥促AS的作用[10]。前期研究表明,NF-κB/YY1信号通路在血管内皮炎症反应过程中发挥着重要作用。芍药苷是从赤芍中提取的单体成分,属于单萜类化合物。现代药理研究显示,芍药苷具有抗炎、抗氧化应激、抗血小板聚集、抗血栓等多种生物学活性,临床中广泛应用于心脑血管疾病的防治[11-13]。有研究显示,芍药苷可通过抑制NF-κB信号通路改善炎症反应,但其具体作用机制仍有待进一步研究[14]。基于此,本研究构建肿瘤坏死因子-α(TNF-α)诱导的人脐静脉内皮细胞(HUVECs)损伤的体外模型,探讨芍药苷对血管内皮细胞的保护作用及对NF-κB/YY1信号通路的影响,以期为防治动脉粥样硬化性疾病提供客观依据。
1 材料与方法
1.1 实验材料 HUVECs细胞株购自美国ScienCell公司(货号:8000)。TNF-α 购自美国PeproTech公司(批号:300-01A),双氧水充分溶解,0.22 μmol/L孔径滤膜过滤,配成20 ng/mL的母液,-20 ℃冰箱分装保存备用。芍药苷(批号:CP8129)购自中国碧云天公司,纯度>98%。将48 mg芍药苷溶解于500 μL的二甲基亚砜(DMSO)中,充分溶解,过滤,配成200 μmol/L母液,-20 ℃冰箱分装保存备用,实验前用培养液稀释成所需浓度。内皮细胞培养基(ECM,批号:#1001)、胎牛血清(批号:#0025)、内皮细胞生长因子添加物(批号:#1052)均购自美国ScienCell公司。胰蛋白酶(trypsinase,批号:SH40003.01)、磷酸缓冲盐溶液(PBS,批号:SH30256.01)均购自美国life sciences公司。Trizol Reagent(批号:#15596018)购自美国Life Technologies公司。BCA蛋白测定试剂盒(批号:P0012)购自中国碧云天公司。细胞毒性活性检测试剂盒(CCK-8,批号:CK04)购自东仁化学科技(上海)有限公司。白细胞介素-6(IL-6)试剂盒(批号:EK1062)、白细胞介素-8(IL-8)试剂盒(批号:EK1082)均购自中国联科生物科技有限公司。M-MLV反转录试剂盒和Agarose均购自Promega公司(批号:131819)。Real-time PCR扩增试剂盒(批号:18570700)购自中国中原领先科技有限公司。Anti-NF-κB p65抗体(ab32536)、Anti-YY1抗体(ab109237)、Anti-COX-2抗体(ab179800)均购自美国ABcam生物科技有限公司。actin抗体(批号:TA-09)、辣根酶标记山羊抗兔lgG(H+L,批号:ZB-2301)均购自北京中杉金桥生物技术有限公司。实时荧光定量聚合酶链反应(RT-PCR)仪购自美国ABI公司。数码凝胶成像系统购自BINTA公司。计算机图像分析仪(Image-Pro Plus Analysis Soft war)、Trans-blot sp cell型半干转印槽、Mini-PROTEAN Tetra Cell型电泳槽系统、PowerPac universal power supply型通用电泳仪电源均购自美国Bio-Rad公司。核酸紫外分光光度计购自Biophotometer公司。AE2000型倒置相差显微镜及成像系统购自中国麦克奥迪实业集团有限公司。Synergy H1型全自动酶标仪购自美国Bio Tek公司。
1.2 方法
1.2.1 HUVECs培养和干预 HUVECs用含5%胎牛血清、1%内皮细胞生长因子和1%的青链霉素的ECM培养液,于37 ℃、5%CO2细胞培养箱中培养。实验选取对数生长期的第4代~第7代细胞,以6 103个/mL的密度铺于96孔板中,孵育24 h,然后更换为无血清培养基继续培养24 h,最后分别加入不同浓度的TNF-α(0 ng/mL、10 ng/mL、20 ng/mL、40 ng/mL、80 ng/mL)和芍药苷(0 μmol/L、20 μmol/L、40 μmol/L、80 μmol/L、160 μmol/L、320 μmol/L)培养24 h,以确定TNF-α造模浓度和芍药苷的干预浓度。
1.2.2 实验分组 实验分为4组:空白对照组、模型组、中剂量芍药苷组、高剂量芍药苷组。空白对照组为正常培养的HUVECs,模型组加入20 ng/mL TNF-α干预24 h,中剂量芍药苷组和高剂量芍药苷组提前2 h分别给予芍药苷(80 μmol/L或160 μmol/L),再加入TNF-α 20 ng/mL共同干预24 h,进行后续实验。
1.2.3 CCK-8法检测HUVECs增殖活性 取对数生长期的HUVECs,用培养基制成单细胞悬液,以每孔细胞密度为6 103个/mL、培养液100 μL接种于96孔培养板中,每组设置6个复孔,按1.2.1实验步骤干预24 h后,吸去培养液,每孔加入含10%CCK-8溶液的100 μL培养液,于37 ℃、5%CO2培养箱中培养2 h后,在酶标仪450 nm波长检测吸光度值(A),以每组6个复孔吸光度值计算各浓度组的均值。
1.2.4 酶联免疫吸附实验(ELISA)检测炎性因子IL-6、IL-8 取对数生长期的HUVECs,以6×103个/mL接种于96孔培养板中,先给予芍药苷预处理2 h,再给予TNF-α共同干预24 h后,收集细胞上清液至新的EP管中,300 g离心10 min,去除沉淀物,即刻检测。按ELISA试剂盒说明书进行操作。稀释标准品,每孔分别加入50 μL标准品稀释液及样品。各孔加入50 μL稀释的检测抗体封板室温孵育2 h,再加入100 μL稀释的辣根过氧化物酶标记的链霉素,室温孵育45 min,洗液后加入显色底物TMB及终止液。酶标仪570 nm波长检测OD值。
1.2.5 RT-PCR检测NF-κB和YY1基因表达 以6孔板培养细胞,每孔细胞密度为2×104个/mL,先给予芍药苷预处理2 h,再给予TNF-α共同干预24 h后,弃去上清液,用预温的PBS洗3次后,每孔加入800 μL Trizol裂解后收集细胞组织于离心管中,再分别加入氯仿200 μL、异丙醇500 μL提取细胞中RNA,核酸紫外分光光度计测定RNA纯度及浓度。M-MLV反转录试剂盒进行反转录。NF-κB正向引物:5′-GGGATGGCTTCTATGAGGCT -3′,反向引物:5′-CTGACTGATAGCCTGCTCCA -3′;YY1正向引物:5′-GTGTGGAGACACACAGATGC-3′,反向引物:5′-ACTGTGCTCCTCATTCCCAA-3′;GAPDH正向引物:5′-GGGTGTGAACCATGAGAAGT-3′,反向引物:5′-GACTGTGGTCATGAGTCCT-3′。采用相对定量2-△△CT法进行结果分析。
1.2.6 蛋白免疫印迹(Western Blot)法检测NF-κB、YY1、环氧化酶-2(COX-2)蛋白表达 取对数生长期的细胞,以2×105个/mL密度接种在60 mm的培养皿中,先给予芍药苷预处理2 h,再给予TNF-α共同干预24 h后,收集细胞于EP管中,每管加入100 μL高效RIPA裂解液,冰上裂解30 min后,提取总蛋白,然后按照BCA蛋白测定试剂盒说明书进行蛋白定量。取等量蛋白样品(每孔10 μg),进行10%聚丙烯酰胺凝胶电泳,半干转膜仪转膜,5%脱脂奶粉封闭1 h后剪膜,孵育NF-κB、YY1、环氧化酶-2(COX-2,1∶1 000)及β-actin(1∶500)一抗中,4 ℃孵育过夜;TBST洗5次,每次6 min,加入辣根酶标记山羊抗兔lgG(H+L)二抗(1∶3 000),室温孵育1 h,TBST洗5次,每次6 min,ECL发光液加到膜上反应,曝光,凝胶图像分析拍照并对凝胶条带信号强度进行半定量分析。采用Quantity One(BIORAD公司)软件测量各个显色条带的吸光度值。
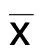
2 结 果
2.1 芍药苷对TNF-α诱导的HUVECs增殖活性的影响 CCK-8实验结果显示:与空白对照组相比,随着TNF-α剂量增加,其对HUVECs活力的抑制作用增强(P<0.01或P<0.001)。详见图1、表1。显著诱导炎性因子IL-6的表达,差异均有统计学意义(P<0.001)。详见图2、表2。根据TNF-α对细胞活力和IL-6表达的影响,本研究选择20 ng/mL TNF-α来诱导HUVECs的炎症反应,给予芍药苷提前干预2 h后,加用TNF-α(20 ng/mL)来诱导HUVECs炎症反应,结果显示:与空白对照组相比,芍药苷(80 μmol/L和160 μmol/L)能促进受损细胞的活力修复,差异有统计学意义(P<0.05)。详见图3、表3。因此,选取芍药苷80 μmol/L和160 μmol/L来观察其对TNF-α诱导的HUVECs的保护作用及可能机制。

与0 ng/mL组比较,*P<0.01,#P<0.001。
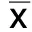
表1 不同浓度TNF-α诱导HUVECs活力比较(±s)

与0 ng/mL组比较,*P<0.001。
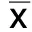
表2 不同浓度TNF-α诱导炎性因子IL-6表达水平比较(±s) 单位:ng/mL
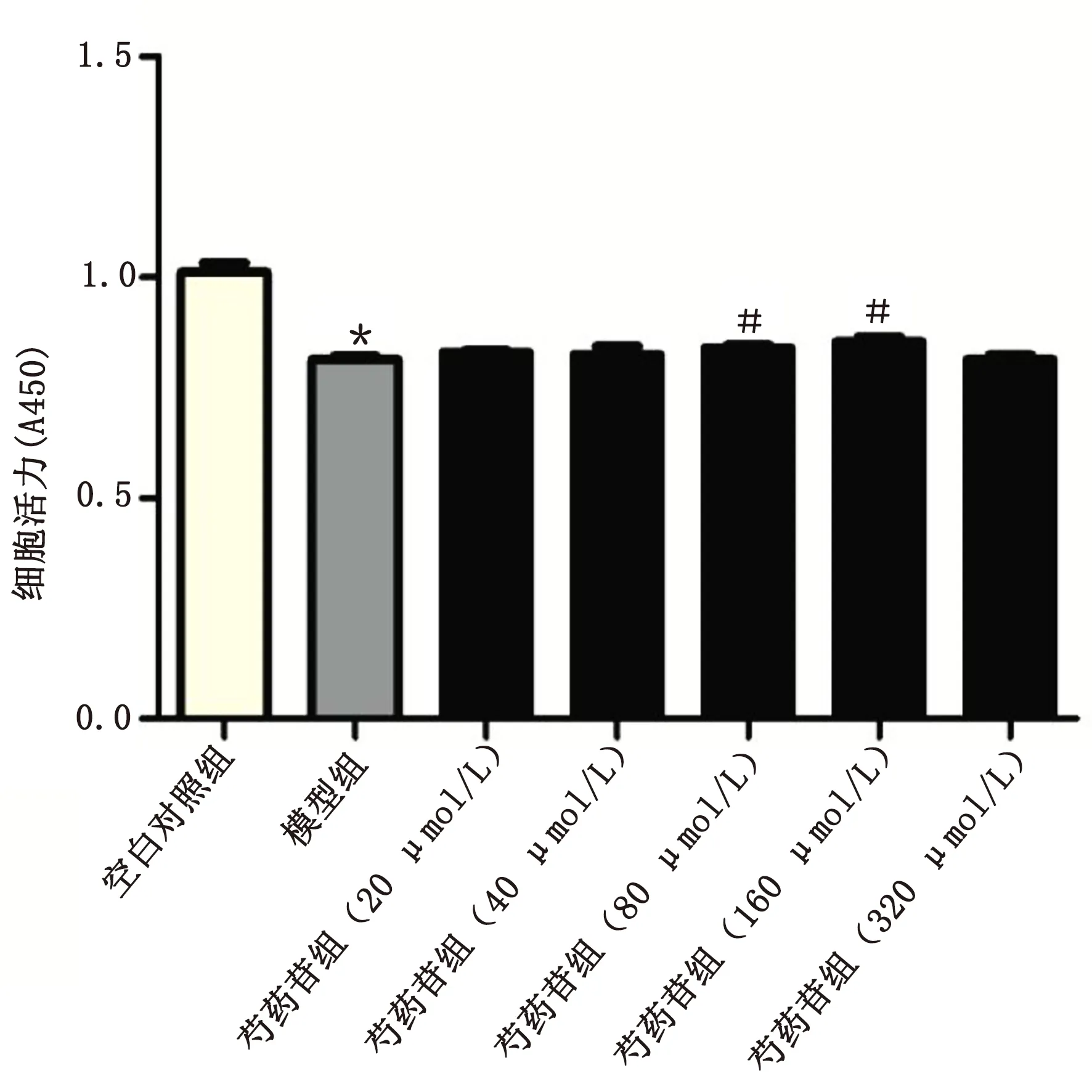
与空白对照组比较,*P<0.001;与模型组比较,#P<0.05。
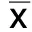
表3 不同浓度芍药苷对HUVECs活力的影响(±s)
2.2 芍药苷对HUVECs炎性介质IL-6、IL-8和COX-2表达的影响 ELISA实验结果显示:与空白对照组相比,模型组炎性因子IL-6、IL-8表达明显上升(P<0.001);与模型组相比,不同剂量的芍药苷预处理后,炎性因子IL-6和IL-8表达均下降,芍药苷高剂量组(160 μmol/L)下降更明显(P<0.01)。Western Blot实验结果显示:与空白对照组相比,模型组COX-2表达明显上调(P<0.001);与模型组相比,不同剂量的芍药苷预处理后,COX-2表达下调(P<0.01)。详见图4、表4。结果表明,芍药苷呈剂量依赖性抑制TNF-α诱导的HUVECs炎性因子和炎症介质的表达。

与空白对照组比较,*P<0.001;与模型组比较,#P<0.05,△P<0.01。
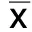
表4 各组IL-6、IL-8、COX-2水平比较(±s)
2.3 芍药苷对NF-κB和YY1 mRNA表达的影响 RT-PCR结果显示:与空白对照组相比,模型组NF-κB和YY1基因表达水平明显上调(P<0.001);与模型组相比,不同剂量芍药苷组NF-κB和YY1基因表达均明显下调(P<0.01),且高剂量芍药苷组的效果优于中剂量芍药苷组。详见图5、表5。结果表明,芍药苷能呈剂量依赖性抑制TNF-α诱导NF-κB和YY1基因的表达。

与空白对照组比较, *P<0.001;与模型组比较,#P<0.01。
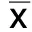
表5 各组NF-κB、YY1 mRNA表达水平比较(±s)
2.4 芍药苷对HUVECs细胞NF-κB和YY1蛋白表达的影响 与空白对照组比较,模型组NF-κB和YY1蛋白表达水平均明显升高(P<0.01);与模型组比较,不同剂量芍药苷组,NF-κB和YY1蛋白表达水平均明显降低(P<0.05或P<0.01)。芍药苷呈剂量依赖性抑制NF-κB和YY1的蛋白表达,说明芍药苷可从蛋白水平抑制NF-κB/YY1信号通路的活化,从而发挥抑制炎症反应的作用。详见表6、图6。
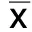
表6 各组NF-κB、YY1蛋白表达水平比较(±s)

与空白对照组比较,*P<0.01;与模型组比较,#P<0.05,△P<0.01。
3 讨 论
AS是多种心脑血管疾病的主要病理基础,炎症反应贯穿AS发生发展的始终[15]。研究发现,AS进程中炎症反应、血小板黏附聚集和血栓形成与中医学“血脉瘀阻”理论密切相关[16-17]。在此认识的指导下,形成了理气活血化瘀、益气活血化瘀和温阳活血化瘀等系列治法和有效方药[18-19]。基于此,深入研究活血化瘀中药对AS进程中血管内皮炎症反应保护作用的可能机制,有助于为临床应用活血化瘀中药治疗动脉粥样硬化性疾病提供可靠依据。
NF-κB是Rel家族的转录因子,通过对靶基因的调控参与机体的炎症反应和免疫应答,其中NF-κB p65亚单位是NF-κB家族中参与炎症反应的主要成员之一,在炎症反应中发挥着重要作用[20-21]。YY1为多功能的转录因子,通过与特异性DNA序列结合以调控下游基因的表达[22-23]。IL-6是重要的促炎因子之一,不仅能够诱导C-反应蛋白(CRP)、血清淀粉样蛋白和纤维蛋白原的合成,而且能促进急性炎症反应的发展[24-25]。IL-8属于CXC趋化因子家族成员之一,能够诱导中性粒细胞的黏附、促进内皮细胞的迁移和泡沫细胞的形成,发挥促AS的作用[26-27]。环氧化酶(COX)是前列腺素合成所必需的酶,通过促进炎症反应而诱导动脉粥样硬化性疾病的发生发展[28]。COX-2为重要的环氧化酶之一,在内皮细胞和巨噬细胞的炎症反应中都有表达[29]。前期研究发现,NF-κB/YY1信号通路是重要的炎症相关通路之一,能够参与调控内皮细胞的炎症反应。Zhou等[30]发现,NF-κB、YY1与长链非编码RNA(ANRIL)作用可调控下游炎性因子IL-6、IL-8的表达。有研究发现在脂多糖(LPS)诱导的炎症反应中,YY1可结合到COX-2的启动区以调控其表达[31]。
芍药苷是活血化瘀中药芍药最主要的活性成分之一,具有抗炎、抗AS、抗血栓等作用[32-33]。Jin等[34]发现芍药苷可通过抑制TNF-α诱导的NF-κB活化来抑制细胞间黏附因子-1(ICAM-1)的表达,进而减轻炎症反应。Zhu等[35]在高糖诱导的炎症反应模型中发现,芍药苷可通过抑制Toll样受体4(TLR4)/NF-κB信号通路来减轻基质金属蛋白酶-9(MMP-9)的表达,抑制炎症反应。Gu等[36]建立三硝基苯磺酸(TNB-S)诱导的溃疡性结肠炎小鼠模型,给予芍药苷干预后发现,芍药苷可抑制炎性因子白细胞介素-2(IL-2)、IL-6、白细胞介素-1β(IL-1β)和TNF-α的表达,该抗炎作用与抑制丝裂原活化蛋白激酶(MAPK)/NF-κB信号通路相关。Zhang等[37]研究发现在细菌脂蛋白(BLP)诱导单核细胞系(THP-1)细胞的炎症反应过程中,芍药苷可通过抑制NF-κB信号通路的转导发挥抗炎作用。Guo等[38]通过用芍药苷干预缺血损伤的小鼠模型发现,芍药苷可通过抑制MAPK/NF-κB信号通路发挥抑制炎症反应的作用。本研究基于NF-κB/YY1信号通路观察芍药苷对炎性因子和炎症介质表达的抑制作用,以阐述芍药苷可抑制炎症反应而发挥抗动脉粥样硬化性疾病的作用,为活血化瘀中药在临床的运用提供客观依据。
本研究通过构建TNF-α诱导的HUVECs炎症反应和不同剂量芍药苷对其干预效应的研究,结果提示:模型组IL-6、IL-8和COX-2表达明显高于空白对照组,给予不同浓度的芍药苷干预后IL-6、IL-8和COX-2表达降低,其中芍药苷高剂量组干预效果更加明显。研究还发现,芍药苷可抑制NF-κB和YY1表达,减轻内皮细胞的炎症反应。提示活血化瘀中药活性成分芍药苷呈剂量依赖性降低炎性因子的表达和炎症介质的释放,从而发挥保护血管内皮功能的作用。
综上所述,TNF-α可诱导HUVECs的炎症反应,芍药苷可通过抑制NF-κB/YY1信号通路的活化以减少炎性因子IL-6、IL-8的表达和炎症介质COX-2的活化,进而发挥抗炎、抑制AS进展的作用。这可能是活血化瘀中药治疗AS的作用机制之一。
