二氢杨梅素减轻氧糖剥夺/再灌注所致的神经元氧化应激损伤及机制
2020-12-21李娜,曹翔
李 娜,曹 翔
脑卒中具有高发病率、高致残率和高死亡率等特点,严重危害人类健康。缺血性脑卒中约占全部卒中的80%左右,目前临床上唯一公认有效的血管内再通治疗因时间窗和并发症的限制,只有不到4%的患者从中获益[1]。因此,研究新的治疗靶点和方法尤为重要。
氧化应激已被证实是影响缺血性脑卒中预后的重要因素之一[2]。降低氧化应激水平可以显著减轻脑损伤[3,4]。缺血性脑卒中发生后,活性氧(reactive oxygen species,ROS)和脂质过氧化产物(malonaldehyde,MDA)过度产生,内源性抗氧化酶如超氧化物歧化酶(superoxide dismutase,SOD)等活性下降,导致抗氧化防御系统的清除能力无法发挥作用,这些对神经元等细胞造成巨大损害[5,6]。因此,寻找可以抑制氧化应激的药物,将成为有效治疗缺血性卒中的策略。二氢杨梅素(ampelopsin,Amp)是从藤茶中提取的一种黄酮类化合物,具有抗肿瘤、抗炎症等多种作用[7,8]。近期有研究发现二氢杨梅素具有改善阿尔茨海默病大鼠的记忆损伤,可能是通过抑制神经炎症和氧化应激反应,但具体的机制和作用的靶点不明[9]。对于二氢杨梅素是否可以减轻缺血再灌注造成的神经元氧化应激损伤,尚未见文献报道。
本实验通过建立体外神经元细胞氧糖剥夺/再灌注(oxygen-glucose deprivation/reoxygenation,OGD/R)模型来模拟体内缺血再灌注损伤,研究二氢杨梅素对神经元氧化应激损伤的影响。
1 材料和方法
1.1 试剂 二氢杨梅素(CAS号27200-12-0,纯度98%)购自美国Sigma公司,CCK-8试剂盒、活性氧检测试剂盒、SOD活性检测试剂盒、MDA检测试剂盒购自碧云天公司。Nrf2、HO-1、Lamin B、GAPDH抗体以及对应种属的二抗均购自美国Cell Signaling公司。Neurobasal、无糖DMEM细胞培养基、B27血清类似物购自美国Gibco公司。
1.2 大脑皮质神经元原代培养 实验方法参考之前研究[10],简述如下:取15~17 d龄的C57BL/6胎鼠脑组织,尽可能的去掉所有的血管和血管膜,分离大脑皮质并剪碎,胰蛋白酶消化10 min后接种于经多聚赖氨酸包被的含B27的Neurobasal培养基的细胞培养皿中,置于37 ℃、CO2体积分数为5%的培养箱中常规培养。每2~3 d半换液。利用特异性抗体MAP-2检测,阳性率大于95%后可用于后续实验。
1.3 OGD/R模型建立及给药方式 取生长至10 d的成熟原代皮质神经元,将培养基替换成不含葡萄糖的DMEM培养基后再将细胞培养皿放入缺氧小室中。小室内充入95%N2和5%CO2的混合气10 min,将阀门密封后将小室在37 ℃下孵育20 min(氧糖剥夺阶段)。最后将细胞培养皿取出,更换正常神经元培养基,常规培养24 h(再灌注阶段)用于后续实验。对照细胞一直在正常培养基和环境中培养。二氢杨梅素溶于二甲基亚砜(Dimethyl sulfoxide,DMSO),于再灌注阶段开始时以适当浓度稀释于培养基中,作用神经元。
1.4 CCK-8法检测细胞活性 将96孔板中成熟的原代神经元细胞OGD处理,再灌注时与不同浓度二氢杨梅素共孵育24 h,然后每孔加入10 μl CCK-8工作液,37 ℃孵育2 h后置于450 nm波长下检测吸光度值。实验重复3次,每组实验设3个复孔,取平均值进行统计分析。
1.5 细胞ROS水平检测 将OGD/R和药物处理完毕的神经元细胞用PBS洗3次,加入终浓度为10 μmol/L的 DCFH-DA在37 ℃避光孵育30 min。待孵育结束后,再用PBS洗3次,于倒置荧光显微镜下观察各实验组ROS的表达水平。实验重复3次,每组实验设3个复孔,取平均值进行统计分析。
1.6 SOD活性和MDA含量测定 细胞处理结束,利用经典的氮蓝四唑显色法测定SOD活性,硫代巴比妥酸显色反应来定量检测MDA的含量。
1.7 细胞核质分离与免疫印迹 将OGD/R和药物处理完毕的细胞用预冷的PBS洗3遍,弃去PBS后加入细胞质裂解液(含蛋白酶抑制剂)冰上裂解30 min,接着用细胞刮板将细胞完全刮下,4 ℃ 12500 rpm/min离心30 min,上清为细胞质蛋白。沉淀部分再与细胞核裂解液冰上孵育20 min,同样离心方式得到的上清为核蛋白。BCA法定量每组样品后取等量蛋白上样,进行SDS-聚丙烯酰胺凝胶电泳。电泳后恒压转膜,接着用5%脱脂奶粉封闭1 h,4 ℃一抗孵育过夜。次日用相应种属来源的二抗室温孵育1 h,化学发光法显影,用Image J软件分析实验结果。

2 结 果
2.1 二氢杨梅素对神经元细胞活性及OGD/R后细胞存活率的影响 研究发现,二氢杨梅素在150 μg/ml(大约是468 μmol/L)的浓度下对小鼠单核巨噬细胞系RAW264.7活力没有影响[11]。为了进一步检测二氢杨梅素对原代神经元细胞的毒性情况,我们运用CCK8法检测细胞活力,结果(见图1),与对照组相比,1~30 μmol/L的二氢杨梅素对原代神经元细胞活性影响无统计学差异(P>0.05),但是50 μmol/L的二氢杨梅素显著降低了神经元细胞活性(P<0.01)。接下来,我们继续观察是否二氢杨梅素可以降低OGD/R造成的神经元细胞死亡率。在OGD/R的一开始,我们加入0~30 μmol/L浓度的二氢杨梅素作用于原代神经元细胞24 h后,结果发现,20 μmol/L 和30 μmol/L的二氢杨梅素均显著提高了OGD/R造成的细胞死亡率(OGD/R+20 μmol/L Amp vs OGD,P<0.05;OGD/R+30 μmol/L Amp vs OGD,P<0.01)(见图1)。这些结果证明二氢杨梅素在其无药物毒性浓度的情况下表现出神经保护作用,并在30 μmol/L浓度下保护效果最佳,故我们以30 μmol/L的二氢杨梅素作为后续研究的药物浓度。
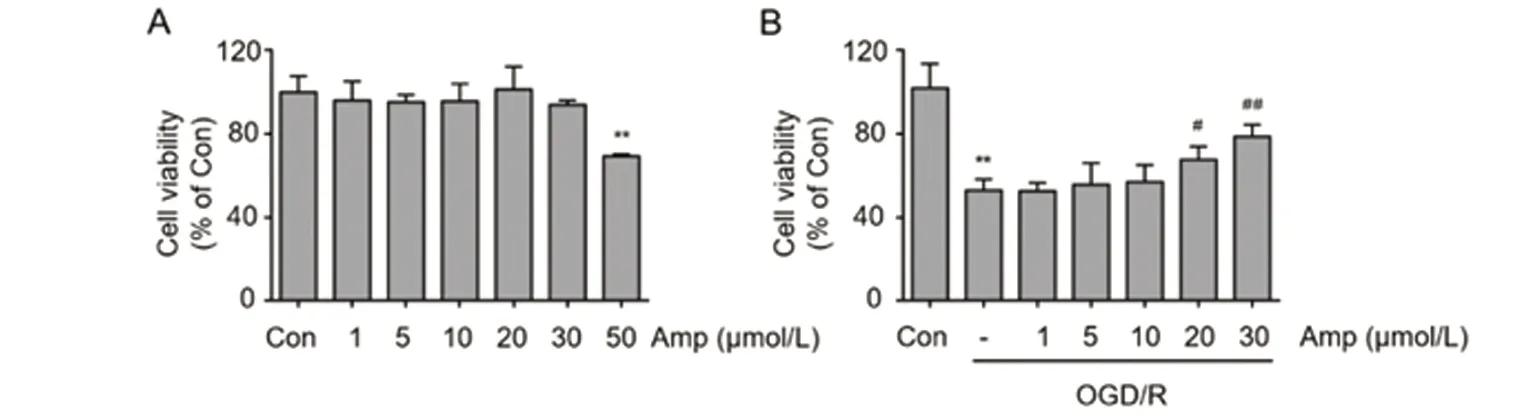
图1 二氢杨梅素对神经元细胞活性及OGD/R后细胞存活率的影响。与对照组比较**P<0.01;与OGD/R组比较#P<0.05, ##P<0.01
2.2 二氢杨梅素减少OGR/R引起的细胞内ROS表达 30 μmol/L的二氢杨梅素处理OGD/R的原代神经元细胞24 h,荧光显微镜检测细胞氧化应激产物ROS的表达后发现,对照组细胞的ROS表达量很低,而OGD/R刺激组,ROS含量显著增加(P<0.01),运用二氢杨梅素处理的神经元细胞ROS的表达水平明显降低(P<0.01),差异具有统计学意义(见图2)。
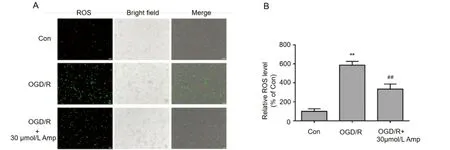
图2 二氢杨梅素减少OGD/R引起的神经元细胞内ROS表达。与对照组比较**P<0.01;与OGD/R组比较##P<0.01。标尺100 μm
2.3 二氢杨梅素对OGD/R神经元SOD活性和MDA含量的影响 在观察到二氢杨梅素可以减少ROS的产生后,我们进一步检测抗氧化酶SOD以及脂质过氧化产物MDA的表达水平。结果发现,与对照组相比,OGD/R组神经元SOD活性明显降低,而MDA水平显著增高。在二氢杨梅素处理组中,其显著提高了神经元细胞SOD的活性并降低MDA的含量(见图3)。

图3 二氢杨梅素对OGD/R所致神经元SOD活性和MDA含量的影响。与对照组比较*P<0.05,**P<0.01;与OGD/R组比较#P<0.05
2.4 二氢杨梅素对OGD/R神经元Nrf2/HO-1信号通路的影响 核因子E2相关因子(nuclear factor erythroid 2-related factor 2,Nrf2)/血红素氧合酶1(heme oxygenase 1,HO-1)通路在细胞氧化应激反应中起着关键的作用,其中HO-1是公认的具有抗氧化功能的分子,在许多疾病中起着重要的保护作用,而HO-1的表达是由Nrf2所诱导[12]。我们在这部分研究中观察二氢杨梅素是否能影响Nrf2/HO-1信号通路从而减轻OGD/R造成的氧化应激损伤。实验结果发现,二氢杨梅素的处理上调了HO-1的表达,同时增加Nrf2在细胞核中的表达,使得更多的Nrf2在核内发挥转录功能(见图4)。

图4 二氢杨梅素对OGD/R神经元Nrf2/HO-1信号通路的影响。与对照组比较*P<0.05,**P<0.01;与OGD/R组比较#P<0.05, ##P<0.01
3 讨 论
氧化应激在脑缺血再灌注造成的脑损伤过程中起着非常重要的作用[12]。氧化应激损伤发生后,脑细胞中的抗氧化物质被大量消耗,造成细胞内促氧化和抗氧化系统失衡,进而引起神经元细胞死亡。因此,增加细胞内的抗氧化物质、减少促氧化的产物生成是降低细胞氧化应激损伤的重要手段之一。
在我国南方,藤茶是一种功能性饮料,它具有多种生物学功能,而二氢杨梅素是藤茶的主要成分[13]。我们课题组前期的研究发现二氢杨梅素可以通过抑制小胶质细胞NF-κB与JAK2/STAT3信号通路发挥抗炎作用[8]。一项关于黄酮类化合物神经保护的研究中,已经证实二氢杨梅素能够通过血脑屏障发挥作用[14]。有研究表明,在阿尔茨海默症动物模型中,利用二氢杨梅素治疗不仅可以改善行为学缺损,还可改善γ氨基丁酸的转运,同时能够抑制神经炎症和氧化应激反应的发生[9,15]。然而,关于二氢杨梅素对缺血再灌注造成的神经元氧化应激损伤的作用知之甚少。本实验结果显示:二氢杨梅素可以显著提高体外OGD/R后的神经元细胞存活率,降低ROS水平,提高抗氧化酶SOD活性,并减少脂质过氧化物MDA的表达。这些提示我们,二氢杨梅素可以保护神经元对抗体外OGD/R造成的细胞死亡,这与其降低了氧化应激损伤有关。
Nrf2抗氧化通路在响应氧化应激的神经保护中发挥重要作用[12,16]。正常生理状态下,Nrf2位于细胞质中,不能进入细胞核发挥转录活性。当细胞受到外界刺激后,Nrf2会转移到细胞核中,与Maf蛋白形成异二聚体,并和抗氧化反应原件ARE结合从而激活包括HO-1在内的许多抗氧化酶的转录,共同抵御外来的有害刺激[17]。Nrf2的基因敲除小鼠与正常小鼠相比,抗氧化应激的效应明显减弱。HO-1作为Nrf2下游蛋白之一,实验证实其在短暂性全脑缺血模型、短暂和永久性大脑中动脉栓塞模型、以及光栓模型中的表达均是下调的[18,19]。HO-1基因敲除小鼠,脑梗死体积显著增大。提高HO-1的表达,则能够减轻缺血再灌注造成的脑损伤[20]。因此,在本研究中我们推测二氢杨梅素有效的降低ROS、MDA水平,促进SOD活性增强可能与Nrf2/HO-1抗氧化通路有关。于是,在接下来的实验中,我们利用免疫印迹技术检测了HO-1蛋白的表达,发现二氢杨梅素处理后可以增加OGD/R神经元细胞的HO-1表达。同时,实验结果还发现调控HO-1表达的Nrf2蛋白核质转移也受到影响,二氢杨梅素的处理导致了更多的Nrf2进入核内,具有转录更多抗氧化物质的潜力。
综上所述,二氢杨梅素抑制OGD/R所致的原代神经元细胞氧化应激损伤,可能是通过激活Nrf2/HO-1抗氧化通路来实现的。本研究进一步丰富了二氢杨梅素在缺血再灌注损伤的运用价值,并为缺血性脑卒中的治疗提供新的干预手段和实验基础。
