厚朴酚治疗重症急性胰腺炎大鼠模型并发急性肺损伤的作用机制
2020-12-21齐文杰曾亚薇谷培云
王 燕, 齐文杰, 曾亚薇, 谷培云, 苗 彬
1 首都医科大学附属北京友谊医院 感染内科, 北京 100050; 2 首都医科大学 研究生院, 北京 100069
重症急性胰腺炎(SAP)相关性肺损伤是SAP早期最常见、最严重的并发症,急性胰腺炎(AP)患者约1/3伴发急性肺损伤或急性呼吸窘迫综合征, 1周内死亡AP患者大约60%伴有急性肺损伤或急性呼吸窘迫综合征[1],而SAP死亡病例中有50%发生重度肺损伤[2]。研究[3]发现,引流胸导管淋巴液能够明显减少SAP病程中炎症因子释放。临床上通过大量补液以改善肠道缺血以及在疾病得到有效控制后及早进食以促进胃肠动力恢复,从而达到“功能性阻断”肠淋巴循环治疗AP。厚朴酚具有抑制炎症反应、缓解炎性疼痛等作用[4]。研究[5]发现,厚朴酚能够通过拮抗氧化应激和调控Cajal细胞改善脓毒症所致胃肠运动障碍。本实验从厚朴酚功能性阻断肠淋巴循环方面研究厚朴酚对 SAP并发急性肺损伤的治疗作用。
1 材料与方法
1.1 主要仪器和试剂 主要试剂:3.75%牛磺胆酸钠(美国Sigma公司)、戊巴比妥钠(德国默克公司)、厚朴酚(北京环亚泰克生物医学技术有限公司)、DMSO(北京环亚泰克生物医学技术有限公司)、蛋白裂解液( 北京普利莱公司)、蛋白酶抑制剂( 北京普利莱公司)等。主要仪器:DHG9070B电热鼓风干燥箱(上海安亭科学仪器有限公司)、Sigma3K-18高速低温离心机(美国Sigma公司)、QL-901旋涡混合器(江苏其林贝尔仪器制造有限公司)、XQ-04750-50匀浆机(美国Biospec公司)、BX43型光学显微镜(日本OLYMPUS公司)等。
1.2 动物模型构建与分组 雄性健康SD大鼠30只,体质量(300±50)g,购自北京维通利华实验动物技术有限公司[生产许可证号:SCXK(京)2016-0006,使用许可证号:SYXK(京)2017-0019)]。大鼠适应性饲养1周,术前12 h禁食,正常饮水。随机分为假手术组、SAP组和厚朴酚治疗组,每组各10只。假手术组为正常大鼠开腹翻动胰腺后直接缝合;SAP组采用逆行胰胆管注射3.75%的牛磺胆酸钠建立SAP大鼠模型;厚朴酚治疗组:经阴茎静脉注射厚朴酚0.2 mg/kg,15 min后,采用逆行胰胆管注射3.75%的牛磺胆酸钠建立SAP大鼠模型。SAP组及厚朴酚治疗组于造模后4 h经肠系膜淋巴管引流淋巴液、腹主静脉采血,后处死大鼠留取肺组织、肠组织,并保存于-80 ℃冰箱。假手术组同样时间点用上述方法留取肠系膜淋巴液、静脉血、肺和肠组织。
1.3 标本采集 自肠系膜淋巴管进行淋巴液引流至EP管中,置于-80 ℃保存。打开腹腔使用静脉采血针穿刺下腔静脉抽取血液4~5 ml,取上部血清,-20 ℃条件下保存,用于后期ELISA检测。取冷冻保存肠、肺组织约100 mg,每1 mg组织加入10 μl组织裂解液,置于冰上,进行充分匀浆。均浆液转移至1.5 ml无菌EP管中,12 000 r/min、4 ℃离心15 min,取上清液至另一1.5 ml无菌EP管中,备用于ELISA和Western Blot检测。
1.4 检测指标 ELISA检查肺、肠组织内二胺氧化酶(DAO)、D-乳酸(DLA)、IL-1β、IL-8、IL-10、TNFα、高迁移率族蛋白B1(HMGB1)、晚期糖基化终产物受体(RAGE)水平变化。Westrrn Blot方法检测淋巴液中Toll样受体4(TLR4)水平。对肺脏、胰腺及回肠进行组织学观察及病理评分[3,6]。造模后4 h,分别称取0.1 g肺组织放入培养皿中,将组织放入60 ℃干燥箱内72 h,重新称量组织干重。
1.5 伦理学审查 本实验方案经由首都医科大学附属北京友谊医院实验动物伦理委员会审批,符合实验室动物管理与使用准则。
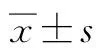
2 结果
2.1 病理检测结果
2.1.1 各组胰腺组织病理学改变 大鼠胰腺大体观察以及镜下观察均无明显异常;SAP 组大鼠胰腺大体观察时可见出血、坏死部分,同时腹腔内有大量血性积液(图1)。镜下观察:SAP组大鼠胰腺组织小叶间有明显水肿以及较大量的炎性细胞浸润,有出血及胰腺小叶结构破坏的情况,同时腺泡细胞有明显坏死(图2),证实SAP大鼠造模成功。
2.1.2 各组肺组织病理学改变 镜下观察(图3):假手术组肺组织病理无明显改变,病理评分0.34±0.02;SAP组肺间质可见充血、水肿、炎细胞浸润、出血,病理评分2.67±0.52;厚朴酚治疗组肺组织轻度出血和炎细胞浸润,病变程度较SAP组轻,病理评分1.50±0.55。3组间病理评分比较差异均有统计学意义(F=29.5,P<0.001),进一步两两比较,差异均有统计学意义(P值均<0.05)。根据大鼠肺组织病理可见SAP肺损伤模型制备成功。
2.1.3 各组肠组织病理学改变 假手术组肠组织大体形态未见明显异常;SAP组肠管扩张、充血、水肿,可见肠系膜皂化斑;厚朴酚治疗组大鼠肠管扩张、充血、水肿的程度减轻,肠系膜皂化斑范围减少(图4)。
镜下观察(图5):假手术组未见明显异常,病理评分0.33±0.02。SAP组可见肠间质水肿、充血、大量炎性细胞浸润,肠绒毛水肿增粗、高度缩短,绒毛上皮剥脱、上皮顶端片状坏死及脱落,杯状细胞排列紊乱、细胞数量减少;黏膜变薄,腺体排列稀疏,且数量减少,病理评分4.83±0.41。厚朴酚治疗组较SAP组病理损伤均有不同程度减轻,病理评分3.50±0.55。3组间比较差异有统计学意义(F=131.136,P<0.001),进一步两两比较,差异均有统计学意义(P值均<0.05)。
2.2 各指标ELISA检测结果
2.2.1 血清中各指标检测结果 3 组间IL-1β、IL-8、TNFα、DAO、DLA、HMGB1、RAGE水平比较差异均有统计学意义(P值均<0.05),进一步两两比较显示,厚朴酚治疗组血清中IL-1β、IL-8、TNFα、DAO、DLA、HMGB1、RAGE水平均低于SAP组(P值均<0.05);假手术组血清中IL-1β、IL-8、TNFα、DAO、DLA、HMGB1、RAGE水平均低于SAP组(P值均<0.05)(表1)。
2.2.2 淋巴液中各指标检测结果 3组间IL-1β、IL-8、TNFα、DAO、DLA、HMGB1、RAGE水平比较差异均有统计学意义(P值均<0.05),进一步两两比较显示,厚朴酚治疗组大鼠淋巴液中IL-1β、IL-8、TNFα、DAO、DLA、HMGB1、RAGE水平均低于SAP组(P值均<0.05);假手术组IL-1β、IL-8、TNFα、DAO、DLA、HMGB1、RAGE水平均低于SAP组(P值均<0.05)(表2)。
2.2.3 肠组织中各指标检测结果 3组间IL-1β、IL-8、TNFα、HMGB1、RAGE水平差异均具有统计学意义(P值均<0.05),进一步两两比较显示,厚朴酚治疗组IL-1β、IL-8、TNFα、HMGB1、RAGE均低于SAP组(P值均<0.05);假手术组IL-1β、IL-8、TNFα、HMGB1、RAGE水平均低于SAP组(P值均<0.05)(表3)。
2.2.4 肺组织中各指标检测结果 3组间IL-1β、IL-8、TNFα、HMGB1、RAGE水平比较差异均有统计学意义(P值均<0.05),进一步两两比较显示,厚朴酚治疗组大鼠肺组织中IL-1β、IL-8、TNFα、HMGB1、RAGE均低于SAP组(P值均<0.05);假手术组IL-1β、IL-8、TNFα、HMGB1、RAGE水平均低于SAP组(P值均<0.05)(表4)。
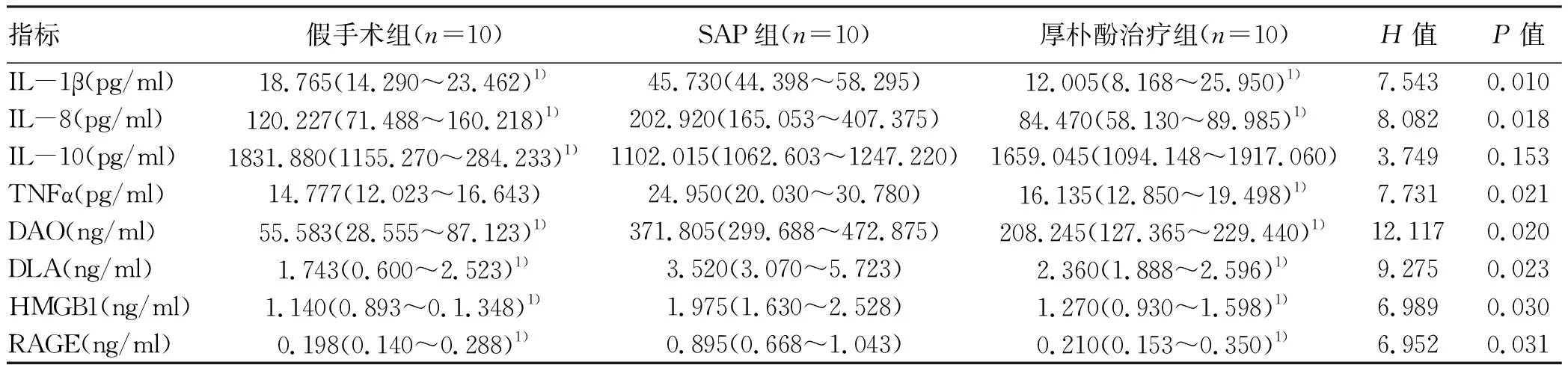
表1 2组大鼠血清中相关成分比较
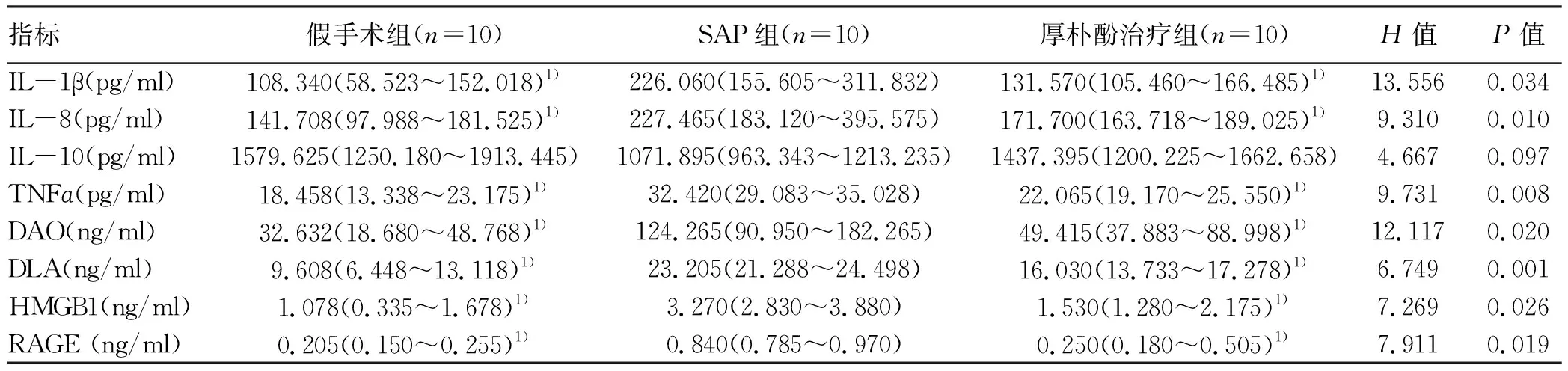
表2 2组大鼠淋巴液中相关成分比较

表3 2组大鼠肠组织中相关成分比较

表4 2组大鼠肺组织中相关成分比较
2.3 Western Blot检测淋巴液中TLR4水平 3组大鼠淋巴液中TLR4蛋白表达比较差异有统计学意义(厚朴酚治疗组 vs SAP组 vs 假手术组:0.405±0.022 vs 0.588±0.037 vs 0.302±0.194,F=170.536,P<0.01),进一步两两比较,厚朴酚组及假手术组均低于SAP组(P值均<0.05)(图6)。
2.4 肺湿/干重比 3组大鼠肺湿/干重比比较差异有统计学意义(厚朴酚组 vs SAP组 vs 假手术组:3.51±0.09 vs 4.64±0.15 vs 2.83±0.20,F=205.930,P<0.001),进 一步两两比较,SAP组高于厚朴酚治疗组及假手术组(P值均<0.05)。
3 讨论
SAP时由于体液的大量丢失,体内循环血流量明显减少,交感神经兴奋,使肠道血管发生强烈收缩,肠道缺血、缺氧,黏膜屏障功能破坏,细菌、内毒素易位入血,形成肠源性感染,导致中毒性肠麻痹、肠衰竭[7-8]。肠衰竭导致细菌、毒素吸收入血,肠道菌群移位,引发其他脏器的功能障碍。SAP相关性肺损伤是SAP早期最常见、最严重的并发症。
厚朴酚为厚朴提取物重要的单体成分之一,具有抗氧化、抗菌、抗内毒素、抗炎、抗肿瘤等药理作用,临床上主要用于炎症、细菌感染等疾病的治疗[9-10]。段金旗等[11]发现,厚朴酚能显著改善脓毒症大鼠肺组织结构,减少炎症细胞浸润,降低TNFα、IL-1β、IL-6,细胞间黏附分子1、巨噬细胞炎症蛋白2、丙二醛水平以及黄嘌呤氧化酶活性,提高超氧化物歧化酶及谷胱甘肽过氧化物酶活性,最终抑制脓毒症引起的大鼠急性肺损伤,其机制可能与阻断NF-κB信号通路有关。
Seely等[12]研究显示,SAP患者IL-1 、IL-8血清水平显著高于健康组。这些炎症因子对炎症反应起正反馈作用, 可加重SAP。IL-8可与中性粒细胞表面的特异性受体结合, 导致白细胞发生变形反应,脱颗粒,释放蛋白溶解酶和活性氧, 从而引起组织损伤的发生。IL-1β能促进白细胞在炎症胰腺的聚集并能激活中性粒细胞,在SAP的多脏器功能衰竭的发生发展中起着重要作用。IL-1β可促使骨髓释放中性粒细胞,并聚集在肺部释放溶酶体酶2诱导TNFα、IL-6的生成[13]。IL-10是人体中发现的少数抗炎因子之一,主要由辅助性T淋巴细胞(Th)产生,也可由B淋巴细胞、单核细胞和肥大细胞产生,能抑制Th1释放细胞因子。内源性和外源性的IL-10均能在转录水平上强烈抑制IL-1、IL-6、IL-8、TNFα、粒细胞-巨噬细胞集落刺激因子、粒细胞集落刺激因子的合成。IL-10主要是通过NF-κB的DNA结合能力,抑制NF-κB启动相关前炎症因子基因的转录。刘志勇等[14]发现,AP大鼠造模12 h后,血清中IL-10水平高于假手术组。宋润波等[15]发现,SAP大鼠造模6 h后血清中IL-10水平与假手术组的差异均无统计学意义,造模12 h后血清中IL-10水平高于假手术组,且差异均具有统计学意义。本实验中3组IL-10水平差异均无统计学意义,考虑与实验造模时间短有关。TNFα主要由单核细胞和巨噬细胞产生, 是SAP相关肺损伤重要的炎性细胞因子。30%~40%的AP患者TNFα水平增加[16]。在SAP被诱发1 h后,胰腺组织及血清TNFα即可被检测到,并在其后的6 h内迅速上升,其升高程度与胰腺损伤及炎症程度直接相关[17]。陆海华等[18]研究发现, AP相关肺损伤组TNFα表达水平明显高于AP组, 差异有统计学意义,与本实验结果一致。HMGB1广泛分布于哺乳动物细胞内,可在炎症晚期发挥作用。HMGB1能通过激活机体单核/巨噬细胞、中性粒细胞,增加炎症因子的释放,参与全身炎症反应;它还能损伤内皮功能,促使纤溶水平失衡,增加肠黏膜通透性[19]。SAP胰腺损伤与HMGB1的异常表达相关,SAP时血清及胰腺组织中HMGB1表达均可增强[20]。当HMGB1主动或者被释放到细胞外时通过TLR4受体通路,刺激免疫细胞产生炎性介质,形成恶性环路,使AP病情不断加重。TLR4是发现最早的TLR亚型之一,TLR4的表达受IL-4、TLR4增强子、IL-1β等细胞因子的影响。RAGE与HMGB1具有高度亲和力,HMGB1和RAGE进行结合以后,使NF-κB因子向核内转移,引起整条炎性信号通路的激活,并进一步诱导分泌大量炎性因子、趋化因子,参与炎性细胞激活、迁移和趋化作用等[21]。
本研究发现,厚朴酚能够改善肠屏障功能,降低淋巴液及血清中炎症因子水平,抑制HMGB1-TLR4/NF-κB信号转导通路,减轻SAP肺损伤,这为中西医结合治疗SAP提供了的思路。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突,特此声明。
作者贡献声明:王燕负责数据采集及分析,实验实施,撰写论文;齐文杰参与实验实施,修改论文;曾亚薇、谷培云参与实验实施;苗彬负责课题设计,资料分析,修改论文,指导撰写文章。
