索磷布韦片在中国健康人体中生物等效性和安全性评价
2020-12-21刘广文高振月薛金玲梁文忠杨海淼
刘广文, 高振月, 于 爽, 薛金玲, 梁文忠, 兰 静, 杨海淼
1 长春中医药大学附属医院 Ⅰ期临床试验研究室, 长春 130021; 2 正大天晴药业集团股份有限公司,s南京 210000; 3 上海药明康德新药开发有限公司, 上海 215000
HCV是一种感染覆盖全球的肝炎病毒[1]。据世界卫生组织统计,全球HCV感染率约3%,感染人数高达1.95亿人[2]。据报道,到2025年相关死亡率将增加2倍[3],我国的HCV发病率为0.06‰,2010年福建部分地区高达6.01%[4],每年由HCV导致的肝硬化、肝细胞癌死亡大约有70万人[5-6]。 目前国际上尚无有效且有针对性的丙型肝炎疫苗可供使用,因此抗HCV药物治疗对防治CHC显得尤为重要[7]。 长时间以来,干扰素联合利巴韦林是我国抗病毒治疗无禁忌证的所有基因型HCV感染者的主要方案[8],直接抗病毒药物(DAA)的出现标志着慢性丙型肝炎的抗病毒药物治疗取得重大进展。
在我国基因1型HCV感染者的治疗方案中,以索磷布韦为基础的DAA联合应用占有很大比重[9]。国外临床研究[10]显示,索磷布韦对HCV具有较好的抑制作用,不仅如此,还具有服药方便,适应证广、周期短、作用快、不良药物反应少等优点[11]。截至目前,我国尚无国产仿制的索磷布韦片获批上市,亦未见在中国健康人群中开展仿制药物的生物等效性相关报道和信息数据。本研究根据 《以药动学参数为终点评价指标的化学药物仿制药人体生物等效性研究技术指导原则》[12]以及美国食品药品监督管理局2013年颁布的“行业指南:根据ANDA草案指南提交的具有药代动力学终点的药物的生物等效性研究”[13],评价国产和进口的两种药物的生物等效性,为临床合理选用药物提供依据。
1 材料与方法
1.1 药品与仪器 受试药物:索磷布韦片,规格0.4 g/片,批号180514302,正大天晴药业集团股份有限公司生产;参比药物:索磷布韦片索华迪(SOVALDI)400 mg/片,批号17SB001D,Gilead Sciences Ireland UC公司生产。
LC-30AD 高效液相色谱系统由Shimadzu公司提供,API 6500和API 6500+检测器由Applied Biosystems/Sciex制造商提供。
1.2 受试者选择 健康受试志愿者均通过长春中医药大学附属医院临床试验招募报名平台征集,空腹组和餐后组分别在2018年9月18日和9月28日集中进行受试者的筛选体检,体检结果符合纳入标准后入组。空腹组和餐后组各入选40例,其中空腹组有1例完成第一周期试验后退出,最终39例完成试验;餐后组有1例完成第一、二周期试验后退出,最终39例完成试验。空腹组40例中男19例,占比47.5%,年龄(42.6±6.54)岁,BMI(24.39±2.22)kg/m2。餐后组40例中男21例,占比52.5%,年龄(38.3±7.7)岁,BMI(24.39±2.22)kg/m2。
受试者均符合研究方案中所规定的入选标准,均无既往病史,无药物滥用史。受试者给药前检查结果均为正常或无临床意义异常,药物滥用筛查结果未见阳性。试验前2周内未服用任何其他药物,受试者入住病房期间均统一饮食,禁止剧烈活动,整个试验期间禁烟、禁酒、咖啡、茶等可能影响药物代谢的食物或饮料。
1.3 给药方案、血样采集与检测单位检测采血点 本试验按单中心、随机、开放、单次给药、四周期、完全重复交叉健康人体空腹/餐后状态下给药设计。空腹组和餐后组受试者均随机分为2组,口服受试药物或参比药物索磷布韦片,温水240 ml送服。索磷布韦的消除半衰期约为0.4 h,清洗期设定为8 d,>7倍半衰期以上。
每周期药代动力学血样采集第一天服药前后2 h禁止饮水(高脂餐和服药饮用水除外),4 h后进午餐,10 h后进晚餐,中午、晚上均给标准餐,每周期的用餐计划应保持一致,给药后,由研究人员对受试者口腔进行检查,以确保药物服用。药代动力学血样采集空腹组及餐后组均在给药前0 h(60 min内)及给药后5 min、10 min、15 min、20 min、30 min、45 min、1 h、1.25 h 、1.5 h、1.75 h、2 h、2.5 h、3 h、4 h、6 h、8 h、12 h、24 h、48 h、72 h 共21个时间点采集静脉血。每点应用EDTA-K2真空抗凝采血管采集4 ml,轻柔颠倒混匀5次,约2500 r/min离心,离心10 min后,分离血浆,先存入-40 ℃冰箱中,24 h内转移至-80 ℃冰箱储存,冷链运输至检测单位待测。
检测单位分别检测原形物索磷布韦及其主要代谢物GS-331007。二者采血时间点如下,索磷布韦:给药前0 h(60 min内)及给药后5 min、10 min、15 min、20 min、30 min、45 min、1 h、1.25 h、1.5 h、2 h、3 h、4 h、6 h、8 h共15个时间点。代谢物GS-331007:给药前0 h(60 min内)及给药后15 min、45 min、1.25 h、1.5 h、1.75 h、2 h、2.5 h、3 h、4 h、6 h、8 h、12 h、24 h、48 h、72 h共16个时间点。
1.4 分析方法
1.4.1 色谱条件 色谱柱:ACQUITY UPLC HSS T3,1.8 μm, 2.1 mm × 100 mm ,柱温设置为50 °C;流动相A:0.1%甲酸,流动相B:乙腈含/甲醇溶液(30/70,V/V)。流速:0.4500 ml/min,进样量:5.0 μl。
1.4.2 质谱条件 电喷雾离子源(ESI),正离子模式(positive),多反应监测 (MRM);3000 V;离子源温度550 ℃;离子源喷雾电压(IS):4500 V;气帘气(CUR):35 psi;离子源气体1(GS1):70 psi;离子源气体2(GS2):70 psi;分辨率Q1/Q3(Resolution Q1/Q3):Unit/Unit;碰撞气(CAD):9.00 unit;选择监测离子对分别是530.2/243.1(索磷布韦)和534.2/247.1(GS-331007),索磷布韦-13C-d3和GS-331007-13C-d3;去簇电压(DP)分别为60 V、50 V、40 V、40 V;入口电压(EP)均为10 V;碰撞能量(CE)分别为66 eV、63 eV、20 eV、25 eV;出口电压(CXP)分别为29 V、15 V、14 V、14 V。
1.4.3 血浆样品的预处理与测定 取含药物血浆50.0 μl,摇板机上摇约5 min充分混匀,加入(25.0 μl内标工作溶,加入250 μl的乙腈/甲醇(3/1,V/V)溶液,摇板机上摇约15 min充分混匀,并在约4 ℃、4000 r/min离心10 min,转移50.0 μl上清液至一新的96孔板中,向样本中加200 μl水溶液,摇板机上摇约10 min充分混匀,进样,进行液相色谱-串联质谱分析。
1.4.4 标准曲线储备液与内标储备液的配置 索磷布韦标准曲线储备液的配置:称2.139 mg的索磷布韦标准品溶于2107.5 μl DMSO溶剂,得到校正后的终浓度为1.00 mg/ml的储备液(15Nov18_A_S1)。GS-331007标准曲线储备液的配置:称3.015 mg的GS-331007标准品溶于2945 μl DMSO溶剂,得到校正后的终浓度为1.00 mg/ml的储备液(15Nov18_B_S1)。精密量取适量标准曲线样品储备液,采用人血浆样品稀释,得到索磷布韦浓度为5、10、25、125、500、2000、4000、5000 ng/ml和GS-33100浓度为10、20、50、250、500、2000、4000、5000 ng/ml的标准曲线样品浓度值。以上配置的储备液装入透明玻璃瓶中,于-20 ℃保存。
索磷布韦-13C-d3储备溶液的配置:将1 mg的索磷布韦-13C-d3标准品溶于986 μl DMSO溶剂。得到校正后的终浓度为1.00 mg/ml的储备液。GS-331007-13C-d3储备溶液的配置:称1 mg的GS-331007-13C-d3标准品溶于990 μl DMSO溶剂得到校正后的终浓度为1.00 mg/ml的储备液。
1.5 伦理学审查 本试验方案由长春中医药大学附属医院伦理委员会批准,批号:CCZYFYLL2018S审字-90,所有受试者均在充分知情后自愿签署知情同意书。
1.6 统计学方法 药代动力学参数采用WinNonlin 7.0版本的非房室模型(non-compartmental analysis,NCA),根据实际采样时间点计算,包括索磷布韦Cmax、AUC0-t、AUC0-inf、Tmax、λz、t1/2、CL/F、Vd/F、%AUCex和代谢物(GS-331007)Cmax、AUC0-t、AUC0-inf、Tmax、λz、t1/2、CL/F、Vd/F、%AUCex。使用SAS 9.4软件版本进行统计分析,采用90%CI分析数据。与参比制剂比较,受试制剂的药代动力学参数(Cmax、AUC0-t、AUC0-inf)的几何平均值90%CI均在80%~125%,可以认为2种制剂的药动学主要参数无显著性差异,即生物等效。空腹和餐后状态的生物等效性试验分开进行计算。
2 结果
2.1 方法学评价
液相色谱-串联质谱方法学验证由上海药明康德新药开发有限公司完成,该方法符合中国药典生物样品定量分析方法验证指导原则[14]的要求。
2.1.1 专属性 通过分别测试索磷布韦和GS-3310076对6个不同来源空白基质、待测物对内标,内标对待测物均无干扰。说明具有良好的专属性。
2.1.2 标准曲线与定量下限 以分析物(索磷布韦和GS-331007)与内标(索磷布韦-13C-d3和GS-331007-13C-d3) 的色谱峰面积比为纵坐标,用加权(W=1/x2)最小二乘法以血浆中分析物的质量浓度(x)与峰面积比(y)进行线性回归,索磷布韦血药浓度在5~5000 ng/ml呈良好线性关系,最低定量下限(LLOQ)为5 ng/ml;GS-331007血药浓度在10~5000 ng/ml呈良好线性关系,LLOQ为10 ng/ml。
2.1.3 精密度和准确率 按照标准曲线储备液的操作流程,配置索磷布韦5个浓度(5、15、250、2500和3750 ng/ml)和GS-331007的5个浓度(10、30、500、2500和3750 ng/ml)的质控样品;均按照血浆的预处理与测定进行处理和分析,分批次制备并分别测定3 d得到质控样品的浓度,计算本方法的精准度和准确率,结果见表1 。

表1 精准度和准确度结果
2.1.4 提取回收率和基质效应 配制中间溶液,参照样品处理过程,计算真实质控样品(L、M、H)萃取后化合物与内标最终在仪器进样的理论浓度值,根据理论浓度进行稀释,精确量取10.0 μl LQC、MQC、HQC工作液和100 μl内标工作液混合,使用5490 μl的水分别稀释得到N-LQC、N-MQC、 N-HQC。经提取后的样品用配制的真实质控样品(L、M、H)按照样品处理过程萃取后获得。提取回收率计算:在提取后的质控样品中待测物和内标的峰面积除以空白血浆提取物与净溶液混合后待测物和内标的峰面积的比值。提取的样品中,高浓度待测物索磷布韦提取回收率均值118.5%,CV为2.9%,高浓度待测物GS-331007提取回收率均值95.6%,CV为4.8%。中浓度待测物索磷布韦提取回收率均值118.6%, CV为1.8%,中浓度待测物GS-331007提取回收率均值93.5%,CV为2.2%。低浓度待测物索磷布韦提取回收率均值112.3%,CV为5.5%,低浓度待测物GS-331007提取回收率均值91.8%,CV为4.4%。内标索磷布韦-13C-d3提取回收率均值114.4,CV为4.7%,内标GS-331007-13C-d3提取回收率均值93.1,CV为3.5%。
配制中间溶液,参照上述过程分别稀释得到N-LQC、 N-MQC、 N-HQC。生物基质相基质效应样品的配制,在96孔板中加入50.0 μl 空白单个人血浆,按照样品处理过程处理,提取上清后加入200 μl低、中、高溶液(N-LQC、N-MQC、N-HQC),使其浓度与萃取后真实质控样品(L、M、H)中化合物和内标的理论浓度相同。使用生物基质相面积和溶剂相面积比较得到待测物和内标面积比,获得归一化基质效应因子。索磷布韦的内标化平均归一化基质效应为LQC 1.00、MQC 0.98、HQC 0.98。GS-331007的内标化平均归一化基质效应为LQC 1.12、MQC 1.01、HQC 1.04,分析物索磷布韦经内标归一化的基质因子的相对标准偏差分别为4.0%、1.2%、0.5%。GS-331007基质因子的相对标准偏差分别为7.0%、1.7%、2.0%,均满足相对标准偏差不超过15%的接受标准,表明无明显基质效应。
2.1.5 稳定性 低、高浓度质控样品在室温放置23.9 h,-20 ℃冷冻放置24 d,-20 ℃连续5次冻融循环,80 ℃连续5次冻融循环,生物样品前处理过程中在白光室温2 h、黄光冰浴下22 h,制备后样本6 ℃放置147 h,待测物血浆样品在20 ℃条件下储存18 d、44 d和80 ℃条件下储存44 d、132 d后进行测试分析,结果表明准确度偏差均小于15%,说明具有良好的稳定性。
2.2 药代动力学参数 空腹状态下40例健康受试者口服受试制剂或参比制剂后,不同时点测定索磷布韦的平均血药浓度-时间曲线见图1,测定GS-331007平均血药浓度-时间曲线见图2。餐后状态下40例受试者口服受试制剂或参比制剂后,不同时点测定索磷布韦的平均血药浓度-时间曲线见图3,GS-331007平均血药浓度-时间曲线见图4。
2.3 生物等效性评价
2.3.1 空腹 以索磷布韦及其代谢物(GS-331007)的主要药代动力学参数Cmax、AUC0-t、AUC0-inf评价受试制剂与参比制剂的生物等效性,Cmax、AUC经对数转换后进行方差分析,索磷布韦Cmax、AUC0-t、AUC0-inf几何均值比值分别为90.55%、97.26%和94.62%,GS-331007Cmax、AUC0-t、AUC0-inf几何均值比值分别为98.91%、98.98%和99.46%,均在80.00%~125.00%;方差分析结果显示序列、周期、制剂对Cmax、AUC0-t、AUC0-inf均无显著影响(P值均>0.05);个体间存在差异(表2、3)。按照生物等效性判定标准,可判定2种制剂生物等效。
1.3 统计学分析 采用SPSS 20.0统计分析,数(n)和率(%)表示计数资料,采用χ2检验;采用Logistic回归模型实施多因素分析;P<0.05表明差异具有统计学意义。
2.3.2 餐后 以索磷布韦及其代谢物(GS-331007)的主要药代动力学参数Cmax、AUC0-t、AUC0-inf评价受试制剂与参比制剂的生物等效性,Cmax、AUC经对数转换后进行方差分析,索磷布韦Cmax、AUC0-t、AUC0-inf几何均值比值分别为83.3%、91.53%和93.28%,GS-331007Cmax、AUC0-t、AUC0-inf几何均值比值分别为100.63%、100.84%、101.01%,均在80.00%~125.00%;方差分析结果显示序列、周期、制剂对Cmax、AUC0-t、AUC0-inf均无显著影响(P值均>0.05);个体间存在差异(表4、5)。按照生物等效性判定标准,可判定2种制剂生物等效。
2.4 安全性评价 40例受试者全部进入安全性数据分析集,一般状况良好,无明显不良反应,空腹组有10例受试者出现11例次不良事件,其中贫血3例(7.5%),尿隐血4例(10%)。餐后组有14例受试者出现20例次不良事件,其中贫血6例(15%),尿隐血4例(10%)。所有不良事件均未经治疗恢复正常,试验结果显示受试制剂与参比制剂安全性均较好。
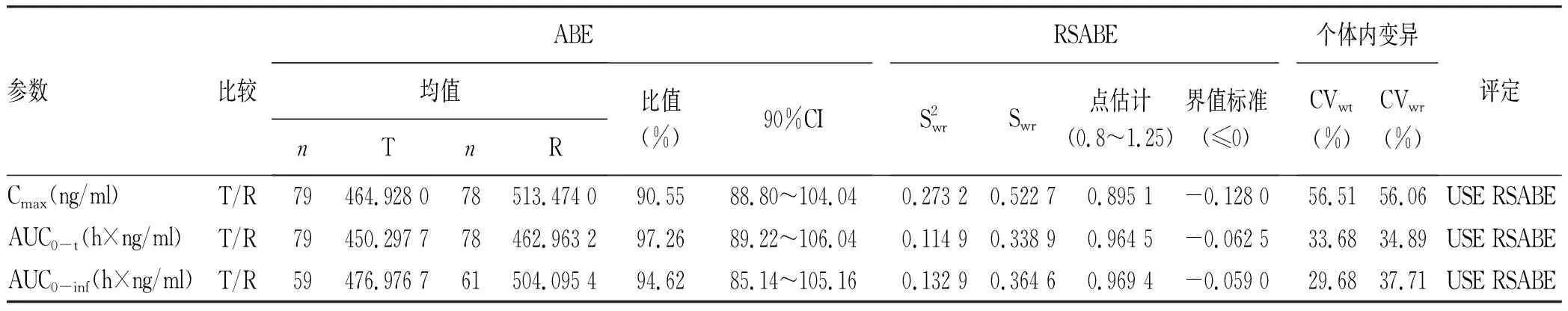
表2 空腹状态下服用索磷布韦片受试制剂和参比制剂后索磷布韦的生物等效性评价结果
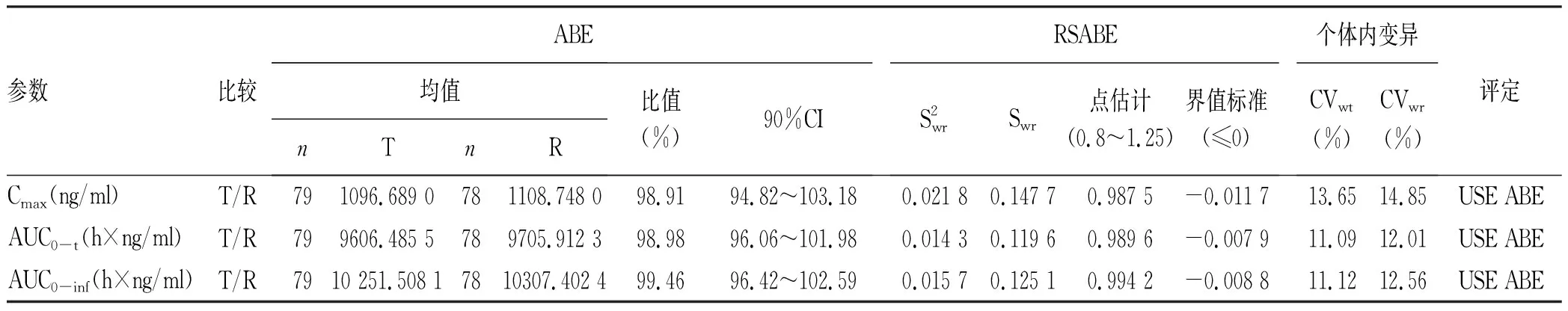
表3 空腹状态下服用索磷布韦片受试制剂和参比制剂后GS-331007的生物等效性评价结果
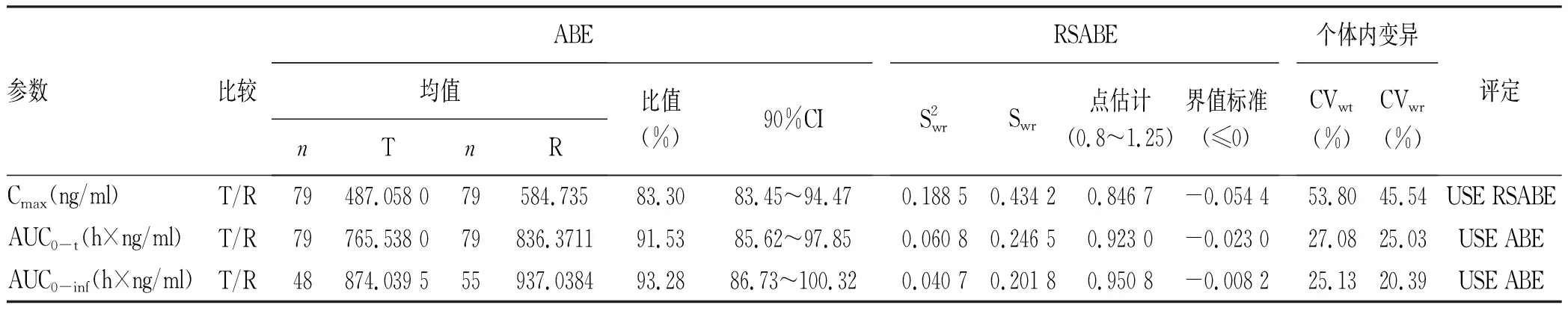
表4 餐后状态下服用索磷布韦片受试制剂和参比制剂后索磷布韦的生物等效性评价结果
3 讨论
本次索磷布韦片在空腹和餐后状态下口服0.4 g/片受试制剂和参比制剂后药代动力学特点显示,受试制剂和参比制剂空腹试验及餐后试验药代动力学变化趋势相同,食物对药物的Cmax无影响,其受试制剂安全性良好,两种制剂在空腹和餐后状态下均具有生物等效性。索磷布韦是第一个上市的核苷类NS5B、RNA聚合酶抑制剂,对人类的DNA和RNA聚合酶、线粒体RNA无明显的抑制作用,故少有不良反应[15]。本研究中出现的贫血不良事件与国外数据[16-18]和相关文献报道[19]在治疗慢性丙型肝炎患者中出现贫血事件相符合,说明该药物在患者和健康人中均会出现贫血的不良事件。在该项研究中共出现10例尿隐血不良事件,目前未见相关文献报道,值得今后的试验研究中特别关注。
本研究采用了液相色谱-串联质谱法测定K2EDTA人血浆中索磷布韦和代谢物GS-331007浓度,该生物分析方法采用蛋白沉淀法对样品进行前处理,在多反应监测模式下,基于电喷雾电离技术,采用高效液相色谱-串联质谱法分析测定样品浓度。LC-MS/MS方法具有高选择性、高灵敏度,适于广泛应用。
随着DAA的不断研发和应用,更加高效、短疗程、易耐受、服用方便的药物也必将不断被发掘,索磷布韦等抗病毒药物必将为全人类丙型肝炎患者造福,消灭慢性丙型肝炎指日可待。
作者贡献声明:刘广文、高振月负责课题设计,资料分析,撰写论文;于爽、薛金玲、梁文忠、兰静参与收集数据,修改论文;杨海淼负责拟定写作思路,指导撰写文章并最后定稿。
