家蚕幼虫BmMyD88基因对脂多糖和大肠杆菌的响应表达
2020-12-18李佳璇司徒金容林泳仪李树强刘吉升
李佳璇 司徒金容 林泳仪 李树强 王 涛 刘吉升
(广州大学生命科学学院,广东广州 510006)
家蚕(Bombyxmori)是由野蚕驯化,经长期人工培育,进化出发达的丝腺,吐出高品质蚕丝的具有高经济价值的昆虫,也是鳞翅目昆虫的模式生物。然而,每年因蚕病造成的损失占产业总产值的比率高达10%[1],严重制约着蚕桑产业的发展。蚕病的关键在于致病微生物具有极强的感染性和致死性,一旦感染,通过普通治疗方法难以起到有效作用[2]。
2004年,我国科学家率先完成家蚕全基因组的测序工作,2009年CHENG等[3]发现家蚕免疫相关基因218个。通过与模式生物果蝇免疫系统的对比分析,得到家蚕的14个Toll家族基因,以及和果蝇同源性很高的免疫缺陷(immune deficiency,Imd)基因、髓样分化因子88 (myeloid differentiation factor 88,MyD88)基因、Spatzle基因及超过40余种抗微生物肽(antimicrobial peptides,AMPs)基因和抗微生物肽类基因[4-5]。
MyD88是机体内重要的转导蛋白,在信号转导途径中起关键作用,能调控细胞分子分泌,影响适应性免疫应答[6]。LORD等[7]用白细胞介素6(interleukin 6,IL-6)处理小鼠髓样白血病细胞M1,发现髓样分化基因家族的新成员MyD88,并克隆MyD88基因序列,认为MyD88能够调节髓样细胞分化。HARDIMAN等[8]通过分析活化的树突状细胞及其表达序列数据库,发现编码人MyD88基因序列,其编码的蛋白质分子量为33 kD,编码296个氨基酸,具有2个特殊的结构域,包括C端TIR结构域(Toll/L-IR domain,TIR)与N端死亡结构域(death domain,DD)。在哺乳类动物中,MyD88基因主要表达于T细胞、B细胞中,在肝、肠、脾中表达量较高。在人体中,检测到MyD88基因主要在免疫细胞中表达。
在家蚕中,BmMyD88基因在家蚕的头部、中肠、脂肪体、丝腺、表皮中均有一定程度的表达;其中在中肠、脂肪体、表皮等主要免疫器官中的表达量较高,但整体表达水平依然很低[9]。BmMyD88是家蚕先天免疫通路上重要的接头分子,其信号转导方式类似于果蝇,在信号转导的早期BmTube先与BmMyD88结合形成二聚体形式,形成的二聚体恢复活性再与BmPelle蛋白结合成三聚体形式,此形式才具有转导功能,接着与活化受体识别连接,磷酸化进入胞内完成信号转导[10]。
脂多糖(lipopolysaccharide,LPS),是革兰氏阴性菌细胞壁的主要成分,机体感染革兰氏阴性菌后会出现毒性反应,其毒性主要与Lipid A结构有关,其免疫原性由多聚糖(polysaccharide)决定[11]。脂多糖也是大肠杆菌(Escherichiacoli)细胞壁的主要成分,参与大肠杆菌引起的免疫反应[12]。LIU等[13]研究发现脂多糖能够触发昆虫先天免疫反应,通过喂食或注射脂多糖可以抑制BmToll9-1在家蚕幼虫中的表达;同时,利用脂多糖和大肠杆菌处理后,诱导BmToll9-2在家蚕幼虫不同组织的表达上调,参与对脂多糖等外源病原体的识别过程[14]。
本文采用喂食法,分析脂多糖和大肠杆菌对家蚕幼虫体内BmMyD88基因表达的影响,从而在BmMyD88基因上揭示家蚕免疫系统对特定外源物质的反应,为家蚕感染革兰氏阴性菌的研究提供一定的试验数据。
1 材料与方法
1.1 试验材料
1.1.1 供试昆虫 本研究所使用的家蚕品系为P50,由广东省农业科学院蚕业与农产品加工研究所提供。孵化后的幼虫在温度为25±1 ℃,相对湿度为60%~70%,每日上午7:00起连续12 h光照(L)之后再连续12 h黑暗(D)(L∶D=12∶12,L 7:00AM—7:00PM,D 7:00PM—7:00AM)的条件下,以新鲜桑叶饲养。
1.1.2 主要试剂 RNAiso Plus、PrimeScript Ⅱ 1st Strand cDNA Synthesis Kit、Taq、DL2000 DNA Marker等试剂,均为宝日医生物技术(北京)有限公司(大连TaKaRa公司)产品;Lipopolysaccharides fromEscherichiacoliO111:B4,为西格玛奥德里奇(上海)贸易有限公司产品;琼脂糖M,为BBI公司产品。
1.1.3 主要仪器设备 T100 Thermal Cyclers PCR仪、Gel Doc XR+凝胶成像系统,均为Bio-Rad公司产品;CentrisartA-14C离心机、BSA224S电子天平,均为Sartorius公司产品;NanoDrop 2000超微量分光光度计、-80 ℃超低温冰箱,均为Thermo Fisher公司产品。
1.2 试验方法
1.2.1 家蚕幼虫的喂食试验及解剖取样 随机选取36头5龄第1天的家蚕幼虫每头单独置于六孔板中饥饿处理24 h后进行喂食试验,以喂食20 μL脂多糖溶液(2.5 μg/μL)或20 μL大肠杆菌稀释液(2.5×105个/μL)为试验组,以喂食20 μL无菌水为对照组,共3种处理,每种处理12头幼虫。将不同溶液分别均匀涂抹于一片洗净的1 cm2桑叶上,待其完全被取食后再添加新鲜桑叶继续喂食。
在喂食前的0 h、喂食后的3 h、6 h和24 h进行平行取样,每头家蚕解剖取中肠、脂肪体和表皮3种组织,保证每种溶液处理的每个时间段均有3头家蚕重复样品。所有样品迅速置于无RNA酶的离心管中,保存于-80 ℃冰箱备用。
1.2.2 总RNA的提取和cDNA的合成 采用RNAiso Plus试剂盒,按其说明书提取以上组织的总RNA,并用NanoDrop 2000超微量分光光度计检测RNA的浓度和质量,置于-80 ℃冰箱保存。
参照PrimeScript Ⅱ 1st Strand cDNA Synthesis Kit使用说明书操作,采用10 μL反应体系进行反转录。反应条件为25 ℃ 10 min,42 ℃ 60 min,4 ℃保存。cDNA置于-20 ℃冰箱保存,以此作为模板进行PCR反应。
1.2.3 目的基因的PCR扩增 本研究所使用的PCR引物均使用Primer Premier 6.0软件进行设计(表1),由生工生物工程(上海)股份有限公司合成。检测基因为家蚕BmMyD88基因(GenBank登录号:XM_004921516),内参基因选择家蚕BmActinA3看家基因(GenBank登录号:NM_001126254)。

表1 BmMyD88基因扩增和内参基因引物
采用Taq试剂盒和20 μL的反应体系进行PCR扩增。扩增条件:94 ℃预变性2 min,94 ℃变性30 s,52 ℃退火30 s,72 ℃延伸30 s,共28次循环后,再72 ℃延伸10 min。PCR产物进行1.5%琼脂糖凝胶电泳,在凝胶成像仪下观察试验结果。
1.3 数据处理与分析
利用Quantity One图像分析软件对凝胶条带进行定量分析。参照软件说明,通过校正原凝胶电泳图的亮度和对比度,统一背景色调;调整目标条带宽度并重新编号计算;框选目的条带后平衡条带峰值;分析量化条带亮度后导出数据。对脂多糖、大肠杆菌处理的试验组和无菌水处理的对照组进行单因素方差分析(one-way ANOVA),并进行Turkey法多重比较检验。
2 结果与分析
2.1 不同处理对家蚕幼虫表皮组织中BmMyD88基因表达的影响情况
通过凝胶电泳图分析,喂食无菌水时,家蚕幼虫表皮组织中BmMyD88基因在4个时间段的条带亮度相近(图1-A);喂食脂多糖时,家蚕幼虫表皮组织中BmMyD88基因在6 h和24 h的条带亮度明显增强(图1-B);喂食大肠杆菌时,家蚕幼虫表皮组织中BmMyD88基因在6 h的条带最亮,24 h的条带亮度减弱到与3 h相近(图1-C)。通过Quantity One软件进一步验证,喂食无菌水时,家蚕幼虫表皮组织中BmMyD88基因在4个时间段的相对表达量无显著性差异;喂食脂多糖时,家蚕幼虫表皮组织中BmMyD88基因在6 h和24 h的相对表达量显著上调;喂食大肠杆菌时,家蚕幼虫表皮组织中BmMyD88基因在6 h的相对表达量最高,24 h较之前有明显下降(图2)。根据凝胶电泳的条带亮度和Quality One软件表达量分析相结合,可以判断脂多糖和大肠杆菌均可引起BmMyD88基因在表皮中的表达上调;其中脂多糖的诱导上调作用在处理后的24 h达到最大,大肠杆菌的诱导上调作用在处理后的6 h达到最大。
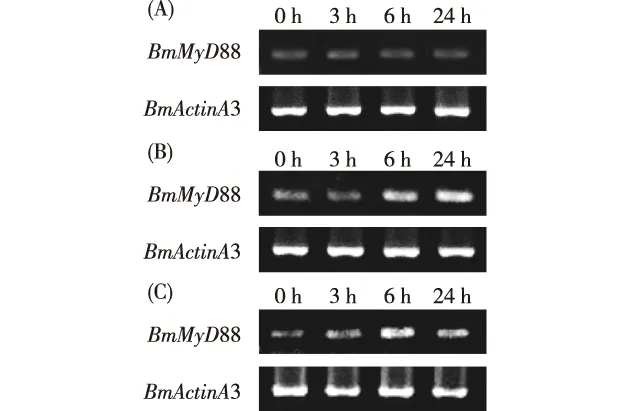
图1 喂食无菌水(A)、脂多糖(B)、大肠杆菌(C)后家蚕幼虫表皮组织中BmMyD88基因的凝胶电泳
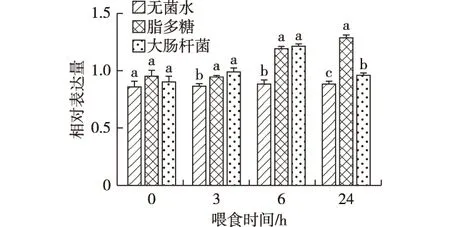
图中数据为3个重复的平均值±标准差;柱上不同小写英文字母表示差异显著(P<0.05)。图4和图6相同。图2 不同喂食处理后家蚕幼虫表皮组织中BmMyD88基因的相对表达量
2.2 不同处理对家蚕幼虫脂肪体组织中BmMyD88基因表达的影响情况
通过凝胶电泳图分析,喂食无菌水时,家蚕幼虫脂肪体组织中BmMyD88基因在0 h和24 h的条带亮度较其他2个时间段更亮(图3-A);喂食脂多糖时,家蚕幼虫脂肪体组织中BmMyD88基因在3 h条带亮度略微增强,6 h减弱,24 h达到最亮(图3-B);喂食大肠杆菌时,家蚕幼虫脂肪体组织中BmMyD88基因在3 h的条带最亮,6 h和24 h明显变暗(图3-C)。通过Quantity One软件进一步验证,喂食无菌水时,家蚕幼虫脂肪体组织中BmMyD88基因在0 h和24 h相对表达量比3 h和6 h略高,但均无显著性差异;喂食脂多糖时,家蚕幼虫脂肪体组织中BmMyD88基因在3 h相对表达量达到最高,6 h相对表达量较之前有所下降,但较0 h仍有增加,24 h再恢复上调;喂食大肠杆菌时,家蚕幼虫脂肪体组织中BmMyD88基因在3 h的相对表达量显著上调,6 h和24 h基因相对表达量无显著变化(图4)。
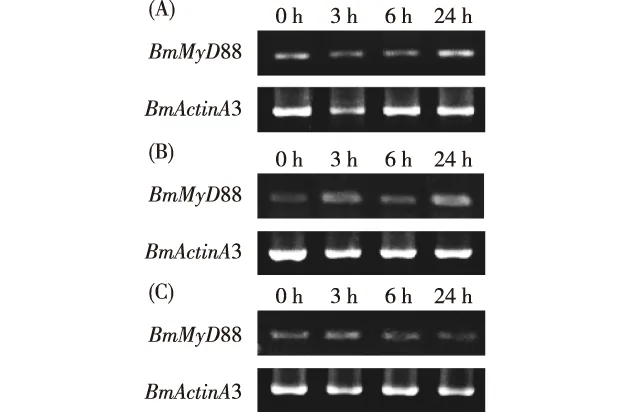
图3 喂食无菌水(A)、脂多糖(B)、大肠杆菌(C)后家蚕幼虫脂肪体组织中BmMyD88基因的凝胶电泳
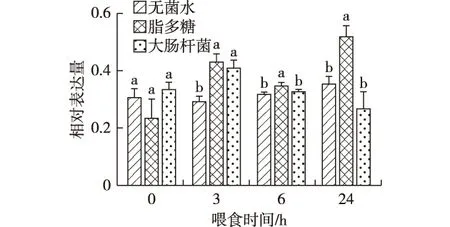
图4 不同喂食处理后家蚕幼虫脂肪体组织中BmMyD88基因的相对表达量
根据凝胶电泳的条带亮度和Quality One软件表达量分析相结合,可以判断在脂肪体中脂多糖较大肠杆菌使BmMyD88基因上调表达的效果更好;其中脂多糖的诱导上调作用在处理后的24 h最为显著。
2.3 不同处理对家蚕幼虫中肠组织中BmMyD88基因表达的影响情况
通过凝胶电泳图分析,喂食无菌水时,家蚕幼虫中肠组织中BmMyD88基因在6 h的条带最暗,其余3个时间段的条带亮度相近(图5-A);喂食脂多糖和大肠杆菌时,家蚕幼虫中肠组织中BmMyD88基因在3 h和6 h的条带亮度明显增强,24 h有明显减弱的趋势(图5-B、C)。通过Quantity One软件进一步验证,喂食无菌水时,家蚕幼虫中肠组织中BmMyD88基因在6 h的相对表达量较其余3个时间段略低,但均无显著差异;喂食脂多糖和大肠杆菌时,家蚕幼虫中肠组织中BmMyD88基因在3 h和6 h的相对表达量明显上调,24 h显著下降(图6)。

图5 喂食无菌水(A)、脂多糖(B)、大肠杆菌(C)后家蚕幼虫中肠组织中BmMyD88基因的凝胶电泳
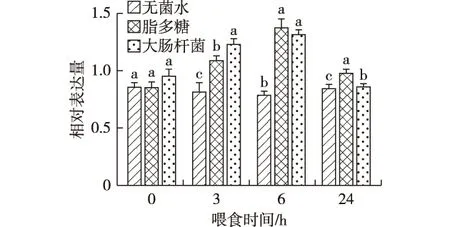
图6 不同喂食处理后家蚕幼虫中肠组织中BmMyD88基因的相对表达量
根据凝胶电泳的条带亮度和Quality One软件表达量分析相结合,可以判断脂多糖和大肠杆菌均可诱导家蚕幼虫中肠组织中BmMyD88上调表达;并且最佳诱导上调时间均在处理后的3 h和6 h。
3 小结与讨论
先天免疫对昆虫至关重要,并且在病原体消除和伤口愈合中起着重要作用。已鉴定出几种由病原体诱导的信号转导途径,包括Toll、Imd、JAK/STAT以及JNK途径,其中Toll信号通路是昆虫先天免疫介导抗菌肽合成的主要信号通路[15-16]。Toll信号转导通路中,MyD88作为一种重要的接头分子,锚定在质膜的富含磷脂酰肌醇-4,5-双磷酸酯的区域,在此过程中,活化的Pelle通过其激酶活性进行自身磷酸化,释放后磷酸化下游IkB以激活NF-kB,最终NF-kB迁移到细胞核中,诱导AMP和其他免疫相关基因的表达[17-20]。
为明确外源病原体能否影响BmMyD88基因的表达,本试验对家蚕5龄幼虫进行脂多糖喂食,结果显示,在表皮、脂肪体、中肠中,喂食脂多糖后BmMyD88基因表达量均能在不同时间段引起上调表达。脂多糖作为一种常见的病原相关分子模式(pathogen-associated molecular pattern,PAMP)可以激活无脊椎动物的先天性免疫反应,在马氏珍珠贝(Pinctadafucatamartensii)、厚壳贻贝(Mytiluscoruscus)、菲律宾蛤仔(Ruditapesphilippinarum)中,脂多糖处理后MyD88基因均上调表达[21-23]。在哺乳动物中,脂多糖通过结合TLR4及MD-2(myeloid differentiation-2)形成的异二聚体[24],诱导TLR4/MyD88信号通路中的炎性因子表达[25]。在家蚕中,BmTol19是最接近TLR4的Toll受体,同时ZHANG等[26]研究表明BmTol19-1-BmEsr16(Bombyxmoriecdysteroid-regulated 16 kD protein)可能具有与哺乳动物TLR4-MD-2相似的脂多糖识别和信号转导功能,由此推测BmMyD88作为Toll通路的相关基因可能参与脂多糖引起的免疫应答反应。
为进一步验证外源病原体对BmMyD88基因表达水平的影响,本试验同时进行了大肠杆菌喂食试验,结果显示,经大肠杆菌处理后BmMyD88基因出现上调表达。CHENG等[27]早在2008年就已发现并鉴定家蚕Toll信号通路中Spätzle、Toll、MyD88、Tube等的可能成分,并指出该通路可能由大肠杆菌诱导产生免疫反应。BmMyD88上游BmToll9-2受体基因,也能被大肠杆菌诱导上调表达[14]。任美佳[28]研究表明家蚕中大肠杆菌处理后Tube基因转录水平显著升高。在其他无脊椎动物如三角帆蚌(Hyriopsiscumingii)中也证实MyD88基因能被大肠杆菌诱导而使表达量增加[29]。由此可推测BmMyD88作为Toll受体的重要接头蛋白,为保持Toll通路正常的免疫反应,从而响应大肠杆菌诱导上调表达。
对比脂多糖和大肠杆菌对BmMyD88基因的诱导上调表达水平,分析发现脂多糖和大肠杆菌均能够引起BmMyD88基因的上调表达。ZHANG等[26]发现在家蚕幼虫中,抗菌肽基因Moricin、CecropinB、Lebocin、Gloverin2和DefensinB均能被脂多糖和大肠杆菌诱导上调表达。而在本试验中脂多糖的诱导上调表达速度更快、效果更强、时间更持久,与廖文丽等[14]研究中大肠杆菌的诱导BmToll9-2基因表达效果较脂多糖更好的结果相一致,推测可能由于脂多糖是细菌的细胞壁组成部分,在大肠杆菌中含有更多的脂多糖,BmMyD88基因对其响应更敏感,上调表达更显著。
综上所述,BmMyD88基因在家蚕5龄幼虫的不同组织中,经脂多糖和大肠杆菌处理后上调表达,在免疫应答中起重要作用。含脂多糖的革兰氏阴性菌能够诱导家蚕的免疫表达反应,且不同组织会出现不同程度的免疫反应。但是,还需要进一步通过基因敲除和过表达等手段进行深入研究,明确BmMyD88基因在家蚕免疫系统对特定外源物质的反应及其生理功能,为完善鳞翅目昆虫先天免疫信号通路提供数据依据。
