非预包装食品中沙门氏菌快速检测方法的建立
2020-12-18王丽石晓丽杨桂娥
王丽,石晓丽,杨桂娥
(包头市食品药品检验检测中心,内蒙古包头014060)
沙门氏菌(Salmonella)在我国乃至全球范围内细菌性食物中毒中占首位,可致肠热症、慢性肠炎、食物中毒等[1],人一旦摄入含有大量沙门氏菌(106CFU/g~107CFU/g)的食品,就会引起食物中毒导致的胃肠炎、伤寒和副伤寒。沙门氏菌的传播媒介多为肉、蛋及其制品,且在与此类食品接触或食品从加工到出售的过程中都易发生污染[2],因此沙门氏菌的检测对食品安全非常重要。
目前食品中沙门氏菌的检测方法主要依据是国家标准方法GB 4789.4-2016《食品安全国家标准食品微生物学检验沙门氏菌检验》,该法耗时较长,过程繁琐,检测灵敏度偏低,且易受技术人员操作水平和经验的影响[3-6],这些弊端使食品安全监管的时效性降低。近年来,为弥补传统国家标准方法检测周期长的不足,各种快速检测方法不断涌现,如认可度较高的实时荧光PCR法、生物质谱法等[7-14],而这些方法对仪器有着较高的要求,其普及性并不高。
本研究利用PCR分子层析检测方法,使用常规增菌液增菌,通过对不同基质的非预包装食品的大量试验与结果数据分析,对比传统国标检测方法的特异性和灵敏度,探索出一个区别于传统检测方法的有效且快速的沙门氏菌检测方法。该方法样品前处理步骤少,使用的扩增仪较普通,较大程度地提升了该方法的可操作性及普及性。
1 材料与方法
1.1 材料与试剂
1.1.1 试验菌株
肠炎沙门氏菌 CICC21513(Salmonella enteritidis)、大肠埃希氏菌CICC10389(Escherichia coli):中国工业微生物菌种保藏管理中心(China Center of Industrial Culture Collection,CICC)。
1.1.2 培养基和试剂
缓冲蛋白胨水、四硫磺酸钠煌绿增菌液、改良缓冲蛋白胨水(modified buffered peptone water,mBPW)、亚硒酸盐胱氨酸增菌液、六水氯化镁、亚硫酸铋琼脂:北京陆桥技术股份有限公司;沙门氏菌显色培养基:上海科玛嘉微生物技术有限公司;沙门氏菌PCR分子层析测试盒[15-16](包括1.5 mL装有预处理试剂的核酸提取管、缓冲液Buffer B、50 μLPCR试剂管和掌上型的层析卡盒):上海美凯纯生物科技有限公司。
1.1.3 仪器和设备
恒温培养箱(PR505750R-CN)、水浴培养箱(TSCOL35)、PCR 扩增仪(power pac basic):赛默飞世尔科技公司;立体压力蒸汽灭菌器(YXQ-LS-100SII):上海博讯实业有限公司;金属浴加热装置(TMS-300):杭州奥盛仪器有限公司。
1.2 试验方法的研究
1.2.1 选取的样品来源
本研究中非预包装食品样品本底采样于不同超市和市场的散装售卖点。普通基质样品直接检测。复杂基质样品是将凉菜类样品本底在室温下放置2 d,待其自然腐败后进行检测,以模拟自然界的复杂微生物环境,凉菜类检测样品均为放置2 d后自然腐败的样品;生鲜蛋类则挑取了粘附有禽类粪便的样品。
1.2.2 沙门氏菌检测
沙门氏菌检测方法流程见图1。
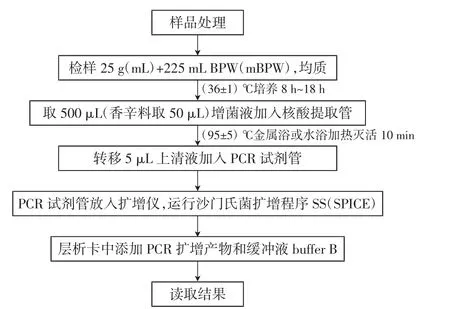
图1 沙门氏菌检测流程Fig.1 Salmonella detection process
1.2.3 检测过程
1.2.3.1 样品处置
非冷冻的易腐样品若不能及时检测,应置于2℃~5℃冰箱保存,在24 h内检测。冷冻样品应在45℃以下不超过15 min或2℃~5℃不超过18 h解冻,若不能及时检测,应置于-10℃~-20℃保存。
1.2.3.2 样品制备及增菌
1)普通基质样品
称取25g(mL)样品,放入盛有225mLBPW增菌肉汤的无菌均质袋或均质杯内,8 000 r/min~10 000 r/min均质1 min~2 min,制成样品匀液。将制备好的样品放于(36±1)℃培养箱中培养 8 h~18 h。
2)复杂基质样品
称取25 g(mL)样品,放入盛有225 mL mBPW增菌肉汤的无菌均质袋或均质杯内,8000r/min~10000r/min均质1 min~2 min,制成样品匀液。将制备好的样品放于(36±1)℃培养箱中培养 8 h~18 h。
1.2.3.3 核酸的提取及扩增
取培养好的增菌肉汤(普通食品500 μL,香辛料样品50μL)加到已经恢复到室温的1.5mL核酸提取管中盖好,上下颠倒混匀内容物或涡旋混匀5 s,(95±2)℃金属浴或水浴加热灭活10 min,取出后10 000 r/min离心1 min,室温冷却10 min,取出后和下一步加样前不要摇动[注:灭活和未灭活的核酸提取管可以在(-20±2)℃保藏一周]。
从已经冷却的核酸提取管中取5 μL上清液加到已解冻的PCR试剂管中,可室温解冻(10±1)min,并立即使用,且为避免PCR管之间交叉污染,只在加样时打开PCR管,加样后立即关闭,10 000 r/min离心10 s,将PCR试剂管放入扩增仪,并运行相应程序(沙门氏菌普通食品用SS,香辛料样品用SS SPICE)。扩增程序设置见表1。

表1 沙门氏菌扩增程序Table 1 Salmonella amplification program
1.2.3.4 层析卡盒检测及结果判定
程序运行结束,冷却后加入4滴缓冲液(buffer B),用200 μL移液枪将PCR扩增管内全部扩增物转移到层析卡加样窗内,等待(2±0.25)min再加4滴buffer B至加样窗内,等待(1±0.25)min,拉动检测卡盒上的开关,观察检测结果。若出现一条红色质控线,表示层析卡盒工作正常;若质控线和检测线都出现表示沙门氏菌属阳性;而只出现质控线,则表示为阴性,结果如图2所示。
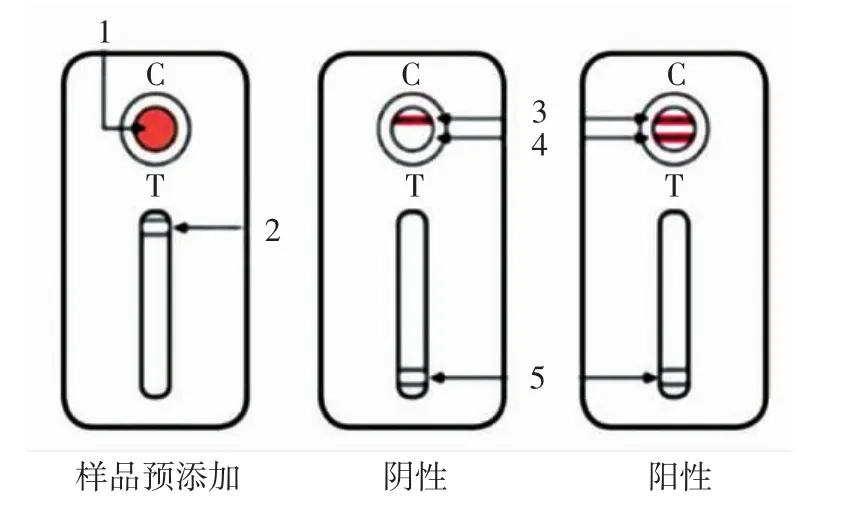
图2 层析卡盒检测结果判定Fig.2 Chromatographic card box detection results determination
2 结果与分析
2.1 普通基质食品中沙门氏菌的检测结果与分析
2.1.1 面食制品
取20批不同种类的面食制品(蛋糕、夹心面包、果仁饼干、馒头、果条、玉米饼、膜片、油饼)各25 g,分别加入225mLBPW增菌肉汤,每批样品中分别添加1mL不同浓度(10-4~10-7)的沙门氏菌阳性菌液,于(36±1)℃培养18 h后分别用国标法GB 4789.4-2016《食品安全国家标准食品微生物学检验沙门氏菌检验》和PCR分子层析法同时检测,将不同浓度的阳性菌液分别涂布于沙门氏菌显色培养基,于(36±1)℃培养24 h后计数。结果见表2、表3。
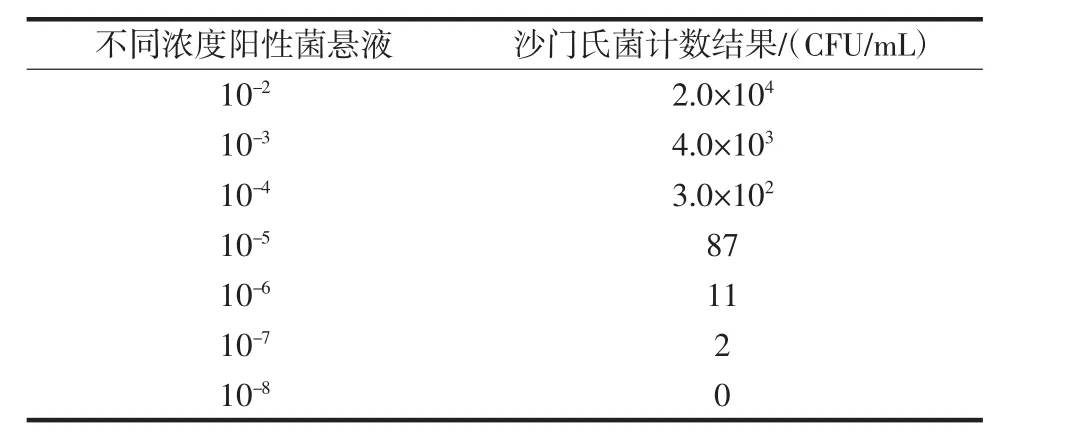
表2 不同浓度沙门氏菌阳性菌悬液计数结果Table 2 The count results of different concentrations of Salmonella positive bacteria suspension
由表3可知,20批不同种类的面食制品比较国标法和PCR分子层析法检测沙门氏菌,添加阳性菌量浓度为10-4和10-5时,阳性菌数量偏多,两种方法均检出沙门氏菌。当添加阳性菌量浓度为10-6和10-7时,阳性菌数量偏少或极少,PCR分子层析法检测结果为检出,而国标法则为未检出,由此表明PCR分子层析法比较国标法有更低的检出限和更高的灵敏度。

表3 20批不同种类面食制品比较国标法和PCR分子层析法的检测结果Table 3 The comparation of the detection results between national standard method and PCR molecular chromatography on 20 batches different types pasta products
2.1.2 乳制品
取20批不同种类的乳制品(生牛乳、生羊乳、奶酪、奶豆腐)25 g(mL),加入 225 mL BPW 增菌肉汤,每批样品中分别添加1 mL不同浓度(10-4~10-7)的沙门氏菌阳性菌液,于(36±1)℃培养18 h后分别用国标法和PCR分子层析法同时检测,结果见表4。

表4 20批不同种类乳制品对比国标法和PCR分子层析法的检测结果Table 4 The comparation of the detection results between national standard method and PCR molecular chromatography on 20 batches different types dairy products
由表4可知,20批不同种类的乳制品比较国标法和PCR分子层析法检测沙门氏菌,由于生鲜乳样品的基质相对复杂,添加阳性菌量浓度为10-5时,国标法未检出沙门氏菌,PCR分子层析法则同时在添加阳性菌浓度为10-5、10-6和10-7的样品中检出沙门氏菌,由此表明PCR分子层析法的抗干扰性更强,检测灵敏度更高。
2.1.3 肉制品
取20批不同种类的熟肉制品(猪蹄、鸡翅、羊蹄、红肠、牛肚)25 g,加入225 mL BPW增菌肉汤,每批样品中分别添加1 mL不同浓度(10-4~10-7)的沙门氏菌阳性菌液,于(36±1)℃培养18 h后分别用国标法和PCR分子层析法同时检测,结果见表5。
由表4和表5试验结果可知,PCR分子层析法测定基质相对复杂的样品时,较国标法有更好的抗干扰能力,且检测灵敏度更高,可达到1 CFU/mL~10 CFU/mL的阳性菌添加浓度。

表5 20批不同种类肉制品对比国标法和PCR分子层析法的检测结果Table 5 The comparation of the detection results between national standard method and PCR molecular chromatography on 20 batches different types meat products
2.1.4 PCR分子层析法检测沙门氏菌的特异性研究
将沙门氏菌检测中对其干扰和竞争最多的大肠埃希氏菌作为特异性实验的干扰菌株,取1 mL浓度为10-5的沙门氏菌菌悬液,加入BPW增菌肉汤,同时分别加入 1 mL 不同浓度(10-1、10-2、10-3、10-4、10-5)的大肠埃希氏菌的菌悬液于(36±1)℃培养18 h后用PCR分子层析法检测,结果见表6。

表6 PCR分子层析法检测沙门氏菌的特异性试验结果Table 6 Detection of Salmonella specific experiment results by PCR molecular chromatography
由表6可知,在沙门氏菌浓度较低的情况下,不断增大干扰菌大肠埃希氏菌菌悬液的浓度,最大的添加浓度可到达10-2,PCR分子层析法均检出沙门氏菌,表明PCR体系中存在大量其他干扰菌株的DNA时,并不会影响检测结果,可见PCR分子层析法具有较强的特异性和排他性。
2.2 复杂基质与普通基质食品中沙门氏菌的检测结果与分析的比较研究
2.2.1 凉菜类和生鲜蛋类
分别取20批不同种类的凉菜(面筋凉皮、煮花生、腐竹银耳、蕨根粉、豆皮)和20批生鲜蛋(鸡蛋、鸭蛋、鹌鹑蛋且蛋壳表面附带原粪)25 g,加入225 mL BPW增菌肉汤,对于微生物环境较为复杂的食品样品基质,试验中增大了阳性菌菌悬液的添加浓度,以增强沙门氏菌的竞争力。即每一批样品中分别添加1 mL浓度为 10-2~10-7的沙门氏菌阳性菌菌悬液,于(36±1)℃培养18 h后,分别用国标法和PCR分子层析法检测,结果见表7、表8。

表7 20批不同种类凉菜对比国标法和PCR分子层析法的检测结果Table 7 The comparation of the detection results between national standard method and PCR molecular chromatography on 20 batches different types cold dishes
由表7可知,用国标法和PCR分子层析法同时检测20批不同种类的凉菜中的沙门氏菌,当添加阳性菌浓度为10-2时,两种方法均可检出沙门氏菌,添加阳性菌浓度降为10-3时,国标法未检出沙门氏菌,而PCR分子层析法检出了沙门氏菌。可见对于基质较复杂的食品,两种方法的检测灵敏度明显下降。

表8 20批不同种类生鲜蛋对比国标法和PCR分子层析法的检测结果Table 8 The comparation of the detection results between national standard method and PCR molecular chromatography on 20 batches different types fresh eggs
由表8可知,用国标法和PCR分子层析法同时检测20批不同种类的生鲜蛋中的沙门氏菌,与凉菜相比生鲜蛋类样品基质的微生物环境更为复杂。当添加阳性菌浓度为10-2时,国标法未检出沙门氏菌,而PCR分子层析法检出了沙门氏菌。表明样品基质的微生物环境较复杂时,干扰菌对沙门氏菌的抑制和竞争作用增强,使得检出率和灵敏度均有降低。
2.2.2 增菌液的优化研究
为降低复杂基质样品本底对测定结果的干扰,用基质微生物环境较复杂的20批生鲜蛋作为样本,分别在其增菌液BPW中加入六水氯化镁、碳酸钙以及柠檬酸铋铵和亚硫酸钠,进行了比对试验。比对结果显示,在BPW中加入六水氯化镁的增菌液(mBPW),对生鲜蛋样本的增菌效果较理想,可使PCR分子层析法的检测灵敏度有显著提高。结果见表9。

表9 20批生鲜蛋增菌液优化前后PCR分子层析法检测结果Table 9 The comparation of the detection results on 20 batches fresh eggs before and after optimization of increase microbial liquid by PCR molecular chromatography
由表9可知,使用优化后的增菌液mBPW,PCR分子层析法检测阳性菌添加浓度由10-2降低至10-4,检测灵敏度得到提高,相比优化前提高了100倍。对于基质较复杂的食品可以采用PCR分子层析法结合改良增菌液进行检测。
3 讨论与结论
沙门氏菌的种类繁多,生存力强,在20℃以上即可大量繁殖。随着食品售卖方式的多样化,尤其对于基质相对复杂的非预包装食品来说,对其生物污染的及时检测显得尤为重要,如何快速准确地检出污染微生物是预防和控制食品安全问题的重要环节。
传统的检测技术在沙门氏菌的分离过程中存在一定的不确定性,检验步骤耗时较长,易受环境和微生物活性影响,且对检验人员的检验技术和经验均有较高要求,不能很好地与食品安全所需的“及时准确”相适应。
目前的沙门氏菌检验技术,包括分子生物学技术、生物传感器检测技术、质谱检测技术等,一是对人员操作能力有要求,二是仪器操作相对复杂,三是样品处理复杂。因此,对沙门氏菌的快速检测技术和风险监控技术的开发和应用研究,成为食品安全检测发展的重要方向[17-22]。
本研究相比其他快速检测方法,具有较高特异性和灵敏度的优势,且准确性和稳定性也较好。应用PCR分子层析技术检测沙门氏菌有其独特的优势,一是样品前处理步骤少,不需要样品纯化和复杂的DNA提取,操作简单,不易受环境影响;二是检测灵敏度可达到阳性菌最低添加浓度10 CFU/mL;三是时效性大大提高,PCR分子层析法检测周期比传统国标方法检测周期快了6倍左右,弥补了沙门氏菌国标检测方法周期长的不足,提高了沙门氏菌检测的时效性;四是本方法所使用的扩增仪是食品检测实验室常规配置的仪器,价格不高,便于方法的普及推广。
