黄果茄总黄酮的提取工艺优化与体外抗氧化活性研究
2020-12-18李学玲许苑南龙佳敏张建强陈梅
李学玲,许苑南,龙佳敏,张建强,陈梅,*
(1.云南民族大学化学与环境学院,云南昆明650504;2.普洱学院生物与化学学院,云南省高校亚热带药用食用生物资源开发与利用重点实验室,云南普洱665000)
黄果茄(Solanum xanthocarpum Schrad.et Wendl)为茄科、茄属植物,是多年生野生植物。主要分布于我国的福建、海南、广西、四川、云南等地,黄果茄的果实、种子及根均可入药,具有清热利湿、活血化瘀和止痛的功效。目前,国内外对黄果茄总黄酮的提取工艺及体外抗氧化活性的研究鲜见报道。
闫晓慧等[1]采用甲醇回流的方法得到黄果茄提取物,对其进行了抗烟草花叶病毒(tobacco mosaic virus,TMV)活性研究,结果显示具有一定的抗病毒活性,因此推测黄果茄中可能含有抗TMV的活性物质;徐兴建等[2]通过探究黄果茄提取物对不同贝类的生物效应,表明黄果茄提取物是一种剂量低、效果好且很有潜力的植物灭螺剂;魏风华等[3]通过一系列试验,探究黄果茄提取物的灭螺效果,并进行了鱼类和大鼠急性毒性实验,得出黄果茄提取物是一种剂量低、效果好且对鱼类和大鼠毒性较低的植物灭螺剂;李娟娟等[4]提取和分离了黄果茄果实原粉中有效成分,得出黄果茄果实原粉中含有生物碱,它能有效抑制并杀死钉螺并且对鱼类毒性不大,是一种效果好且低毒的灭螺剂;余蔚等[5]采用正交试验法,以黄果茄果实中生物碱的质量分数为考察指标,优化黄果茄果实中生物碱的提取工艺条件。
Josekutty等[6]研究发现从黄果茄中提取的有效成分对猫、犬的心肌有增强收缩作用;Dewangan等[7]用乙醇浸提黄果茄果实得到的提取物中被鉴定出重要的次生代谢产物生物碱、糖苷、皂苷、碳水化合物、单宁、酚类化合物、蛋白质和脂肪。Baskar Kathirvelu等[8]得出黄果茄对棉铃虫具有毒性作用。Parmar Komal M等[9]研究表明黄果茄对糖尿病大鼠创面愈合具有很好的效果。
本试验采用超声波辅助提取黄果茄中总黄酮,通过Al(NO3)3-NaNO2显色法测定黄果茄总黄酮含量,设计L9(34)正交试验优化黄果茄总黄酮提取工艺,通过显色反应可以对黄酮类化合物的种类及结构进行初步推测,通过测定总黄酮对DPPH·和·OH的清除率以及总抗氧化能力的方法评价其体外抗氧化活性,为黄果茄的药用开发提供试验研究基础。
1 材料与试剂
1.1 材料
黄果茄:采于云南省红河州个旧市卡房镇村边、路旁,晾晒至干,将晒干的黄果茄置于温度为60℃的鼓风干燥箱中烘干,冷却至30℃,粉碎,过筛,将其装入密封袋低温避光保存。
1.2 试剂
无水乙醇、氢氧化钠、抗坏血酸、亚硝酸钠、水杨酸、磷酸氢二钠(均为分析纯):天津市大茂化学试剂厂;硝酸铝(分析纯):北京康普汇维科技有限公司;硫酸亚铁(分析纯):天津市风船化学试剂科技有限公司;过氧化氢(分析纯):重庆创导化工有限公司;三氯化铁(分析纯):上海展云化工有限公司;钼酸铵(分析纯):天津市化学试剂四厂;DPPH、芦丁(标准品):Acros公司。
1.3 仪器和设备
UV-2600紫外可见分光光度计:日本岛津公司;WJX-100高速多功能粉碎机:上海缘沃工贸有限公司;KQ-500B超声波清洗器:昆山市超声仪器有限公司;SHZ-Ⅲ循环水式多用真空泵:河南省豫华仪器有限公司;DHG-9245A鼓风干燥箱:江苏同君仪器科技有限公司;FA3204B电子天平:上海天美天平仪器有限公司;DLAB移液器:大龙兴创实验仪器有限公司。
2 方法
2.1 提取工艺研究
2.1.1 试验设计
2.1.1.1 单因素试验设计
以黄果茄总黄酮提取率为考察指标,分别探讨提取时间[10、20、30、40、50、60 min,固定料液比 1 ∶50(g/mL)、温度 30℃、乙醇体积分数30%]、料液比[1 ∶20、1 ∶30、1 ∶40、1 ∶50、1 ∶60、1 ∶70(g/mL),固定提取时间30min、温度30℃、乙醇体积分数30%]、温度[30、40、50、60、70、80 ℃,固定提取时间 30 min、料液比 1∶60(g/mL)、乙醇体积分数 30%]、乙醇体积分数[30%、40%、50%、60%、70%、80%,固定提取时间30 min、料液比 1 ∶60(g/mL)、温度 50℃]对黄果茄总黄酮提取率的影响。在相同条件下结果平行测定3次,取平均值。
2.1.1.2 正交试验优化及黄果茄总黄酮含量的测定
根据单因素试验结果,设计L9(34)正交试验优化黄果茄总黄酮的最佳提取工艺,所有试验平行测定3次[10]。正交优化分析出黄果茄总黄酮的最佳提取工艺,并在最佳工艺条件下测定黄果茄中总黄酮含量,验证优化试验的合理性。
2.1.2 试验方法
2.1.2.1 测定方法原理
黄酮化合物与亚硝酸钠发生氧化还原反应,然后与铝离子结合形成稳定的化合物,氢氧化钠可使其显色,在可见光区处有特征吸收峰,其吸光度值与总黄酮质量浓度呈线性关系[11]。
2.1.2.2 黄果茄供试品溶液的制备
称取1.0 g黄果茄粉末于不同试验条件下通过超声波辅助对黄果茄总黄酮进行提取,趁热抽滤,定容,得供试品溶液。
2.1.2.3 黄果茄提取液中黄酮类化合物的鉴定
参考文献[12]采用氢氧化钠法、浓氨水法、三氯化铁法和盐酸-镁粉法,通过观察其颜色变化推测黄果茄提取液中黄酮类化合物的种类和结构。
2.1.2.4 检测波长的选择与标准曲线的绘制
精确称取芦丁标准品20.00 mg,加入80%乙醇溶解,定容至100 mL,得0.20 mg/mL芦丁标准溶液。
采用Al(NO3)3-NaNO2显色法[13],配制标准系列溶液,以不加芦丁标液的溶液为参比,在300 nm~700 nm范围内扫描,检测最大吸收峰,确定出最佳检测波长。并在最佳检测波长条件下检测系列标准溶液的吸光度A。以芦丁质量浓度(μg/mL)为横坐标,吸光度A为纵坐标,绘制芦丁标准曲线,通过软件Origin 9.0得到线性回归方程。
2.1.2.5 黄果茄总黄酮含量测定方法
准确移取供试品样液1.00 mL于10 mL容量瓶中,按2.1.2.4的方法加入相同剂量相同种类的试剂,测定其吸光度,利用线性回归方程计算出供试品溶液中总黄酮的质量浓度,然后按下列公式计算出黄果茄总黄酮提取率。总黄酮提取率计算公式为:
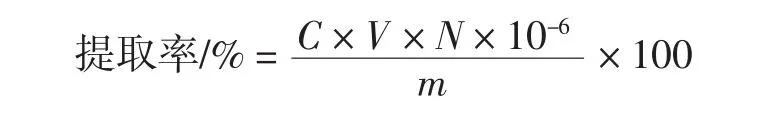
式中:C为供试品样液的质量浓度,μg/mL;V为供试品样液总体积,mL;N为稀释倍数;m为黄果茄粉末质量,g。
2.2 黄果茄总黄酮体外抗氧化活性研究
2.2.1 ·OH清除率的测定
根据寇亮等[14]的测定方法,稍作改动。取5个10 mL的容量瓶并编号,准确移取质量浓度0.05、0.10、0.15、0.20、0.25 mg/mL的黄果茄样品溶液各1.00 mL于相应编号的容量瓶中,按顺序加入1.00mL5mmol/mL H2O2溶液、2.00 mL 5 mmol/mL FeSO4溶液和5.00 mL 5 mmol/mL水杨酸乙醇溶液,蒸馏水定容至刻度线,摇匀,将容量瓶置于温度为37℃的恒温水浴锅中反应30 min,于510 nm处测定其吸光度值Ax。另取5个10 mL的容量瓶并编号,以不加入H2O2溶液作为试验对照组,其余按照上述步骤操作,测定其吸光度值Ax0。再取一个10 mL的容量瓶,以不加黄果茄总黄酮样品溶液作为空白对照,其余操作同上,测定其吸光度值A0。同时,以相同质量浓度的VC溶液作为阳性对照。按以下公式计算黄果茄总黄酮对·OH的清除率:

式中:Ax是样品组吸光度值;Ax0是试验对照组吸光度值;A0是空白组溶液的吸光度值。
2.2.2 DPPH·的清除率的测定
参照王晓林等[15]的测定方法,稍作改动。用电子天平精确称取10.0 mg DPPH于烧杯中,用无水乙醇溶解后转移至100 mL容量瓶中,定容,充分摇匀,得到质量浓度为0.10 mg/mL的DPPH标准溶液,并将其置于暗处备用。取5个10 mL的容量瓶并编号,准确移取质量浓度 0.05、0.10、0.15、0.20、0.25 mg/mL 的黄果茄样品溶液各2.00 mL于相应编号的容量瓶中,加入2.00 mL的DPPH标准溶液,用无水乙醇定容,避光放置30 min后,于517 nm波长下测定吸光度值Ax。另外取5个10 mL的容量瓶并编号,用无水乙醇代替DPPH标准溶液作为对照组,其余按照上述步骤操作,测定其吸光度值Ax0。再另取一个10 mL容量瓶,不加黄果茄样品溶液,其余操作同上,测定其吸光度值A0。同时,以相同质量浓度的VC溶液作为阳性对照。按以下公式计算黄果茄总黄酮对DPPH·的清除率:

式中:Ax为样品组吸光度值;Ax0为试验对照组吸光度值;A0为空白组溶液的吸光度值。
2.2.3 总抗氧化能力测定
参照曹旭等[16-17]的测定方法,稍作改动。取5个10 mL的容量瓶并编号,准确移取质量浓度0.05、0.10、0.15、0.20、0.25 mg/mL的黄果茄样品溶液各2.00 mL于相应编号的容量瓶中,依次加入2.50 mL 0.6 mol/mL硫酸、2.50 mL 28 mmol/mL磷酸氢二钠溶液和2.50 mL 4 mmol/mL的钼酸铵溶液,摇匀,将其置于温度为95℃的恒温水浴锅中反应90 min,于695 nm处测定其吸光度值A。另外取一个10 mL的容量瓶,以2.00 mL无水乙醇溶剂代替样品液作为参比溶液。同时,以相同质量浓度的VC溶液作为阳性对照,与黄果茄总黄酮的总抗氧化能力进行比较。吸光度值越大表示黄果茄总黄酮的还原能力越强,即抗氧化能力越强,因此,吸光度值可作为评价总抗氧化能力大小的指标。
2.3 数据分析
全文涉及的试验数据结果处理采用Origin9.0软件统计计算并作图,工艺优化采用L9(34)正交优化分析方法。
3 结果与分析
3.1 检测波长的确定
检测波长的测定结果见图1。
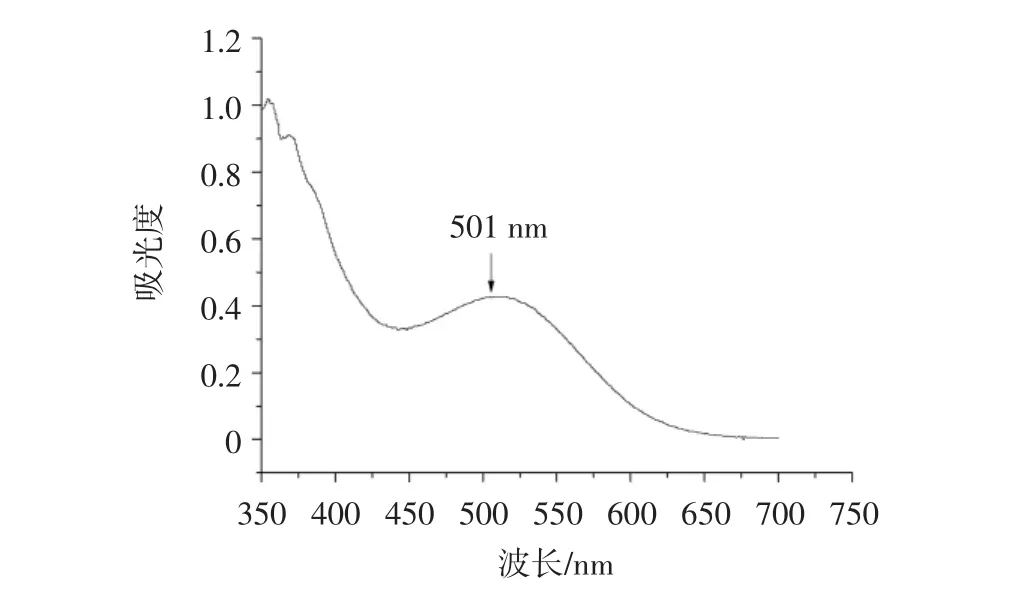
图1 检测波长的确定Fig.1 Determination of detection wavelength
由图1可知,测定溶液在501 nm处出现峰值,因此确定黄酮类化合物的检测波长为501 nm。
3.2 芦丁标准曲线的确定
芦丁标准曲线的测定结果见图2。

图2 芦丁标准曲线Fig.2 Standard curve of rutin
由图2可知,标准曲线的线性回归方程为y=0.010 8x+0.001 5,R2=0.999 7。测定范围内,线性较好,在此区间内芦丁质量浓度与吸光度呈线性增长。
3.3 黄果茄提取液中黄酮类化合物的鉴定结果
黄果茄提取液中黄酮类化合物的鉴定结果见表1。

表1 黄酮类化合物的颜色反应Table 1 Color reaction results of the flavonoids compound
由此可以初步推断,黄果茄提取液中总黄酮主要为黄酮类、二氢黄酮类、查尔酮类和异黄酮类,且化合物中可能含有游离的酚羟基。由于表1所列的反应颜色,只是某类黄酮体中大多数化合物所具有的共同颜色,要明确黄果茄提取液中的具体黄酮成分仍需做进一步的鉴定[18]。
3.4 单因素的试验结果
3.4.1 提取时间对总黄酮提取率的影响
提取时间对总黄酮提取率的影响结果见图3。
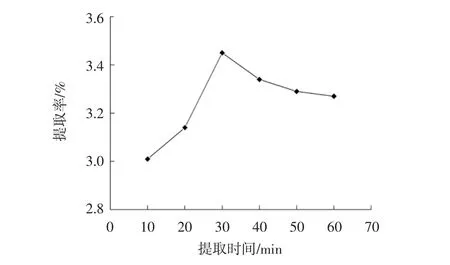
图3 提取时间对总黄酮提取率的影响Fig.3 Effect of extraction time on extraction rate of total flavonoids
由图3可知,随着提取时间的增加,黄果茄总黄酮提取率呈先上升后下降的趋势,最佳提取时间为30 min,之后总黄酮提取率逐渐下降。其原因可能是:随着提取时间的增加,黄果茄中的总黄酮不断溶于乙醇溶液中,提取率不断升高,当总黄酮全部溶出后,较长的提取时间可能导致黄酮类物质发生降解,提取率下降[19]。因此选取提取时间30 min为正交优化依据。
3.4.2 料液比对总黄酮提取率的影响
料液比对总黄酮提取率的影响结果见图4。

图4 料液比对总黄酮提取率的影响Fig.4 Effect of solid-liquid ratio on extraction rate of total flavonoids
由图4可知,随着溶剂体积不断增大,黄果茄总黄酮提取率不断增大,最佳料液比为1∶60(g/mL),之后提取率趋于平缓。因此选取料液比1∶60(g/mL)为正交优化依据。
3.4.3 温度对总黄酮提取率的影响
温度对总黄酮提取率的影响结果见图5。

图5 温度对总黄酮提取率的影响Fig.5 Effect of temperature on the extraction rate of total flavonoids
由图5可知,黄果茄总黄酮提取率随温度升高先增大后减少,超声温度50℃为最佳,之后总黄酮提取率显著下降。其原因可能是:温度越高分子运动的速率越快,从而使黄酮类物质更易溶于溶剂中,可是温度过高会破坏黄酮类化合物的结构及生物活性,还会增加其它杂质的析出,导致提取率急剧下降[20]。因此,选取提取温度50℃为正交优化依据。
3.4.4 乙醇体积分数对总黄酮提取率的影响
乙醇体积分数对总黄酮提取率的影响结果见图6。

图6 乙醇体积分数对总黄酮提取率的影响Fig.6 Effect of ethanol volume fraction on total flavonoids extraction rate
由图6可知,乙醇体积分数不断增大,黄果茄总黄酮提取率先增大后减小,乙醇体积分数50%时总黄酮提取率最佳,之后总黄酮提取率显著下降。其原因可能是:乙醇溶液有利于黄酮类化合物溶出,增大乙醇体积分数,黄果茄中的黄酮类物质更容易溶出。但是,过大的乙醇体积分数会使大分子物质发生凝聚而使溶液变得浓稠,降低总黄酮的溶出率。因此,选取乙醇体积分数50%为正交优化依据。
3.5 正交试验结果
L9(34)正交试验因素水平表见表2。试验设计及黄果茄总黄酮提取率的结果见表3。

表2 正交试验因素与水平表Table 2 Factors and levels of orthogonal design
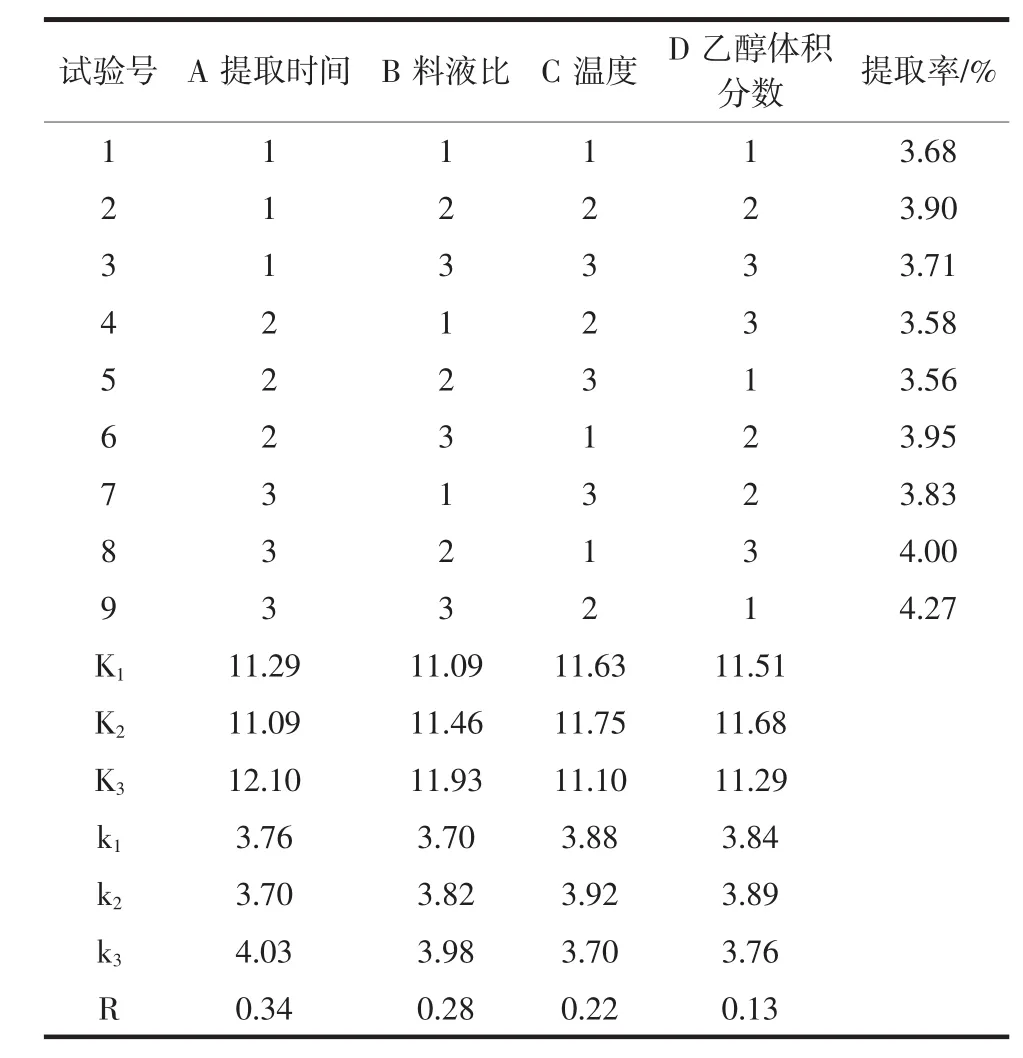
表3 正交试验结果Table 3 Results of orthogonal experimental
通过极差分析可以看出,各因素对黄果茄总黄酮提取率的影响程度为A>B>C>D,即时间是影响黄果茄总黄酮提取率的主要因素,其次是料液比、温度、乙醇体积分数。其最佳提取工艺条件为A3B3C2D2,即提取时间 40 min,料液比 1 ∶70(g/mL),温度50℃,乙醇体积分数50%。在此最佳提取工艺条件重复试验3次,测得黄果茄总黄酮提取率为4.35%。其中A3B3C2D1为9组中的实际最优组合,在该工艺条件下再次重复试验3次,测得黄果茄总黄酮提取率为4.28%。因此,确定黄果茄总黄酮的最佳提取工艺条件组合为A3B3C2D2。
3.6 黄果茄总黄酮体外抗氧化活性研究
3.6.1 黄果茄总黄酮对·OH的清除效果
黄果茄总黄酮对·OH的清除效果见图7。

图7 总黄酮和VC对·OH的清除作用Fig.7 Hydroxyl radical scavenging effects of total flavonoids and VC
由图7可知,随着黄果茄总黄酮质量浓度的增加,对·OH清除能力逐渐增强,质量浓度超过100 μg/mL后,清除率增加趋势缓慢。在质量浓度为50 μg/mL~130 μg/mL的范围内时,相同质量浓度的VC溶液的清除能力小于黄果茄总黄酮提取液,当质量浓度超过130 μg/mL时,VC对·OH的清除能力强于黄果茄总黄酮提取液。
3.6.2 黄果茄总黄酮对DPPH·的清除效果
黄果茄总黄酮对DPPH·的清除效果见图8。

图8 总黄酮和VC对DPPH·的清除作用Fig.8 DPPH radical scavenging effects of total flavonoids and VC
由图8可知,随着黄果茄总黄酮质量浓度的不断增加,对DPPH·清除能力逐渐增强,当质量浓度大于150 μg/mL时,清除率不再有明显的增大。VC对DPPH自由基有着较强的清除能力,相同质量浓度下,VC的清除能力始终强于黄果茄总黄酮,且VC溶液质量浓度为50 μg/mL时,清除率就已经达到90%以上,之后虽然质量浓度不断增加,但清除率不再较大幅度地增加。
3.6.3 黄果茄总黄酮的总抗氧化能力测定结果
黄果茄总黄酮的总抗氧化能力测定结果见图9。

图9 总黄酮和VC的总抗氧化能力的测定Fig.9 Determination of total antioxidant activity of total flavonoids and VC
由图9可知,VC和黄果茄总黄酮的总抗氧化能力随质量浓度的增加而不断增强,两者之间呈线性关系。当质量浓度为50 μg/mL时,黄果茄总黄酮与VC的总抗氧化能力相当,而质量浓度超过50 μg/mL后,VC的总抗氧化能力明显强于黄果茄总黄酮。
4 结论
本试验选择超声波辅助提取方法,乙醇为提取溶剂,对黄果茄总黄酮的提取工艺、种类及结构的鉴定及体外抗氧化活性进行相关研究。通过一系列显色反应,初步推断黄果茄提取液中黄酮类化合物主要为黄酮类、二氢黄酮类、查尔酮类和异黄酮类。探讨了提取时间、料液比、温度及乙醇体积分数对黄果茄总黄酮提取率的影响,在单因素试验基础上设计正交试验优化提取工艺条件,得到提取时间40 min,料液比1∶70(g/mL),温度50℃,乙醇体积分数50%为黄果茄总黄酮的最佳提取工艺条件。在此条件下,黄果茄总黄酮提取率可达4.35%。最后,通过探究黄果茄总黄酮对·OH、DPPH·的清除率及总抗氧化能力,说明在受测范围内,黄果茄总黄酮具有较强的体外抗氧化活性。目前,对黄果茄的化学成分研究报道甚少,物质基础不明确,难以确定黄果茄中主要的活性成分。本次研究优化了黄果茄总黄酮的提取工艺,初步推断黄酮类化合物的类型,并探究其体外抗氧化活性,对后续黄果茄的化学成分提取分离和抗病机制研究具有一定的参考价值。