植物乳杆菌发酵强化贝母-雪梨汁抗氧化性能的研究
2020-12-18刘金龙危晶晶白敬赵国群王勇孙旭关军锋
刘金龙 ,危晶晶,白敬,赵国群,王勇,孙旭,关军锋
(1.河北科技大学生物科学与工程学院,河北石家庄050018;2.河北省发酵工程技术研究中心,河北石家庄050000)
乳酸菌发酵果汁,又称水果酵素,是一种利用乳酸菌发酵鲜果而成的饮品。乳酸菌发酵果汁过程中产生的有机酸、醛类、醇类和羧酸类等芳香成分,可改善其口感风味[1],且有文献表明:乳酸菌发酵可促进植物细胞壁降解[2-4],有利于细胞中有效成分如抗氧化物质的释放,增强果汁益生功能。
雪梨含有丰富的酚类物质[5],表现出良好的抗炎及抗氧化活性[6-7]。雪梨制品,如雪梨膏、雪梨浆等,具有清咽润喉的功能[8]。贝母含有多酚[9]、黄酮等多种抗氧化成分[10],具有清热润肺,化痰止咳等功效[11]。人们常将贝母与雪梨组合食用,强化其益生功能,如:“贝母炖梨”、“贝母蒸梨”、“鲜梨贝母汤”等。
本研究将贝母、雪梨汁二者组合,并添加植物乳杆菌对其进行发酵,研究了发酵过程中影响抗氧化物质多酚、黄酮释放的主要因素,并基于正交试验对其工艺进行优化,开发出一种具有优良抗氧化性能[12-14]的新型功能性饮品。
1 材料与方法
1.1 材料与仪器
植物乳杆菌Zw-1:河北省发酵工程技术研究中心保藏菌株;雪花梨:河北省赵县;贝母:市售。
1.2 主要试剂
蛋白胨(BR)、牛肉膏(BR)、酵母浸粉(BR)、柠檬酸三铵(AR)、亚硝酸钠(AR)、硝酸铝(AR)、氢氧化钠(AR):北京奥博星生物技术公司;葡萄糖(AR)、乙酸钠(AR)、磷酸氢二钾(AR)、碳酸钠(AR)、铁氰化钾(AR)、三氯乙酸(AR):天津市永大化学试剂有限公司;吐温80(AR):上海源叶生物科技有限公司;硫酸镁(AR)、硫酸锰(AR)、无水乙醇(AR):天津市北方天医化学试剂厂;蔗糖:市售。
1.3 培养基
1.3.1 种子培养基
蛋白胨1.0 g,牛肉膏1.0 g,酵母浸粉0.5 g,葡萄糖2.0 g,柠檬酸三铵 0.2 g,吐温 80 0.1 mL,乙酸钠 0.5 g,磷酸氢二钾0.2 g,硫酸镁0.042 g,硫酸锰0.025 g,调pH值为6.8~7.0,蒸馏水定容至100 mL。121℃灭菌20 min。
1.3.2 基础发酵培养基
优良雪花梨梨汁100 mL,贝母粉(过40目筛)3 g,蔗糖15g。于85℃水浴灭菌30min,迅速冷却至40℃。
1.4 方法
1.4.1 种子培养
取斜面保藏的植物乳杆菌Zw-1一环,接种于100 mL种子培养基,36℃恒温培养12 h至对数生长期。
1.4.2 发酵培养
取5mL种子培养液,接种于基础发酵培养基,36℃恒温培养51 h。
1.4.3 样品制备
发酵贝母-雪梨汁与对比样品(贝母-雪梨汁和梨汁)的制备。
发酵贝母-雪梨汁:取100 mL雪梨汁,加贝母3 g,蔗糖15 g,于85℃水浴灭菌30 min,迅速冷却至40℃,接入3%种子培养液,于36℃恒温培养51 h;贝母-雪梨汁制备:取100 mL雪梨汁,加贝母3 g,蔗糖15 g,于85℃水浴灭菌30 min,迅速冷却至40℃,于36℃恒温培养51 h;梨汁制备:取100 mL雪梨汁,加蔗糖15 g,于85℃水浴灭菌30 min,迅速冷却至40℃。于36℃恒温培养51 h。
1.4.4 发酵工艺条件的单因素试验
1.4.4.1 植物乳杆菌接种量对贝母-雪梨汁多酚、黄酮释放量的影响
取基础发酵培养基100 mL,以种子培养液接种量为变量,设置接种量分别为1%、3%、5%、7%、9%,于36℃发酵培养51h。取上层清液,测定其多酚、黄酮含量。
1.4.4.2 贝母添加量对贝母-雪梨汁多酚、黄酮释放量的影响
取基础发酵培养基100 mL,以贝母粉添加量为变量,设置梯度为 1、2、3、4、5 g,于 36 ℃发酵培养 51 h。取上层清液,测定其多酚、黄酮含量。
1.4.4.3 蔗糖添加量对贝母-雪梨汁多酚、黄酮释放量的影响
取基础发酵培养基100 mL,以蔗糖添加量为变量,设置梯度为 5、10、15、20、25 g,于 36 ℃发酵培养51 h。取上层清液,测定其多酚、黄酮含量。
1.4.4.4 发酵时间对贝母-雪梨汁多酚、黄酮释放量的影响
取基础发酵培养基100mL,于36℃进行发酵培养,以发酵时间为变量,设置梯度为 31、36、41、46、51 h 。取上层清液,测定其多酚、黄酮含量。
1.4.5 贝母-雪梨汁正交优化试验
以多酚、黄酮释放量为指标,选择贝母添加量、发酵时间、植物乳杆菌接种量、蔗糖添加量为单因素,进行四因素三水平L9(34)正交试验,见表1。
1.5 多酚、黄酮含量测定及抗氧化性能检测方法
1.5.1 多酚浓度的测定
采用Folin-Ciocalteu比色法。取1mL样品于25mL比色管中,加入5 mL蒸馏水,1 mL显色剂和3 mL 75%碳酸钠溶液,摇匀,显色2 h。以蒸馏水代替样品作为空白对照。在765 nm波长下测定吸光度值,计算多酚浓度。

表1 因素水平表Table 1 Factor level table
1.5.2 黄酮浓度的测定
采用NaNO2-Al(NO3)3-NaOH比色法。取1 mL样品于10 mL容量瓶,依次加入4 mL 70%乙醇和0.3 mL 5%NaNO2溶液,静置6min。加入0.3mL10%Al(NO3)3静置6 min。再加入4 mL 4%NaOH溶液,静置10 min,用70%乙醇定容。以70%乙醇代替样品作为空白对照。在510 nm波长下测定吸光度值,计算黄酮浓度。
1.5.3 还原力的测定-普鲁士蓝法
取样品1 mL于试管中,加入2.0 mL 0.2 mol/L磷酸缓冲液(pH 6.6)和1%铁氰化钾溶液混匀,50℃水浴反应20 min后迅速冷却至25℃,立即加入2.0 mL 10%三氯乙酸终止反应。5 000 r/min离心10 min,吸取上清液2.0 mL,加入2.0 mL蒸馏水和0.4 mL 0.1%FeCl3溶液,混匀,暗室静置反应30 min,于700 nm波长处测定吸光度值[15]。
2 结果与分析
2.1 植物乳杆菌发酵贝母-雪梨汁促进多酚、黄酮的释放
植物乳杆菌发酵贝母-雪梨汁,有利于促进多酚、黄酮的释放,如图1所示。
由图1可知,与贝母-雪梨汁相比,植物乳杆菌发酵后的贝母-雪梨汁中多酚、黄酮含量分别增加了25.71%和16.62%,与雪梨汁相比,贝母-雪梨汁复合物中多酚、黄酮含量也分别提高了17.37%和9.89%。且发酵贝母-雪梨汁、贝母-雪梨汁与雪梨汁中多酚、黄酮含量对比差异显著(P<0.05)。分析其原因可能为:在长时间的浸泡过程中,贝母细胞中的多酚、黄酮等有效成分借助于渗透和扩散作用,逐渐释放到梨汁中,使得梨汁中多酚、黄酮含量升高。当利用植物乳杆菌对贝母-雪梨汁进行发酵时,植物乳杆菌可能分泌一些有利于贝母细胞壁降解的酶系,提高贝母胞内物质的释放效率,从而进一步提高贝母-雪梨汁中多酚、黄酮的含量。

图1 不同雪梨汁样品多酚、黄酮含量比较Fig.1 Comparison of polyphenols and flavonoids in different pear juice samples
2.2 发酵贝母-雪梨汁与贝母-雪梨汁、梨汁的抗氧化性能比较
将发酵贝母-雪梨汁、贝母-雪梨汁和梨汁进行梯度稀释,稀释后浓度分别为样品的 1/2、1/4、1/5、1/8和1/10,原样品浓度设为1,稀释浓度以0.1、0.125、0.2、0.25、0.5表示,纵坐标为吸光度值。各样品Fe3+还原力测定结果见图2。

图2 不同雪梨汁样品Fe3+还原力测定结果比较Fig.2 Comparison of Fe3+reducing power determination results of different pear juice samples
研究证实,活性成分的抗氧化性能与还原力密切相关,即还原力越强,抗氧化活性越强。由图2可知,发酵贝母-雪梨汁、贝母-雪梨汁与雪梨汁3种样品的还原活性,均随样品浓度的增大而增大。更重要的是,与浸泡相比,贝母-雪梨汁经植物乳杆菌发酵后,可显著提高其还原活性,且浓度越高差异越明显。
李伟伟等[16]研究发现益生菌发酵可降低膳食纤维粒径,使其内部结构由原来致密的网状结构变得蓬松易碎;发酵亦能显著降低不溶性膳食纤维含量,增加可溶性膳食纤维含量。本试验乳酸菌在以植物类中药为基质进行发酵培养时,可能产生相应的物质定向作用于中药细胞壁,促进胞内有效成分的释放。由此可知,当将植物乳杆菌用于贝母-雪梨汁发酵培养时,该菌极有可能基于贝母细胞壁成分产生相应的复合降解酶系,加速贝母细胞壁破损过程,促进贝母胞内多酚、黄酮等有效成分的释放,从而表现出更强的抗氧化活性。
2.3 植物乳杆菌发酵贝母-雪梨汁单因素及正交试验优化
为进一步提高植物乳杆菌发酵对贝母-雪梨汁抗氧化性能的强化作用,本文分别考察了植物乳杆菌接种量、贝母添加量、蔗糖添加量和发酵时间等因素对贝母-雪梨汁多酚和黄酮释放量的影响。在此基础上,以贝母-雪梨汁多酚和黄酮释放量为指标,基于四因素三水平的正交优化试验结果,获得植物乳杆菌发酵贝母-雪梨汁的最佳工艺条件。
2.3.1 植物乳杆菌发酵贝母-雪梨汁单因素试验
2.3.1.1 植物乳杆菌接种量对贝母-雪梨汁多酚、黄酮释放量的影响
植物乳杆菌接种量对贝母-雪梨汁多酚、黄酮释放量的影响见图3。

图3 植物乳杆菌接种量对贝母-雪梨汁多酚、黄酮释放量的影响Fig.3 Effect of Lactobacillus plantarum inoculum on the release of polyphenols and flavonoids in fritillaria-pear juice
如图3所示,在初始接种量较低时,随乳杆菌接种量的增加,贝母-梨汁发酵液中多酚和黄酮含量随之增加;当接种量为5%左右时,多酚、黄酮的含量均达到最大值;当接种量超过5%时,多酚、黄酮含量明显下降,其中黄酮含量下降尤为明显。由此可知,乳杆菌接种量将直接影响贝母-梨汁发酵液中多酚和黄酮的含量。当乳杆菌接种量过低时,发酵过程中植物乳杆菌活菌数过少,分泌到发酵体系中的破壁酶系较少,贝母细胞壁降解不彻底,导致细胞内多酚、黄酮等有效成分不能充分释放。当乳杆菌接种量过高时,发酵体系中含有较多的植物乳杆菌活菌,一方面发酵体系中的营养物质用于满足菌种自生生长所需,导致相关酶系合成不足,从而影响贝母细胞中多酚、黄酮等有效成分的释放;另一方面,发酵体系中的多酚、黄酮类物质可能被植物乳杆菌作为营养物质消耗掉,导致体系中多酚、黄酮类物质含量降低。因此,植物乳杆菌发酵贝母-雪梨汁时,以5%接种量为最佳。
2.3.1.2 贝母添加量对发酵贝母-雪梨汁多酚、黄酮释放量的影响
贝母和雪梨汁作为主要发酵基质,其配比对发酵过程中多酚、黄酮释放量也有重要影响。本试验以贝母添加量为变量,研究贝母与雪梨汁不同配比对发酵过程中多酚、黄酮释放量的影响结果见图4。

图4 贝母添加量对贝母-雪梨汁多酚、黄酮释放量的影响Fig.4 Effect of fritillaria addition on the release of polyphenol and flavonoids from fritillaria-pear juice
如图4所示,当贝母添加量小于0.3 g/L时,多酚、黄酮的含量随贝母添加量的增加而显著增加;当贝母添加量超过0.3 g/L时,多酚、黄酮的含量则不再上升,整体趋于平衡。这一现象可能是由于在固定的发酵时间内,植物乳杆菌的浓度和分泌产生胞外酶量逐渐趋于饱和,因而多酚、黄酮释放量不会随发酵基质含量的增加而持续增加。因此,当贝母添加量为0.3 g/L时,发酵体系中多酚、黄酮的含量达到最优值。
2.3.1.3 蔗糖添加量对发酵贝母-雪梨汁多酚、黄酮释放量的影响
蔗糖既可作为植物乳杆菌发酵的碳源,也可改善发酵贝母-雪梨汁的口感,因此,在贝母-雪梨汁发酵体系中以蔗糖作为添加物。蔗糖添加量对发酵贝母-雪梨汁多酚、黄酮释放量的影响见图5。

图5 蔗糖添加量对贝母-雪梨汁多酚、黄酮释放量的影响Fig.5 Effect of sucrose addition on polyphenol and flavonoids release in fritillaria-pear juice
如图5所示,发酵液中多酚、黄酮含量随蔗糖添加量的增加,呈现先增加后减小的变化,当蔗糖添加量为15%时,发酵液中多酚、黄酮含量达到最大值。分析其原因可能为:当蔗糖含量过低时,发酵体系中乳杆菌数量较少,分泌产生的降解酶系亦较少。当蔗糖浓度过高时,抑制了植物乳杆菌的正常生长和胞外蛋白酶的分泌,导致贝母细胞破壁效果差,限制了多酚、黄酮等有效成分的释放。
2.3.1.4 发酵时间对贝母-雪梨汁多酚、黄酮释放量的影响
植物乳杆菌的生长发酵受时间以及发酵周期的影响。发酵时间对贝母-雪梨汁多酚、黄酮释放量的影响见图6。

图6 发酵时间对贝母-雪梨汁多酚、黄酮释放量的影响Fig.6 Effect of fermentation time on the release of polyphenols and flavonoids in fritillaria-pear juice
如图6所示,与上述3种单因素影响不同,植物乳杆菌发酵时间对贝母-雪梨汁中多酚和黄酮释放量影响并不完全一致。尽管多酚和黄酮释放量随发酵时间呈现先增加后减少的变化曲线,但发酵体系中黄酮含量在41 h时达到最大值,随后急剧下降,而多酚含量在46 h时达到最大值,滞后于黄酮含量峰值的出现时间。这一现象可能受多酚、黄酮分子量大小的影响,不同分子量的物质从胞内释放速率略有差异。整体而言,发酵初期随着发酵体系中乳杆菌数量的增加,贝母和雪梨细胞壁破碎程度增加,大量的多酚、黄酮被释放到发酵液中;但随着发酵时间的延长,底物不断消耗,部分多酚、黄酮可能被乳杆菌消耗以满足自身生长需要,导致发酵贝母-雪梨汁中多酚、黄酮的含量产生下降趋势。
2.3.2 植物乳杆菌发酵贝母-雪梨汁最佳工艺研究
对影响贝母-雪梨汁乳杆菌复合发酵的贝母添加量(A)、发酵时间(B)、乳杆菌接种量(C)和蔗糖添加量(D)4个因素进行三水平正交试验优化,以贝母-雪梨汁发酵体系中的多酚和黄酮含量为评价指标进行加权综合评定,试验结果如表2、表3所示。

表2 正交试验表Table 2 Orthogonal test table

续表2 正交试验表Continue table 2 Orthogonal test table
由表2的结果可知:以多酚含量为评价指标时,4个因素对发酵贝母-雪梨汁的影响依次为:发酵时间(B)>贝母添加量(A)>乳杆菌接种量(C)>蔗糖添加量(D),多酚含量最高的工艺参数组合为:A2B2C1D3,即贝母添加量为0.3 g/L,发酵时间为41 h,乳杆菌接种量为3%,蔗糖添加量为1.5 g/L。以黄酮含量为评价指标时,各因素对发酵贝母-雪梨汁的影响依次为:蔗糖添加量(D)>发酵时间(B)>乳杆菌接种量(C)>贝母添加量(A),黄酮含量最高的工艺参数组合为:A2B2C2D3,即贝母添加量为0.3 g/L,发酵时间为41 h,乳杆菌接种量为5%,蔗糖添加量为1.5 g/L。多酚和黄酮含量最高值对应的最优工艺参数组合分别为:A2B2C1D3和A2B2C2D3,二者差异在于C工艺参数的不同。由表3正交试验方差分析可知,因素C对发酵贝母-雪梨汁多酚、黄酮含量的影响为不显著因素。以C为变量,进行验证试验,结果发现多酚、黄酮含量最高的工艺组合为A2B2C2D3,即贝母添加量为0.3 g/L,发酵时间为41 h,乳杆菌接种量为5%,蔗糖添加量为1.5 g/L,测得多酚含量为298.75 mg/L,黄酮含量为961.27 mg/L。
由表3正交试验方差分析可知:贝母添加量(A)对于贝母-雪梨汁发酵液中多酚和黄酮的含量均有显著影响;发酵时间(B)对贝母-雪梨汁发酵液中多酚含量影响显著;蔗糖添加量(D)对发酵液中黄酮含量影响显著。乳杆菌接种量(C)对多酚、黄酮含量的影响不显著。

表3 正交试验方差分析表Table 3 Orthogonal test analysis of variance
2.4 植物乳杆菌发酵贝母-雪梨汁工艺优化前后抗氧化能力测定
比较不同稀释浓度(0.1、0.125、0.2、0.5、1)下发酵贝母-雪梨汁优化前后抗氧化能力的变化见图7。
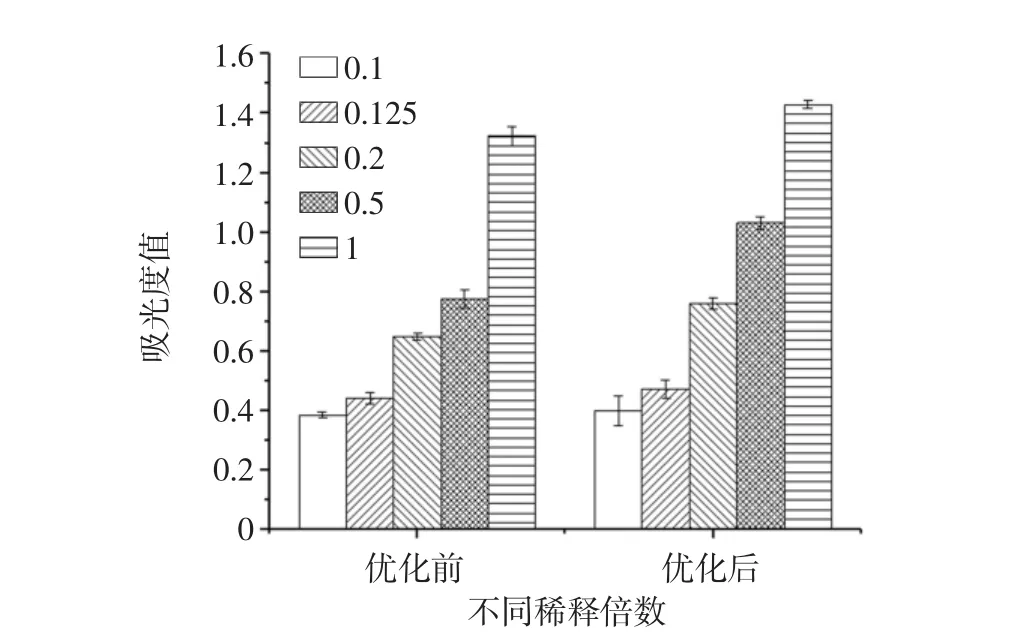
图7 植物乳杆菌发酵贝母-雪梨汁工艺优化前后抗氧化能力测定Fig.7 Determination of antioxidant capacity of Lactobacillus plantarum fermented fritillaria-pear juice before and after optimization
由图7可知,优化后的植物乳杆菌发酵贝母-雪梨汁抗氧化能力较优化前有明显提高,样品浓度越高时,抗氧化效果差距越明显(p<0.05),与之前测定的发酵液中多酚和黄酮类物质含量结果一致。结果表明,发酵贝母-雪梨汁新型功能性饮料的抗氧化性能与多酚、黄酮的含量呈正相关,即多酚、黄酮含量越高,抗氧化效果越明显。
3 结论
该研究通过植物乳杆菌发酵的方式,对贝母-雪梨汁的抗氧化功能进行强化,以生产出具有保健功能的贝母-雪梨汁饮品。结果发现,乳杆菌发酵可显著增加贝母-雪梨汁中多酚和黄酮的含量,与未发酵组相比二者含量分别提高了33.03%和27.60%,且表现出更好的抗氧化效果。
以多酚和黄酮含量为指标,通过正交试验优化获得植物乳杆菌发酵贝母-雪梨汁的最佳工艺条件:植物乳杆菌接种量5%,蔗糖添加量1.5 g/L,发酵时间41 h,贝母添加量0.3 g/L,最终发酵贝母-雪梨汁中多酚含量为298.75 mg/L,黄酮含量为961.27 mg/L。发酵贝母-雪梨汁口感良好,具有良好的抗氧化功能,是理想的新型保健饮品,具有一定的发展前景。
