不同提取方法对南酸枣果胶多糖理化性质及抗氧化作用的影响
2020-12-18张阳王文君谭妙英李景恩
张阳,王文君,2,谭妙英,李景恩,2,*
(1.江西农业大学食品科学与工程学院,江西南昌330045;2.江西省天然产物与功能食品重点实验室,江西南昌330045)
南酸枣系漆树科南酸枣属植物,其果实又名五眼果、山枣、醋酸果,主要分布于我国湖北、湖南、福建、江西、四川等地。南酸枣鲜果成熟时呈黄金色,椭圆形,生食略带酸涩,果实中富含丰富的果胶物质,常被加工成酸枣糕、酸枣蜜饯、酸枣功能性饮料、酸枣软糖等[1-5]。果胶除了在食品加工中可作为胶凝剂、增稠剂、乳化剂、质构改良剂等,还具有抗氧化、调节免疫和抗癌等生理活性[6-7]。工业上主要从苹果渣和柑橘皮中提取果胶,随着人们对食品加工多样性的需求,更多不同结构和功能的果胶产品亟待研究与开发。
目前果胶的提取方法主要包括水提法、酸法、碱法和螯合法等。其中水提法只能提取一些易溶于水的果胶,大量不溶于水的果胶将被浪费[8]。酸法是商业化生产果胶最常用的方法,该法将非水溶性的原果胶及果胶盐在酸性条件下转化成水溶性果胶,有利于提高果胶的提取率[9];碱法则是通过释放与多酚或其他物质结合的果胶组分,以增加果胶的水溶性[10];螯合法通过使用一些螯合剂,如草酸铵、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)等与果胶中的钙离子发生结合,从而降低果胶分子之间的交联,增加其在水中的溶解度[11]。提取方法不同,果胶组成和性质也会存在一定的差异。本研究分别采用水提法、酸法、碱法和草酸铵法从南酸枣果肉中提取不同的果胶多糖,并比较其理化性质及抗氧化作用,为进一步探讨果胶结构与功能间的关系提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
新鲜南酸枣:江西省赣州市崇义县,洗净、去核、烘干、粉碎后备用。
3-苯基苯酚、四硼酸钠、葡萄糖、考马斯亮蓝G-250、硼氢化钠:上海阿拉丁科技股份有限公司;D-半乳糖醛酸标准品、牛血清蛋白(bovine serum albumin,BSA)标准品:索莱宝生物科技有限公司;DPPH、光谱纯溴化钾、单糖标准品(鼠李糖、岩藻糖、阿拉伯糖、木糖、甘露糖、葡萄糖、半乳糖):美国Sigma公司;葡聚糖标准品(分子量分别为 1 152、5 200、11 600、23 800、48 600、148 000、273 000、410 000、668 000 Da):美国 Waters公司;所有试剂均为分析纯。
1.2 仪器与设备
V-5600型紫外分光光度计:上海元析仪器有限公司;TDL-A型离心机:上海安亭科学仪器厂;YP-2型压片机:上海山岳科学仪器有限公司;Nicolet-iS5型傅里叶变换红外光谱仪:美国热电公司;DZF-6090Z型真空干燥箱:上海跃进医疗器械有限公司;LC-10A型高效液相色谱仪、GC/MS-QP 2010型气相色谱-质谱联用仪:日本岛津公司;BRT105-104-102串联凝胶柱(8 mm×300 mm):深圳市博睿糖生物技术有限公司;Rxi-5Sil MS色谱柱(30 m×0.25 mm,0.25 μm):美国瑞思泰康科技(北京)有限公司。
1.3 试验方法
1.3.1 材料预处理
新鲜南酸枣经清水浸泡清洗后,去皮去核。果肉部分用无水乙醇回流1 h,用于去除部分单糖、寡糖、脂类及一些色素,重复回流5次,将所得果肉进行真空干燥,粉碎、过筛(20目)后备用。
1.3.2 4种果胶多糖的制备
称取6 g预处理过的南酸枣果肉样品4份,按料液比1∶20(g/mL)分别加入蒸馏水、50 mmol/L盐酸、50 mmol/L氢氧化钠和80 mmol/L草酸铵溶液,分别于25、85、0℃和 25℃,磁力搅拌提取 30 min,连续提取3次[12]。提取结束后,以4 000 r/min转速离心10 min,除去下层果肉残渣,向上清液中缓慢加入3倍量无水乙醇,搅拌均匀后静置过夜。充分沉淀后以4 000 r/min离心10 min,除去上清液,分别得到水提、酸提、碱提和草酸铵提果胶多糖。为了除去样品中残留的乙醇、酸、碱和草酸铵盐,需进行透析处理(截留分子量>3 400 Da)。以上样品经冷冻干燥后称重,按照公式(1)计算得率。

式中:m1为果肉质量,g;m2为果胶多糖质量,g。
1.3.3 基本化学组成测定
采用干燥法[13]测定水分含量;采用灼烧法[14]测定灰分含量;采用考马斯亮蓝法[15]测定蛋白质含量;采用间羟基联苯法[16]测定半乳糖醛酸含量;采用苯酚-硫酸法测定中性糖含量[17]。
1.3.4 高效凝胶渗透色谱法(high performance gel permeation chromatography,HPGPC)测定分子量
分别精确称取10 mg样品和标准品,配制成5 mg/mL的溶液,12 000 r/min离心10 min,上清液用微孔滤膜(0.22 μm)过滤,然后转移至2 mL进样瓶,进样量20 μL。以不同分子量的葡聚糖标准品(1 152、5 200、11 600、23 800、148 000、273 000、410 000 Da)作对照,制备标准曲线,测定样品的分子量。
1.3.5 中性单糖组成测定
精密称取2 mg果胶多糖样品,用1 mL三氟乙酸(2 mol/L)水解90 min,旋转蒸干。加入2 mL蒸馏水,及100 mg硼氢化钠进行还原,之后加冰醋酸中和,再次旋蒸浓缩。将产物置于110℃烘箱彻底烘干,然后加入1 mL醋酐进行乙酰化反应(100℃,1 h),冷却后加入3 mL甲苯,减压浓缩蒸干,重复操作4次~5次,除去反应物中残留的醋酐。将乙酰化产物用3 mL氯仿溶解并转移至分液漏斗,加少量蒸馏水充分振荡,除去水层,重复操作5次。下层氯仿层以少量无水硫酸钠干燥,定容至10 mL容量瓶备用。
上述乙酰化产物采用GC/MS-QP2010气相色谱-质谱联用仪进行单糖种类测定。采用Rxi-5Sil MS色谱柱(30 m×0.25 mm,0.25 μm)进行分离;升温程序设定为:起始温度120℃,以3℃/min升温至250℃/min后,保持5 min;进样口和检测器温度均为250℃,氦气作为载气,流速1 mL/min。
1.3.6 红外光谱测定
称取4种果胶样品,加入光谱纯的KBr晶体作为分散基质,研磨成粉后进行压片,利用Nicolet-iS5型傅里叶变换光谱仪在400 cm-1~4 000 cm-1范围进行扫描,比较4种果胶多糖的红外光谱特征。
1.3.7 抗氧化作用研究
分别采用DPPH自由基、羟基自由基(·OH)清除力和还原力试验,比较4种果胶多糖的抗氧化作用[18]。
1.3.8 数据分析
所有试验重复测定3次,试验数据采用平均数±标准差表示,用SPSS11.5统计软件进行方差分析,用邓肯法进行均值比较,以p<0.05作为显著性检验标准;IC50值采用Origin 6.0软件进行计算。
2 结果与分析
2.1 化学组成分析
4种方法所制备果胶多糖得率、水分、灰分、蛋白质、中性糖、半乳糖醛酸含量见表1。

表1 南酸枣果胶多糖的得率和基本化学组成Table 1 The yield and chemical compositions of pectin polysaccharides from Choerospondias axillaris fruit %
由表1可见,4种方法制备的果胶多糖得率分别为20.31%、25.33%、24.54%、21.71%。经统计学分析,各得率间存在显著性差异。酸法得率最高,其次是碱法、草酸铵法,水提法得率最低,可见酸、碱、盐均能不同程度提高南酸枣果胶多糖的得率。
4种果胶多糖的化学组成有一定的差别,其中碱法和草酸铵法的中性糖含量最高,其次是酸法,水提法中性糖含量最低。4种果胶多糖中,碱提样品的糖醛酸含量最高,其次是草酸铵法,但均未达到国标要求(≥65%,GB 25533-2010《食品安全国家标准食品添加剂果胶》)[19],因此,本文中制备的是一种果胶类多糖,需进一步纯化。
4种样品中,草酸铵法具有最低的灰分含量,可能是因为草酸铵在螯合Ca2+的同时,也螯合了其它离子,在透析过程中被一同除去。酸提果胶多糖的灰分含量最高,可能是由于提高溶液酸度有利于其它矿物质的溶出,而这些矿物质在多糖醇沉过程中被一同沉淀[20]。
2.2 不同提取方法对分子量的影响
利用HPGPC法对样品的分子量进行测定,结果如图1所示。
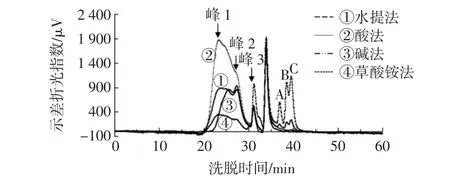
图1 4种南酸枣果胶多糖的分子量分布图Fig.1 Molecular weight distribution of four pectic polysaccharides from Choerospondias axillaris fruit
由峰A、B、C可知,草酸铵法和水提法得到的果胶多糖中含有部分游离寡糖。将不同分子量葡聚糖标品的峰位分子量(peak molecular weight,Mp)、重均分子量(weight-average molecular weight,Mw)和数均分子量(number-average molecular weight,Mn)取对数后对保留时间(retention time,RT)进行回归分析,分别得到lgMp-RT,lgMw-RT,lgMn-RT3条校正曲线(y1=-0.270 5x1+12.454,R2=0.997 4;y2=-0.285 1x2+12.969,R2= 0.994 5;y3=-0.266 6x3+12.261,R2=0.993 9)。根据保留时间,计算样品的分子量(见表2)。

表2 4种南酸枣果胶多糖的相对分子质量及其分布Table 2 The relative molecular weight and its distribution of four pectic polysaccharides from Choerospondias axillaris fruit
由图1和表2得出,不同方法制备的南酸枣果胶多糖分子量分布不均一,且分布范围较宽,基本都包含3种不同分子量的组分。除碱法外,其他3种样品的峰位分子量、重均分子量和数均分子量基本无显著性差异。水提多糖中1号和2号峰为主峰,重均分子量Mw 分别为 1.52×106Da和 1.41×105Da,分散系数(Mw/Mn)分别为1.85和1.59,表示分子量分布较为分散。酸提多糖2号峰的峰高有所下降,1号峰为主峰,Mw约2.01×106Da。碱提多糖出峰时间较晚,说明样品在碱性条件发生部分降解,分子量下降。草酸铵法多糖的出峰信号远低于其他方法,可能是由于样品纯度较低。
2.3 不同提取方法对中性糖组成的影响
图2是7种单糖标准品和4种南酸枣果胶多糖乙酰化衍生物的气相色谱图,各单糖标品的出峰顺序从左到右依次为鼠李糖、岩藻糖、阿拉伯糖、木糖、甘露糖、葡萄糖和半乳糖。依据出峰时间确定单糖种类,然后将峰面积分别代入各单糖标准曲线,计算摩尔百分比,结果见表3。
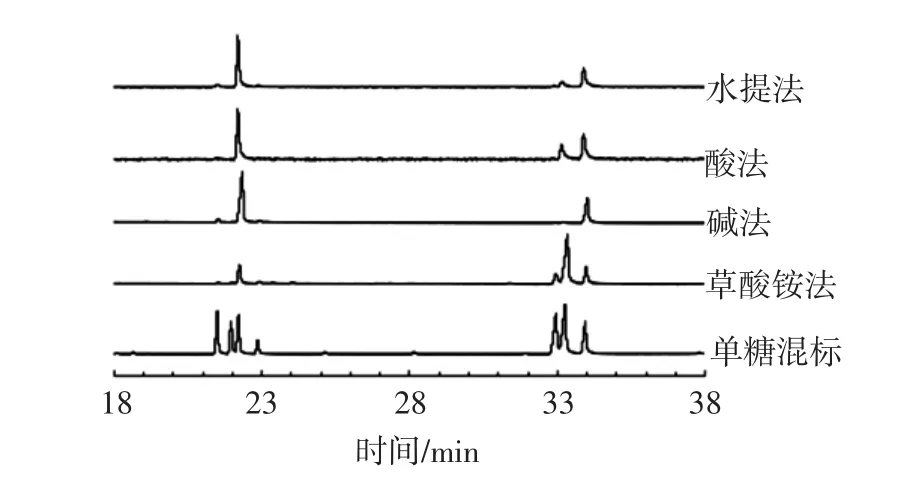
图2 单糖标准品和4种南酸枣果胶多糖乙酰化衍生物的气相色谱图Fig.2 Gas charomaogram of acetylated derivatives of monosaccharide standards and four pectic polysaccharides from Choerospondias axillaris fruit
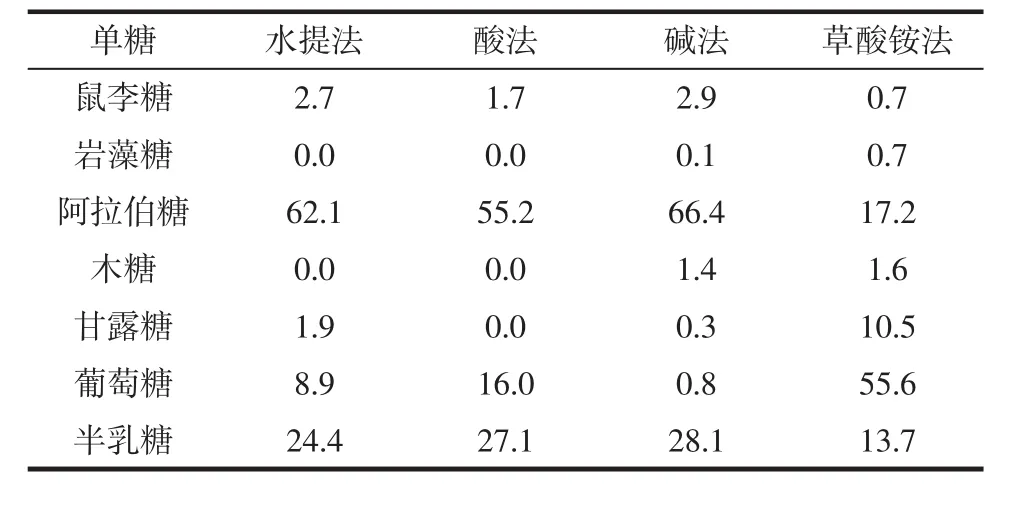
表3 4种南酸枣果胶多糖的中性糖单糖组成摩尔比Table 3 The molar ratio of neutral monosaccharide of four pectic polysaccharides isolated from Choerospondias axillaris fruit %
由表3可见,草酸铵法中葡萄糖和甘露糖含量较高,说明图1中的寡糖(峰A、峰B、峰C)主要由葡萄糖和甘露糖组成。其它3种方法制备的多糖中阿拉伯糖和半乳糖含量较高,而岩藻糖和木糖含量较少。鼠李糖含量均显示较低,表明南酸枣果胶可能属于RG II型鼠李半乳糖醛酸聚糖,即主链由α-1,4-糖苷键连接的线型半乳糖醛酸聚糖组成[21],精细结构还有待进一步研究。
2.4 红外光谱分析(Fourier transform infrared,FT-IR)
利用FT-IR法对4种样品的结构特点进行初步表征,结果见图3。

图3 4种南酸枣果胶多糖红外光谱图Fig.3 FT-IR of four pectic polysaccharides from Choerospondias axillaris fruit
红外光谱显示,4种果胶多糖在500cm-1~4000cm-1范围内均具有明显的糖类的特征吸收峰。在3200 cm-1~3 600 cm-1之间的宽峰,是糖分子内或分子间氢键O-H伸缩振动的结果;2 933 cm-1左右的肩峰是甲基(-CH3)和次甲基的(-CH2)的 C-H伸缩振动峰。1 600 cm-1~1 800 cm-1处的振动是果胶的典型吸收区域,这个区域包括 1 630 cm-1~1 650 cm-1和 1 740 cm-1~1 760 cm-1两个吸收峰,分别代表了自由羧基(-COOH)和酯化羧基(-COOR)的C=O振动,其中甲酯化羧基吸收峰的大小与果胶的酯化度成正比[22]。由图3可见,水提法、酸法、草酸铵法制备的果胶多糖在1 750 cm-1附近的振动峰依次减小,而碱法样品中该峰基本消失,可能是由于碱性条件下发生酯化的甲氧基被水解[23]。1 420 cm-1处吸收峰是C-H的变角振动,它和3 200 cm-1~3 600 cm-1处的C-H伸缩振动构成了糖环的特征吸收。另外,1 082 cm-1左右的强吸收峰是糖苷键C-O-C的非对称振动峰,为吡喃糖的特征吸收峰[24]。890 cm-1附近吸收峰表明有β-型糖苷键;在839 cm-1处的吸收峰表明有α-型糖苷键存在[25]。
2.5 抗氧化作用研究
2.5.1 DPPH·清除作用
4种南酸枣果胶多糖对DPPH·的清除作用见图4。

图4 4种南酸枣果胶多糖对DPPH·的清除作用Fig.4 DPPH·scavenging effects of four pectic polysaccharides from Choerospondias axillaries fruit
如图4所示,在试验浓度内(78μg/mL~5000μg/mL)4种果胶多糖对DPPH·均有一定的清除能力,且随浓度增大,各样品对DPPH·的清除率也逐渐增加。在最高浓度下,水提法、酸法、碱法、草酸铵法对DPPH·的最大清除率分别为57.7%、41.7%、64.6%、54.6%,而碱法对DPPH·的清除力最强,其次为水提法,酸法对DPPH·的清除能力最弱。抗坏血酸在最低浓度78 μg/mL时,清除率已高达90.6%;经计算碱法和草酸铵法的 IC50分别为 3 077 μg/mL 和 4 326 μg/mL。
2.5.2 ·OH清除作用
4种南酸枣果胶多糖对·OH的清除作用见图5。
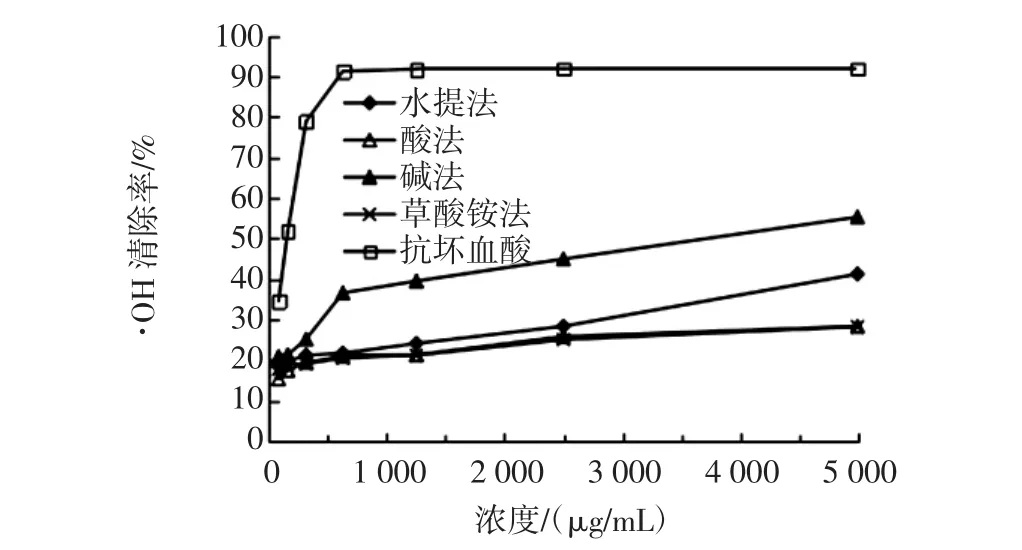
图5 4种南酸枣果胶多糖对·OH的清除作用Fig.5Hydroxyl radical(·OH)scavenging effects of four pectic polysaccharides from Choerospondias axillaries fruit
如图5所示,4种果胶多糖对·OH的清除率,随样品浓度的增加而增加。其中碱法对·OH的清除能力最强,水提法其次,酸法和草酸铵法清除力相似。在最大浓度时,水提法、酸法、碱法、草酸铵法对·OH的清除率分别达到41.3%、28.4%、55.3%、28.3%。可见,碱法制备的果胶多糖具有相对较高的清除率,计算其IC50为 3 694 μg/mL,而抗坏血酸的 IC50值仅为 150 μg/mL。
2.5.3 还原力结果
还原力是评价物质抗氧化性的一个重要指标,吸光度越大,表示还原力越大[26]。4种南酸枣果胶多糖的还原力结果见图6。

图6 4种南酸枣果胶多糖的还原力Fig.6 The reducing power of four pectic polysaccharides from Choerospondias axillaries fruit
如图6所示,4种果胶多糖的还原力均随浓度增大而增大,其中碱提法具有相对较强的还原力,而其他3种方法的还原力在试验范围内无显著性差异。试验浓度范围内,样品的吸光度均远远小于相同浓度抗坏血酸的吸光度,说明南酸枣果胶多糖的还原力较低。
抗氧化试验结果表明,碱法提取的果胶多糖具有较好的抗氧化活性,水提法次之,酸法和草酸铵法较弱。一方面,碱性环境使酯键发生部分水解,羧基重新游离出来;另一方面,碱性条件降低了多糖的分子量,有利于抗氧化作用的发挥[27-28]。
3 结论
本文采用4种不同的溶剂从南酸枣果肉中提取果胶类多糖,并初步分析其化学组成、分子量分布、红外光谱性质及体外抗氧化作用。结果表明,4种果胶多糖的理化性质及抗氧化作用具有显著性差异。分子量分布结果表明南酸枣果胶多糖是由3个不同分子量的组分组成,有待进一步纯化。红外光谱显示,4种样品在400 cm-1~4 000 cm-1范围内都呈现出果胶物质的特征吸收峰,说明属于果胶类多糖。除碱法外,其它3种方法提取的果胶多糖在1 748 cm-1和1 626 cm-1附近均出现明显的糖醛酸特征峰;碱提果胶在1 748 cm-1处的吸收峰消失,可能是由于大部分甲氧基在碱性条件下被水解下来。抗氧化结果表明,4种果胶多糖清除DPPH·和·OH的能力及对Fe3+的还原力都与样品浓度呈正比,其中碱法制备的果胶多糖表现出相对较好的抗氧化作用。通过研究不同提取方法对南酸枣果胶多糖的理化性质和抗氧化作用的影响,可以从理化性质方面为果胶类多糖的构效关系研究提供一定的理论参考。
