普洱茶改善高脂饲料饲喂大鼠的胰岛素抵抗作用
2020-12-18杜恩菊张译丹才让卓玛陈婷婷张鑫璐秦清洲孙康函冯伟王雪青宋文军白小丽李长文
杜恩菊,张译丹,才让卓玛,陈婷婷,张鑫璐,秦清洲,孙康函,冯伟,王雪青,*,宋文军,白小丽,李长文
(1.天津市食品与生物技术重点实验室,天津商业大学生物技术与食品科学学院,天津300134;2.云南天士力帝泊洱生物茶集团有限公司,云南普洱665100)
胰岛素抵抗(insulin resistance,IR)是由多种原因引起的机体中单位胰岛素生物功能下降,只有通过多分泌胰岛素才能实现维持血糖的稳定,而这样会使血液中的胰岛素浓度升高,导致其靶组织,如肝脏、脂肪组织及骨骼肌等对胰岛素的敏感度下降从而产生抗性,当这种代偿性分泌能力达到极限也不足以控制血糖时,就会发展成为II型糖尿病。胰岛素抵抗是II型糖尿病的主要发病机制。现代生活方式导致糖尿病的患病率己呈现逐年上升趋势,其中II型糖尿病占整个糖尿病比例的93.7%以上[1-2],对人类健康的危害仅次于心脑血管病,是现代疾病中的第二大杀手。因此,如何提高机体对胰岛素的敏感性,减轻胰岛素抵抗已成为治疗和预防II型糖尿病及其并发症的重要手段。
目前改善胰岛素抵抗的药物,如曲格列酮、口比格列酮、罗格列酮等噻唑烷二酮类化合物(thiazolidinediketones,TZDs),均具有诱导机体肥胖、产生肝毒等副作用。因此,从天然植物中寻找一种安全有效的能改善胰岛素抵抗的保健食品或饮品具有十分重要的意义。据报道,一些天然植物,如普洱茶,具有减肥降脂、预防动脉硬化、降血糖等多种功效[3],长期以来被用于减肥降脂和辅助治疗糖尿病。然而关于普洱茶改善高脂饲料饲喂大鼠的胰岛素抵抗的作用研究甚少。本试验选用正常大鼠为实验对象,每天饲喂高脂饲料以模拟正常人群的非健康饮食状况,用普洱茶的热水浸提物对大鼠进行灌胃干预,观察普洱茶对大鼠的体重、空腹血糖(fasting blood glucose,FBG)、胰岛素(insulin,INS)及肝糖原水平的影响,及其对正常大鼠肝脏中葡萄糖激酶(glucose kinase,GK)、肝糖原合成酶-2(glycogen synthetase 2,Gys-2)、葡萄糖-6-磷酸酶(glucose-6-phosphatase,G6pc)、胰岛素受体(insulin receptor,INSR)和脂肪组织中葡萄糖转运蛋白-4(glucose transporters-4,GLUT-4)、过氧化物酶体增殖剂激活受体-γ(peroxisome proliferators activated receptorsγ,PPAR-γ)表达水平的影响,以期阐明普洱茶改善大鼠胰岛素抵抗的作用与机制,为进一步开发普洱茶成为预防和治疗与胰岛素抵抗相关疾病的功能性饮品提供理论和试验支持。
1 材料与方法
1.1 材料与试剂
普洱茶热水浸提物:云南天士力帝泊洱生物茶集团有限公司。具体操作按照茶水质量比1∶10,水温度90℃,浸提30 min,二次,减压蒸馏,喷雾干燥成粉,对得到的普洱茶浸提物成粉进行成分分析,其中茶色素约占49.44%(其中茶褐素占47.32%)、蛋白质25.75%和多糖16.74%。
基础饲料配方为(质量百分比):玉米36.9%、麸皮15.5%、小麦15.5%、豆粕15.5%、鱼粉4.5%、维生素0.1%、矿物质添加剂2.5%、花生饼9.5%。高脂饲料配方为:基础饲料59.25%、全脂奶粉2%、猪油20%、蔗糖10%、蛋黄粉8%、酵母粉0.5%,冰冻储存。大鼠基础及高脂饲料:中国人民解放军军事医学科学院实验动物中心,生产许可证编号:SCXK-军2002-018。
染料法实时荧光定量试剂盒、TRIZOL Reagent、M-MLV Fist Strand Kit、核糖核酸酶抑制剂、琼脂糖分子:美国 Life Technologies公司;DNA Ladder 2000、DEPC处理水:上海依科赛生物制品有限公司;Gene Green核酸染料:天根生化科技(北京)有限公司;50×TAE:北京索来宝生物科技有限公司。
1.2 实验动物
成年雄性SD大鼠SPF级,雄性,体质量160g~170 g,共50只:中国人民解放军军事医学科学院实验动物中心,生产许可证编号:SCXK-军2012-0004。
1.3 仪器与设备
UV-2550/2450紫外分光光度计:日本岛津公司;3-18k型高速冷冻离心机:德国SIGMA公司;UV-1紫外透射分析仪:珠海黑马医学仪器有限公司;DYY-4C电泳仪:北京六一仪器厂;chemiDocTmXRS凝胶电泳成像仪、T100Tm热循环仪:美国 BIO-RAD;StepOnePlusTm实时荧光PCR仪:美国Applied Biosystem公司。
1.4 试验方法
1.4.1 动物分组及给药
按照苏静静等的方法,将SD大鼠饲养、分组和给药[4]。
1.4.2 样本收集
试验结束时,各组大鼠禁食24 h,眼球静脉取血。4℃,3 000 r/min离心10 min,取血清,放入-80℃冻藏待测。肝脏和附睾脂肪组织处理和收集方法参见文献[4]。
1.4.3 脂肪系数的测定

式中:m1为睾脂总数,g;m2为大鼠体重,g。
1.4.4 大鼠血清中FBG、肝糖原和INS水平及胰岛素敏感指数(insulin sensitive index,ISI)的测定
FBG的测定:参考文献[5],具体方法按照产品说明书操作。
肝糖原水平的测定:测定原理同蒽酮法,具体方法按照产品说明书操作。
INS水平的测定:参考文献[6]采用生物素双抗体夹心酶联免疫吸附法,具体方法按产品说明书操作。根据所测得的FBG和INS,按照下列公式计算出ISI,判断是胰岛素分泌不足还是胰岛素抵抗。
胰岛素敏感指数=ln[1/(FBG×INS)]
式中:FBG为空腹血糖的浓度,mmol/L;INS为胰岛素浓度,mIU/L。
1.5 肝脏中GK、Gys-2、G6pc及INSR和附睾脂肪中PPAR-γ、GLUT-4表达水平测定
1.5.1 组织总RNA提取
取冻存组织50 mg~100 mg,液氮速冻并研磨成粉;取TRIZOL试剂1.0 mL溶解组织粉末,制成TRIZOL组织悬液,室温(25℃)静置20 min;加氯仿0.2 mL,混匀、室温(25℃)静置 5 min;4℃离心,12 000 r/min,15 min;取上层水相 400 μL,加等体积异丙醇,静置15 min;4 ℃离心,12 000 r/min,10 min;弃上清,沉淀加冰冷75%乙醇(不含RNA酶的无核酸酶水配制,4℃预冷备用)1.0 mL;4℃离心,8 000 r/min,5 min;弃上清,沉淀空气干燥20 min;沉淀加经焦碳酸二乙酯处理的灭菌超纯水40 μL,溶解,制得总RNA溶液。
1.5.2 总RNA逆转录成cDNA
1.5.2.1 RNA完整性的测定
取DEPC水配制的1倍TAE缓冲液(1×TAE)[由三羟甲基氨基甲烷、乙酸和乙二胺四乙酸(ethylenediamine tetraacetic acid,EDTA)组成]制备 1%琼脂糖凝胶,将提取的总RNA溶液取2 μL于1.5 mL EP管中,加298 μL DEPC水(稀释150倍),分别加样,电压100 V,电流50 mA,电泳30 min,紫外透射仪观察总RNA,当清晰的28S和18S RNA条带出现,前者的强度大于后者,验证所提取的总RNA具有完整性。
1.5.2.2 RNA纯度及含量的测定
测定所提取总RNA的OD260/OD280比值在1.8~2.0之间,为满足用于cDNA合成的纯度。RNA的含量为:总RNA浓度/(μg/μL)=OD260值×0.04×稀释倍数。
1.5.2.3 逆转录
无核酸酶的0.2 mL聚合酶链式反应(polymerase chain reaction,PCR)管冰浴并依次加入 1 μL Oligo(dT)20(50 μmol/L),1 μL 总 RNA,1 μL 10 mmol/L 脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP),加DEPC水至12 μL;混合物在65℃加热5 min后,冰冷2 min后,加4 μL 5倍体积的第一链合成缓冲液,2 μL 0.1 mol/L 二硫苏糖醇(dithiothreitol,DTT),1 μL RNaseOUTTm核酸酶抑制剂;在离心管中轻轻将各种成分混合,37℃下孵育 2 min;加入 1 μL(200 U/μL)M-MLV逆转录酶,混匀。37℃孵育50 min,70℃加热15 min以终止反应,-20℃保存备用。
1.5.3 实时荧光PCR检测肝脏中GK、Gys-2、G6pc及INSR和附睾脂肪中PPAR-γ、GLUT-4表达水平
大鼠肝脏中 GK、Gys-2、G6pc、PPAR-γ、GLUT-4、PPAR-γ及β-肌动蛋白基因序列设计引物见表1。
1.5.3.1 引物设计
根据表1,β-肌动蛋白作为内参,所有引物均由美国Applied Biosystem公司设计及合成。取组织RNA原液进行5倍系列的稀释50~5-4,运用StepOnePlusTm实时荧光 PCR 分析仪对 β-肌动蛋白、GK、Gys-2、G6pc、PPAR-γ及GLUT-4基因进行扩增,采用自动分析软件绘制 GK、G6pc、Gys-2、INSR、PPAR-γ、GLUT-4 及β-肌动蛋白标准曲线,相关系数大于0.99且扩增效率在 100%~110%。同时,GK、G6pc、Gys-2、INSR、PPAR-γ、GLUT-4及β-肌动蛋白的溶解曲线出现单特异峰且扩增曲线,无引物二聚体及非特异性扩增产物出现。确定 GK、G6pc、Gys-2、INSR、PPAR-γ、GLUT-4 及 β-肌动蛋白引物合适,能够用于实时荧光PCR的基因表达差异的检测。

表1 β-肌动蛋白、GK、Gys-2、G6pc、INSR、PPAR-γ 和GLUT-4特异性引物Table 1 The specific primers of β-actin,GK,Gys-2,G6pc,INSR,PPAR-γ and GLUT-4
1.5.3.2 实时荧光RCR扩增
1)GK和G6pc:取1.5.3.1逆转录反应产物于20 μL反应体系中进行实时荧光PCR反应。反应体系组成如下:10 μL SYBR Select Master Mix,cDNA 1 μL,上、下游特异性引物各0.6 μL(5 μmol/L,美国Applied Biosystem 公司合成),7.2 μL DEPC。先 95℃预变性2 min,然后95℃15s、60℃1 min循环40次,结束反应。
2)Gys-2和INSR:取1.5.3.1逆转录反应产物于20 μL反应体系中进行实时荧光PCR反应。反应体系组成如下:10 μL SYBR Select Master Mix,cDNA 1 μL,上、下游特异性引物各 0.8 μL(5 μmol/L,美国 Applied Biosystem公司合成),7.4 μL DEPC。先95℃预变性2 min,然后 95 ℃15 s、60℃ 1 min循环 40次,结束反应。
3)PPAR-γ和GLUT-4:取1.5.3.1逆转录反应产物于20 μL反应体系中进行实时荧光PCR反应。反应体系组成如下:10μLSYBR Select Master Mix,cDNA 2 μL,上、下游特异性引物各0.6 μL(5 μmol/L),6.8 μL DEPC。先95℃预变性2 min,然后95℃15 s、60℃1 min循环40次,结束反应。
1.5.3.3 RNA相对含量的计算
用相对定量2-ΔΔCT法分析结果,用各个样本的目的基因的CT值减去各个样本的内参基因(β-actin)的CT值,得到ΔCT值;用ΔCT减去正常对照组的平均ΔCT值,得到ΔΔCT值。用2-ΔΔCT计算各个样本目的基因的表达变化。
1.6 统计方法
所有试验数据利用SPSS16.0统计软件,处理结果用平均值±标准差表示,组间比较采用非参数Mann-Whitney检验,作显著性分析。
2 结果与分析
2.1 普洱茶对大鼠体重和脂肪系数的影响
普洱茶对大鼠体重和脂肪系数的影响见表2。

表2 普洱茶对大鼠体重和脂肪系数的影响Table 2 Effects of Pu’er tea on body weight and fat coefficient in rat
大鼠经12周的处理后,高脂对照组较正常对照组体重和脂肪系数极显著上升(P<0.01),与高脂对照组相比,普洱茶低、中、高剂量组体重和脂肪系数显著下降(P<0.05)。结果表明,在试验剂量范围内,普洱茶具有预防大鼠肥胖的作用且呈剂量依赖关系。
高脂饮食导致的肥胖,尤其是腹型肥胖是胰岛素抵抗发生的主要病因[7]。腹内脂肪以体积增大的脂肪细胞为主,这种脂肪细胞对胰岛素的敏感性大大减低,从而引起胰岛素抵抗。普洱茶可以显著地降低机体脂肪系数和体重[3-4]。本试验结果表明,与正常对照组相比,高脂对照组的体重、脂肪系数显著升高,而处理组大鼠体重和脂肪系数则显著降低,这与Lee等研究结果一致[8]。
2.2 普洱茶对大鼠血清FBG、INS水平和ISI的影响
普洱茶对大鼠血糖、胰岛素水平及胰岛素敏感指数的影响见表3。
结果表明,与正常对照组相比,高脂对照组大鼠血糖水平显著升高(P<0.01)。普洱茶低、中、高剂量组大鼠的血糖水平显著低于高脂对照组(P<0.01)。同时,高脂对照组大鼠血清中胰岛素水平较正常对照组显著升高(P<0.01),与高脂对照组相比,普洱茶低、中、高剂量组分别降低12.57%、33.01%及43.45%,特别是中、高剂量组极显著降低(P<0.01),而普洱茶低、中、高剂量组大鼠胰岛素敏感指数分别升高9.88%、46.59%及24.18%(P<0.05)。这表明高脂对照组大鼠产生了胰岛素抵抗,胰岛素敏感指数降低,从而导致血糖含量升高,提示普洱茶可以改善高脂饲料饲喂大鼠胰岛素抵抗的作用。

表3 普洱茶对大鼠FBG和INS水平及ISI的影响Table 3 Effects of Pu’er tea on FBG,INS and ISI in rats
有研究显示,普洱茶茶色素可降低单纯性肥胖大鼠的空腹胰岛素,调节血脂,提高胰岛素敏感性,改善胰岛素抵抗[9-10]。本文采用的普洱茶的热水浸提物,其主要成分是茶色素(49.44%)。茶色素是发酵茶在其特殊的工艺制备过程中形成的,并赋予普洱茶特殊的风味,影响着产品的质量。这与本试验结果一致。普洱茶能够通过降低大鼠体质量和腹部脂肪质量,有效地改善大鼠的胰岛素抵抗,从而使大鼠血糖维持在较低水平[3]。因此,普洱茶可以改善高脂饲料喂养大鼠胰岛素抵抗,从而预防II型糖尿病和与胰岛素抵抗相关疾病的发生。
2.3 普洱茶对大鼠肝糖原含量的影响
肝脏中的肝糖原相当于储能物质,能够维持血液中血糖浓度平衡。当血糖充足时,肝糖原不分解。血糖升高时,在胰岛素的作用下,促进血糖进入肝脏转变为肝糖原,降低血糖。因此,肝糖原水平的高低反映了机体内血糖的平衡情况和肝脏的健康程度。普洱茶对大鼠血清中肝糖原水平的影响见图1。
与正常对照组相比,高脂对照组肝糖原含量显著降低,经普洱茶干预的低、中、高剂量组分别升高52.63%、62.28%及90.79%(P<0.01)。说明普洱茶可以显著提高大鼠肝糖原的合成能力,从而有效的调节大鼠血糖水平。
2.4 普洱茶对大鼠肝脏中INSR、GK、G6pc、Gys-2和附睾脂肪组织中PPAR-γ、GLUT-4表达水平的影响
2.4.1 普洱茶对大鼠肝脏中INSR表达水平的影响
普洱茶对大鼠肝脏中胰岛素受体表达水平的影响见图2。

图1 普洱茶对大鼠肝糖原水平的影响Fig.1 Effect of Pu’er tea on the level of hepatic glycogenin rats

图2 普洱茶对大鼠肝脏INSR表达水平的影响Fig.2 Effect Pu′er tea on the expression level of INSR in the liver
高脂对照组大鼠肝脏中胰岛素受体表达水平较正常对照组降低了32.12%(P<0.01)。与高脂对照组相比,普洱茶低、中、高剂量组大鼠胰岛素受体表达水平分别升高了 75.97%、86.63%及 123.19%(P<0.05),特别是高剂量组胰岛素受体表达水平极显著降低(P<0.01)。表明普洱茶可以升高大鼠肝脏胰岛素受体的表达水平,提高胰岛素和胰岛素受体的结合能力,降低血糖水平。
胰岛素抵抗发病机制的受体水平基因突变包括胰岛素受体前缺陷、受体水平缺陷和受体后缺陷。其中以受体和受体后水平最为重要[11-13]。本试验结果表明,普洱茶能使INSR表达水平显著升高。通过上调肝脏中INSR表达水平,增强INS作用信号的传递,从而改善胰岛素抵抗状态。王文祥等[9]研究表明,普洱茶可以显著提高胰岛素抵抗大鼠红细胞胰岛素高亲和力受体数目,降低空腹血糖和胰岛素水平。这与本试验结果一致。
2.4.2 普洱茶对大鼠GK和G6pc表达水平的影响
普洱茶对大鼠肝脏中GK和G6pc表达水平的影响见图3。
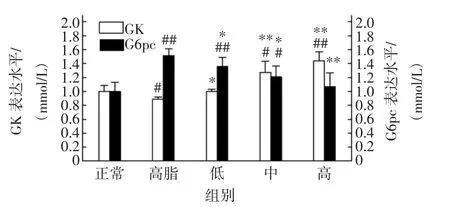
图3 普洱茶对大鼠GK和G6pc表达水平影响Fig.3 Effect of Pu’er tea on the expression level of GK and G6pc in rats
试验结果表明,与正常对照组相比,高脂对照组大鼠肝脏GK表达水平显著降低(P<0.05),经过普洱茶干预后,普洱茶低、中、高剂量组GK水平分别升高11.91%、43.08%和61.56%,尤其中、高剂量组显著升高(P<0.01)。同时,普洱茶各剂量组大鼠肝脏G6pc表达水平显著低于高脂对照组,特别是高剂量组G6pc表达水平降低29.58%(P<0.01)。表明普洱茶可显著升高高脂饲料饲喂大鼠肝脏中GK表达水平,降低G6pc水平,有效地促进葡萄糖转变为6-磷酸葡萄糖,抑制糖异生,从而预防大鼠血糖水平的升高。
肝脏葡萄糖的利用和释出分别依赖6-磷酸葡萄糖的合成与水解,这两步方向相反的反应分别由GK和G6pc催化完成。在高热量饮食引起的胰岛素抵抗模型中,发现模型组肝糖原含量下降,葡萄糖激酶活性下降,葡萄糖-6-磷酸酶活性增加,肝脏葡萄糖输出增多[14-15]。本试验结果表明,普洱茶处理组大鼠肝脏中GK表达水平显著升高,而G6pc表达水平则显著降低。因此,普洱茶可以通过增加肝脏中GK表达水平,降低G6pc表达水平,有效地促进肝糖原的合成,抑制糖异生,从而改善肝脏胰岛素抵抗。
2.4.3 普洱茶对大鼠肝脏中Gys-2表达水平的影响
普洱茶对大鼠肝脏Gys-2表达水平的影响见图4。
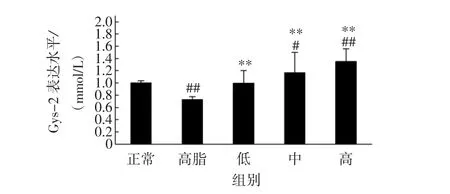
图4 普洱茶对大鼠Gys-2表达水平影响Fig.4 Effect Pu’er tea on the expression level of Gys-2 in rats
高脂对照组较正常对照组大鼠肝脏Gys-2表达水平显著降低(P<0.01),表明高脂对照组大鼠肝糖原合成能力降低。与高脂对照组相比,普洱茶低、中、高剂量组Gys-2表达水平分别升高了36.95%、60.86%及85.93%(P<0.01)。该结果表明,普洱茶可以有效地升高Gys-2表达水平。Gys-2表达水平的提高能促进血糖进入肝脏合成肝糖原,从而降低血糖水平。
2.4.4 普洱茶对大鼠附睾脂肪组织中PPAR-γ和GLUT-4表达水平的影响
普洱茶对大鼠脂肪组织中PPAR-γ和GLUT-4表达水平的影响见图5。

图5 普洱茶对大鼠附睾脂肪组织中PPAR-γ和GLUT-4表达水平的影响Fig.5 Effect Pu’er tea on the expression level of PPAR-γ and GLUT-4 in rats
与正常对照组相比,高脂对照组PPAR-γ表达水平下降15.57%(P<0.05),普洱茶低、中、高剂量组较高脂对照组PPAR-γ水平显著上升(P<0.05)。同时,高脂对照组大鼠脂肪组织GLUT-4表达水平较正常对照组降低24.56%(P<0.05),普洱茶低、中、高剂量组GLUT-4水平较高脂对照组分别升高31.35%、54.07%及96.71%(P<0.01)且呈剂量依赖关系。上述表明,普洱茶能够升高大鼠脂肪组织PPAR-γ和GLUT-4的表达水平,有效改善大鼠胰岛素抵抗,从而预防大鼠糖尿病的发生。
与糖代谢和脂代谢密切相关的PPAR-γ,常作为减肥和降糖的主要靶点之一。当激活PPAR-γ后,能够增加肝细胞的INSR和GLUT-4的表达水平,从而提高胰岛素敏感性[16-18]。本试验结果表明,高脂对照组PPAR-γ表达水平较正常对照组显著降低,而普洱茶处理组大鼠脂肪组织中PPAR-γ表达水平较高脂对照组显著升高。显示出普洱茶能够通过提高PPAR-γ在脂肪细胞中的表达,增强机体胰岛素敏感性。
GLUT-4表达异常是脂肪组织产生IR的主要原因。在脂肪细胞中有选择性地过量表达GLUT-4可以增强和改善整体胰岛素敏感性,而敲除脂肪细胞中的GLUT-4基因则会导致胰岛素抵抗[19-20]。因此,葡萄糖转运的主要转运体GLUT-4在基因表达量发生减少时,可导致对葡萄糖摄取率的减少,进而导致胰岛素抵抗的发生。本试验结果表明,与正常对照组相比,高脂对照组GLUT-4表达水平显著降低,而普洱茶处理组大鼠脂肪组织中GLUT-4表达水平较高脂对照组显著升高。因此,普洱茶通过提高细胞外膜上的GLUT-4表达水平,增强脂肪细胞对葡萄糖的转运和摄取,改善大鼠脂肪组织胰岛素抵抗。另一方面普洱茶通过提高脂肪组织PPAR-γ表达水平,增强了GLUT-4表达水平。关于普洱茶对高脂饲喂动物组织GLUT-4基因表达的影响研究甚少。然而,有研究显示,六堡茶可以通过上调GLUT-4基因的表达,改善3T3-L1脂肪细胞的胰岛素抵抗[20]。
3 结论
普洱茶能降低大鼠体重、脂肪系数、空腹血糖及胰岛素水平,提高高脂饲喂大鼠机体的胰岛素敏感指数,改善胰岛素抵抗。其作用机制为普洱茶能够通过增加 GK、Gys-2、INSR、PPAR-γ 和 GLUT-4 表达水平以及降低G6pc表达水平,改善大鼠的胰岛素抵抗状态,有效地降低血糖水平。因此,普洱茶可作为预防和治疗II型糖尿病和与胰岛素抵抗相关疾病的潜在保健饮料。
