高龄原发性小肠淋巴瘤并发肠穿孔一例报道
2020-12-18徐冉杨年钊张义胜
徐冉,杨年钊,张义胜
(皖南医学院弋矶山医院,安徽 芜湖 241001)
原发性胃肠淋巴瘤(primary gastrointestinal lymphoma, PGIL)属于结外非霍奇金淋巴瘤,占胃肠道恶性肿瘤的1%~8%,其中原发性小肠淋巴瘤(primary small intestinal lymphoma, PSIL)发病率低于胃淋巴瘤[1],近年来有相关文献报道,PSIL的发病率有上升趋势,而预后较差[2]。由于发病率较低,临床症状无特异表现,小肠镜检查未能普及情况下,临床医师对小肠淋巴瘤的诊断经验不足,据文献报道,PSIL穿孔发生率约为9%,而穿孔发生时机往往为初次化疗之后,死亡率高[3]。以肠穿孔表现就诊的PSIL少见,经查阅相关文献,高龄PSIL并发穿孔者,笔者未见报道。我院成功抢救1例高龄PSIL并发穿孔病人,现结合相关文献,报道如下。
临 床 资 料
病人:女性,87岁,2019年7月14日因进食水果后2 h,突发腹痛,呈持续性,伴发热,最高达39.2 ℃,急诊就诊于当地医院。腹部平片:部分肠管积气;腹部B超:腹腔少量积液。血常规:WBC 18.2×109/L,N 0.862, Hb 120 g/L。给予抗感染,补液,解痉等对症处理,治疗1 d后,病人腹痛未见明显缓解,神志逐渐淡漠,急诊转我院。入院后体检:BP 90/60 mmHg、P 130次/min、血氧饱和度(SpO2)92%,神志淡漠,精神萎靡,急性面容,强迫体位,呼吸急促,全腹压痛,反跳痛,肌紧张;急诊腹部CT:腹盆腔积液,腹膜炎,腹膜后多发肿大淋巴结,最大者约3.6 cm×4.2 cm,结肠扩张积气,局部多发液气平,见图1、图2。
追问既往史,病人近2年偶有腹部疼痛,未在意;高血压病史30年,口服硝苯地平;脑梗死遗症病史10年,口服阿司匹林;心功能不全病史10年,口服螺内酯、呋塞米;心律失常-房颤病史10年。入院后行腹腔穿刺,抽出乳黄色浑浊液体。根据相关病史,初步诊断为:感染性休克、弥漫性腹膜炎、消化道穿孔?急诊行剖腹探查术,术中探查见腹腔约200~300 ml乳黄、浑浊积液,混有食物残渣;距屈氏韧带约55 cm空肠处可见一大小约4 cm×4 cm病灶,中间一破口(图3),肠液食物残渣外溢,邻近病灶小肠系膜可见一直径约2 cm肿大淋巴结,肠系膜上血管根部扪及一融合淋巴结群直径约6 cm,包绕肠系膜上血管。探查肝脾、胃十二指肠、结直肠未见明显异常;遂行部分小肠切除术+侧侧吻合术+腹腔冲洗引流术;因肠系膜根部融合淋巴结包绕肠系膜血管,遂未切除该处淋巴结。
术后病理结果:①肉眼所见:肠管一段,长约14 cm,周径约5.5 cm,距一切缘约4.5 cm,距另一切缘约5 cm处,见溃疡型病灶,面积约3.5 cm×3.0 cm,浆膜面见缝合的缺损区,长径约1.5 cm,肠管表面覆脓苔。②镜下所见:(部分小肠)溃疡型弥漫性大B细胞淋巴瘤,瘤组织大小约3.5 cm×3.0 cm;瘤组织侵及肠壁全层;标本两切缘均未见瘤组织;肠周发现淋巴结2枚,均见瘤组织累及(2+/2);免疫组织化学结果:CD20(+),CD79a(+),CD3(-),CD43(-),Bcl-2(+),CD10(-),MUM-1(+),CD30(-),Bcl-6(+),CD5(-),EMA(-),Ki67(80%,+),见图4~图6。
病人术后转ICU过渡,4 d后转普通病房,7 d进流质,15 d出院。术后复查胸腹部增强CT:纵隔未见肿大淋巴结,肝脾未见明显异常。
讨 论
淋巴瘤起源于淋巴结和淋巴组织,其发生多与免疫应答过程中淋巴细胞增殖分化产生的某种免疫细胞恶变有关;根据病理学改变将淋巴瘤分为霍奇金淋巴瘤及非霍奇金淋巴瘤,PGIL占非霍奇金淋巴瘤的10%~20%[4-5];其中PSIL更是少见,其判定依据如下:①外周无浅表淋巴结肿大;②胸部CT未见明显纵隔淋巴结肿大;③外周白细胞计数及分类正常;④术中探查,除肠道受累及区域淋巴结肿大外其他肿大淋巴结未侵及;⑤肝脾未受到侵犯[6]。本例病人诊断为PSIL并发肠穿孔、感染性休克。PSIL的早期临床表现不典型,无特异性,腹痛性质及部位不定,往往因胃肠镜检查后未发现病因忽略小肠疾患。就诊时已合并严重的并发症,如穿孔、腹膜炎、消化道出血、梗阻等。有文献[3]报道PSIL穿孔发生率为9%,其中病理类型以弥漫性大B淋巴瘤为主(59.1%),穿孔常发生于化疗之后。
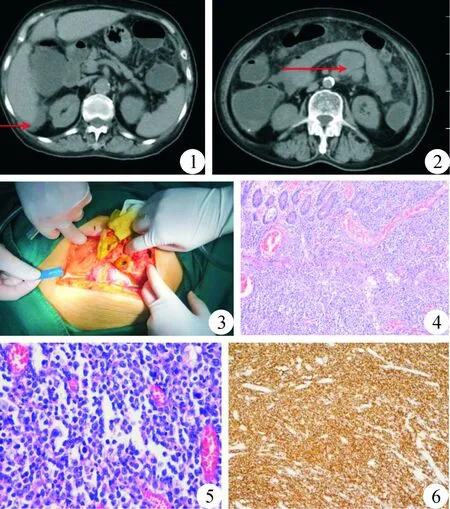
图1 腹部CT 肝周积液(箭头所示) 图2 腹部CT 腹膜后肿大淋巴结(箭头所示) 图3 术中穿孔处 图4 肠黏膜层及肌层淋巴瘤细胞弥漫浸润性分布(HE染色,×100) 图5 淋巴瘤细胞弥漫一致,核大、深染,可见小核仁,核分裂象易见(HE染色,×400) 图6 淋巴瘤细胞弥漫一致强表达CD20(IHC染色,×200)
目前PSIL术前诊断较为困难,其临床表现、专科体检、影像学表现均没有特异性,腹部增强CT可能具有辅助诊断价值,表现为局部肠管增厚,肠梗阻,肠周淋巴结异常肿大等。卢雯雯[7]研究报告,腹部增强CT对PSIL的检出率达96%,笔者认为这是影像经验丰富的大中心数据,和读片专家经验和精密仪器有关。近年来,随着小肠镜及胶囊内镜的逐步运用,小肠病变的诊断有了长足的进步,但PSIL内镜检查下也缺乏特异的表现,可表现为肠壁增厚,不规则隆起,广泛糜烂或溃疡等[8]。虽然术前诊断困难,但是早期识别,诊断该病特别重要,特别是在未穿孔、梗阻出现之前,能够意识到该病,通过完善小肠镜、腹腔镜、超声内镜检查或者在CT引导下穿刺活检,明确诊断,那是优先策略。有研究表明,PSIL合并穿孔,会危及生命,感染增加死亡率,延长住院时间,延迟后续治疗时间,穿孔是PSIL病人预后不良的独立危险因素[2,9]。本例病人在高龄、基础疾病较多情况下,入院时已发生感染性休克,急诊手术剖腹探查是唯一可靠治疗手段,当然手术风险巨大,术中需要贯彻损伤控制理念,术后液体复苏也至关重要。
对于PSIL的治疗,若病灶局限,手术治疗R0切除为最优治疗策略;若病灶弥散、多处的情况下,手术治疗的优势有限,可术中取病理,帮助诊断。对于不能手术的病人,放化疗依然是较好的治疗方法。手术时机:若术前已诊断明确,能R0切除,建议在未穿孔前行手术治疗。文献报道,在病人出现穿孔之前行病灶肠管切除手术,会提高病人生存率[10]。若像本例,以穿孔、腹膜炎、感染性休克就诊病人,需要按照急腹症诊疗策略,急诊剖腹探查。
对于PSIL的预后,国内已有中心对淋巴瘤病人死亡原因进行调查,对1 173例淋巴瘤总体人群直接死亡原因分析,死于淋巴瘤本身疾患者占58.7%;其次为各类感染性疾病,约占10.1%,其中以肺部感染和感染中毒性休克为主[11]。PSIL的预后跟其病理类型、是否合并穿孔及治疗方式选择有关,病理类型为T细胞、合并穿孔的淋巴瘤病人预后差,B细胞淋巴瘤是PSIL病人预后良好的独立因素[7]。
尽管现代影像学飞速发展,PSIL的术前诊断仍然困难,PSIL合并穿孔依然是严重的并发症,死亡率高,但在透彻理解该疾病的前提下,及时手术干预,术后ICU精心管理,可能会帮助病人渡过难关,提高生存率。
