钴胺转运蛋白TCN1在结直肠肿瘤中的研究进展
2020-12-18朱信强侯道荣黄海龙蒋学通邢春根
朱信强,侯道荣,黄海龙,蒋学通,邢春根
(1.苏州大学附属第二医院普外科,江苏 苏州 215004;2.徐州医科大学附属宿迁医院普外科,江苏 宿迁 223800;3.南京医科大学附属动物研究重点实验室,江苏 南京 211166)
结直肠癌(colorectal cancer,CRC)是全球最常见的恶性肿瘤之一[1-2],结直肠上皮细胞中各种遗传和表观遗传变化的积累被认为是驱动CRC发生和发展的重要因素[3-4]。表观遗传变化被称为是基因表达的遗传性改变,它不受DNA序列变化的影响[5]。癌症表观遗传包括DNA甲基化、非编码RNA和组蛋白修饰等方面,其中研究最广泛的表观遗传改变是异常的DNA甲基化[6]。异常甲基化可以通过改变关键基因,尤其是抑癌基因的表达,影响其功能,从而参与CRC发生和发展的各个过程[7]。单碳代谢与异常的DNA甲基化中又存在诸多关联,维生素B12,或称钴胺素,是一种水溶性维生素,它是单碳代谢途径中的一种酶辅因子[8],通过改变单碳代谢中的维生素B12的关键基TCN1(transcobalamin Ⅰ),可进一步深入研究结直肠癌的发生机制。
一、单碳代谢在肿瘤生成中的作用
DNA序列及其甲基化位点组成了细胞中最重要的遗传信息实体,组蛋白的作用在于帮助DNA形成特定结构、稳定DNA,围绕着组蛋白的30多种修饰蛋白在基因表达的调控中也起到重要作用。组蛋白甲基化是表观遗传密码的重要组成部分,在调控基因表达的染色质状态的建立中起着重要的作用。组蛋白甲基转移酶(histone methyltransferases, HMTs)的活性依赖于叶酸和蛋氨酸循环产生S-腺苷蛋氨酸(S-adenosine methionine SAM)。SAM是甲基化反应的普遍甲基供体,包括组蛋白和DNA甲基化反应[9-11]。而SAM的水平会随着细胞营养有效性成份的高低而波动。单碳代谢是一种将环境中的营养状况整合起来,产生多种生物功能的代谢网络,为细胞代谢和组蛋白甲基化之间提供了联系,正常的“单碳单位”代谢对嘌呤等物质的合成是必需的。
近年研究认为,这一代谢过程的紊乱会促使肿瘤的发生,特别是结直肠肿瘤[12]。研究表明[13-14],几个单碳代谢基因(CBS、FTHFD、SHMT1、TCN1和TYMS)的突变可能影响非霍奇金淋巴瘤(NHL)的易感性。“单碳单位”代谢至少涉及25种生物酶发挥作用,除叶酸外,还需要维生素B2、维生素B6、维生素B12等物质以辅酶的形式参与其中。各种营养物质在体内是联合发挥作用,而单个营养素的体内水平及活性有可能受到其他营养物质的调节。维生素B12相关基因TCN1是一种新的基因发现,研究发现[15]该基因与较差的记忆功能有关,是记忆表现的临床相关标志物。胎盘TCN1蛋白含量,与脐带血维生素B12浓度有关,间接反映维生素B12可能在向胎儿转运中发挥作用[16],TCN1对维生素B12相关疾病的诊断和治疗具有重要意义。维生素B12水平的改变,扰乱了单碳代谢途径的稳态,导致DNA合成、蛋白质合成和甲基化的调控异常,这可能导致肿瘤发生,如胃癌、非小细胞肺癌、肝癌、胰腺癌、结直肠癌和乳腺癌等[17-20]。
二、关于钴胺转运蛋白TCN1的基础知识
TCN1是一种分子量为60~70 kD的蛋白,来自于粒细胞系[21-22]。TCN1基因(MIM 189905)位于染色体11 q11-q12☞3[23],有9个外显子的59~191 bp和8 160个基点的内含子3☞2 kb,编码433个氨基酸的蛋白质[24-25]。该基因主要编码维生素B12转运蛋白——钴胺转运蛋白。该蛋白存在于人类血清和各种生物体液中[26],可在血浆中与维生素B12特异性结合,并再与特异性受体结合,完成细胞对维生素B12的利用[8]。R黏合蛋白可以结合人体血浆中80%~94%的维生素B12,然后将这些结合好的维生素B12运送至空肠进行吸收和利用。众所周知,维生素B12在维持神经系统功能、造血和细胞代谢方面发挥着重要作用[17,26-27]。TCN1在通过胃时携带维生素B12,并在十二指肠中酶解释放维生素B12,随后在十二指肠中被内在因子(IF)结合。
三、TCN1基因研究现状
TCN1基因功能研究不多,为了探究TCN1在所有肿瘤类型中的表达,从Oncomine 数据库中共收集了433个不同类型的研究结果。结果表明TCN1在各种肿瘤中高表达,其中包含结直肠肿瘤。在Oncomine数据库中我们还发现,自2007年开始,共有8个研究涉及TCN1在结直肠癌组织和正常组织中的表达,共包括406个样本。文章分别发表于Cancer Research、PLoS One等。荟萃8个研究结果发现,与对照组相比,TCN1在结直肠癌中高表达(P<0.000 1)。基于GWAS对于维生素B12相关代谢基因的研究结果也表明,TCN1基因与胃肠癌的发生发展关系密切[28],该基因对胃肠肿瘤发生发展的具体作用机制仍不清楚。
四、TCN1在肿瘤组织中的表达情况
细胞质和肿瘤组织中TCN1的上调均有报道,TCN1在一些恶性肿瘤中过表达,如肝细胞癌(HCC)和乳腺癌、肺癌和胃癌[17-18]。既往研究表明,肝癌或继发性肝转移病人血清TCN1水平和表达水平升高可能是由于肝内TCN1清除率降低所致[21,29]。另一方面,在其他实体恶性肿瘤中,TCN1的过表达被推测主要是肿瘤细胞自身合成了过多的TCN1,或粒细胞增多有关[18,21,30]。在一项基于6项研究的荟萃分析中,维生素B12的循环浓度与前列腺癌风险增加有关,而TCN1基因表达与前列腺癌风险呈负相关[OR=0.76;95%CI(0.55,1.05);P=0.10][31]。最近,一项基于生物信息学的研究表明,TCN1是正常组织和CRC组织分类的重要致癌基因[32]。然而,对其在结直肠癌中的表达以及该基因与临床相关性了解甚少。
五、TCN1促进多种肿瘤进展的现状
癌细胞等快速分裂的细胞需要某些维生素,包括维生素B12、叶酸、生物素和核黄素,以促进肿瘤生长和存活,对肿瘤细胞的转移起着至关重要的作用,这一点越来越清楚。通过对下咽鳞状细胞癌的新辅助化疗研究,发现在蛋白水平(P=0.013)和mRNA水平(P<0.001)上,新辅助化疗敏感病人的TCN1表达显著低于非敏感病人,说明低TCN1表达预示着更好的新辅助化疗反应[19]。此外,据报道[33-35],癌症病人血清维生素B12和TCN1水平升高,与恶性血液病(如慢性髓系白血病和急性白血病)之间的关系已被很好地阐明,其发病机制涉及通过增殖粒细胞[21,29,36]释放TCN1,TCN1是Wnt/-连环蛋白通路的调控因子,可增强-连环蛋白靶基因的表达,导致癌症进展和预后恶化。在胃癌研究中,TCN1与胃癌分期、细胞分化、淋巴结转移、预后显著相关[37]。TCN1还与层黏连蛋白gamma2、金属蛋白酶7、金属蛋白酶14、cyclin D1、c-Met、CD44等靶基因的表达有关。TCN1增强基质凝胶的侵袭性和增殖能力,促进其在癌症侵袭性生物学行为中的作用。 此外,TCN1而不是维生素B12被发现与胃癌的进展有更好的相关性[38]。TCN1是新的基因,但以前没有报道与结直肠癌相关,进一步的研究将有助于我们更好地了解其在结直肠癌中的作用。Chu等[32]最近通过微阵列Meta分析发现TCN1是一种与晚期CRC相关的显著表达基因,研究结果提供了进一步的证据,表明TCN1在肿瘤细胞中的表达状态比以前的研究更明显,提示TCN1是CRC疾病进展的标志物。在接受新辅助同步放化疗(concurrent chemoradiotherapy,CCRT) 的直肠癌病人中,TCN1过表达与治疗反应差、不良结局相关,证实了TCN1在接受CCRT治疗的直肠癌中具有潜在的预后价值[26]。TCN1对各种胃肠道肿瘤生存的影响,也各不相同(图1~图4)[39],说明TCN1在不同实体肿瘤中的作用机制可能不完全相同。
六、结直肠肿瘤发生的机制研究
单碳营养物质(甲基供体)的膳食摄入和单碳代谢基因的种系变异,可能影响启动子CpG岛的全部DNA甲基化水平和甲基化。通过评估单碳代谢通路中的单核苷酸多态性(SNPs)与结直肠癌DNA甲基化状态之间的关系[40],确定种系遗传变异和体细胞启动子CpG岛甲基化在结直肠癌中的可能联系。我们知道遗传和表观遗传改变在肿瘤发生中起重要作用[41-42],饮食因素、遗传和表观遗传改变的共同影响,可导致结直肠癌的风险因素增加[43-44]。全基因组DNA甲基化,涉及重复的DNA元件,如LINE-1 (long interspersed nucleotide element-1),通过激活转座DNA序列,在基因组不稳定性中发挥重要作用[45-46],导致结直肠癌的发生[47-51]。相反,异常启动子CpG岛甲基化也可能通过沉默抑癌基因[41]促进结直肠癌的发生。有研究显示TCN2 776G等位基因[40]与结直肠癌中较高的基因启动子CpG岛甲基化有关,与结直肠癌的风险[52]增加有关,但与结直肠癌无关[53]。考虑到单碳代谢基因的重要生物学功能,研究结果表明,TCN2多态性可能是CRC的易感性因素[54]。然而,TCN1与癌症风险的关系很少被研究。需要更多的研究数据才能将钴胺转运蛋白与癌症发生联系起来。最近的一篇文献[55]报道从DNA甲基化谱和RNA测序微阵列数据中筛选出14个异常表达并受DNA甲基化调控的差异表达基因。在TCGA数据库中进一步验证了这些基因,并筛选了3个候选基因(SOX9、TCN1和TGFBI),并证实了这些基因表达与DNA甲基化之间的相关性。ROC(receiver operating characteristic)结果表明,TCN1和TGFBI可作为CRC早期诊断的有效生物标志物。TCN1在结直肠肿瘤组织中是否和胃癌一样有同样的调控通路,以及对结直肠肿瘤的发生发展有何具体意义鲜有报道。
七、结论
总之,关于TCN1在结直肠肿瘤中的作用和分子机制尚不清楚,根据国内外研究现状和结果,TCN1在结直肠肿瘤中高表达,提示TCN1的表达抑制应该会对肿瘤的生长增殖起到抑制作用。进一步研究TCN1在结直肠肿瘤中作用的分子机制有助于为结直肠肿瘤的临床治疗提供新的药物靶点和实验依据。
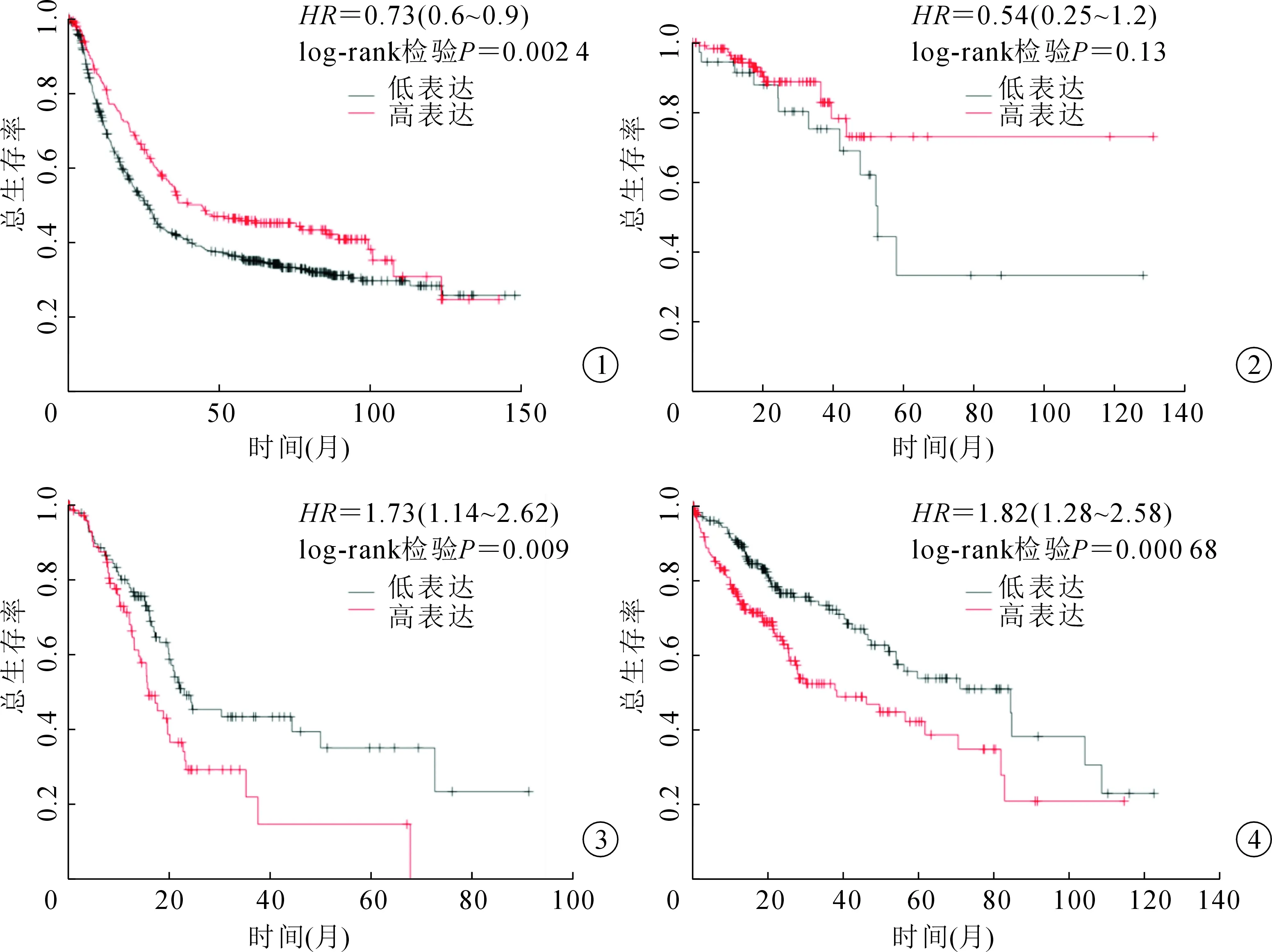
图1 TCN1水平对胃癌总生存的影响 图2 TCN1水平对直肠癌总生存的影响 图3 TCN1水平对胰腺癌总生存的影响 图4 TCN1水平对肝癌总生存的影响
