欧亚旋覆花总黄酮对衰老人皮肤成纤维细胞lncRNA TERRA的影响及其机制
2020-12-17周茂强况杰胡翰林果磊
周茂强,况杰,胡翰林,果磊
重庆医科大学附属第一医院整形烧伤外科,重庆 400016
衰老是在遗传和环境的共同影响下发生的全方位、多因素、系统的不可逆转的过程,常伴随机体应激能力衰退和结构退行性变[1]。目前发现,长链非编码RNA(long noncoding RNA,lncRNA)是长度大于200个核苷酸的非编码RNA[2],主要调控转录、转录后和翻译后等水平的基因表达模式,在衰老及相关疾病的发生与发展过程中发挥重要作用[3]。 某些特定的lncRNAs可通过激活MAPK通路抑制细胞凋亡,从而延缓衰老进程[4]。端粒是真核细胞染色体末端特殊的异染色质核蛋白复合物[5],可随着细胞的分裂而缩短,对维持染色体完整性和细胞稳定性至关重要,其缩短可导致细胞衰老[6]。非编码端粒重复RNA(telomeric repeat containing RNA,TERせ)是由RNA PolⅡ将端粒从亚端粒区域转录而成,可以一种长度依赖的方式调节单个染色体末端的端粒酶活性,甚至可能参与短端粒的DNA损伤反应,具有引发早期衰老和端粒重组的独特功能[7]。目前,从天然植物和传统草药中研究开发新型的抗衰老产品成为全球热点[8]。有研究认为,中药的抗衰老效应与其促进端粒稳定有关,主要机制包括抗氧化[9]、 激活端粒酶活性[10]、抑制相关基因(如p16)的功能[11]等。欧亚旋覆花总黄酮(Inula britannica flower total flavonoids,IBFTF)是从欧亚旋覆花中提取的天然抗衰老药物,具有抗炎、抗氧化等功效[12-13], 但其抗衰老的具体机制尚不清楚,是否与调控端粒稳定有关尚需进一步研究。本研究拟在D-半乳糖(D-galactose,D-gal)诱导建立的衰老人皮肤成纤维细胞模型中,探讨IBFTF对lncRNA TERRA表达的影响及其机制。
1 材料与方法
1.1 主要试剂及仪器 D-gal(美国Sigma公司);DMEM高糖培养基(美国康宁CellGro公司);FBS Premium优等胎牛血清(德国PAN公司);RNAiso Plus试剂盒、反转录及荧光实时定量PCR反应试剂盒(日本TaKaRa公司);PCR引物构建于日本TaKaRa公司;兔抗端粒酶反转录酶(TERT)抗体(北京博奥森生物技术有限公司);兔抗p53抗体(7F5;美国Cell Signaling Technology公司);兔抗p16-INK4A抗体、兔抗β-actin抗体(武汉三鹰生物技术有限公司);总超氧化物歧化酶(T-SOD)测试盒、丙二醛(malonaldehyde,MDA)测定试剂盒(TBA法;沈阳万类生物科技有限公司);谷胱甘肽过氧化物酶(GSH-Px)检测试剂盒、β-半乳糖苷酶(SA-β-Gal)细胞化学染色试剂盒、BCA蛋白浓度测试盒(增强型;江苏碧云天生物公司);Cell Counting Kit-8细胞增殖及细胞毒性检测试剂盒(CCK-8试剂盒;武汉博士德生物工程有限公司);甲醇、乙腈(HPLC级;美国Honeywell公司);槲皮素、异鼠李素、山奈酚、芦丁(纯度≥98%;上海源叶生物科技有限公司)。PCR扩增仪、荧光定量PCR仪(美国Bio-Rad公司);RIGOL L3000高效液相色谱仪(北京普源精仪科技有限责任公司);Kromasil C18色谱柱(4.6 mm×250 mm,5 μm;瑞典NOBEL公司)。
1.2 IBFTF制备 欧亚旋覆花购自重庆市中医药材专业市场(产地为中国江苏),由重庆医科大学中医药学院曹纬国教授认证。欧亚旋覆花加水煮沸1 h,纱布过滤,减压浓缩制成浓缩液(浓度20 g/L),AB-8大孔树脂柱富集吸附,70%乙醇洗涤,上样流速0.12 L/h。采用分光光度法,以芦丁作为参照标准,测得提取物中总黄酮含量为82.6%。
1.3 HPLC分析IBFTF的成分及含量
1.3.1 对照品、供试品溶液制备 称取槲皮素、异鼠李素、山奈酚、芦丁对照品各10 mg,分别用甲醇溶解、10 ml容量瓶定容,用0.45 μm微孔滤膜过滤,即得到对照品溶液。
称取0.01 g IBFTF样品粉末,研磨,加入甲醇与25%盐酸水溶液(V:V=4:1)的混合液1.5 ml研磨匀浆,80 ℃水浴水解1.5 h,超声提取30 min,10 000×g离心10 min,取上清,用针头式过滤器过滤,即得到供试品溶液。
1.3.2 标准曲线及线性关系分析 取对照品溶液6份,用70%甲醇稀释成浓度1、5、10、50、100、200 mg/L,各取1 ml进样测定,记录峰面积,分析对照品浓度(x)与峰面积(y)的线性关系。色谱条件如表1所示。
1.3.3 精密度试验 取供试品溶液1份,连续进样6次,测定槲皮素、异鼠李素、山奈酚、芦丁峰面积的相对标准偏差(RSD)。色谱条件如表1所示。
1.3.4 稳定性试验 按照1.3.1方法制备供试品溶液,分别于0、1、2、4、8、12及24 h进样测定,记录峰面积,计算槲皮素、异鼠李素、山奈酚、芦丁峰面积的RSD,评估供试品溶液在24 h内的稳定性。色谱条件如表1所示。
1.3.5 重复性试验 取同一批IBFTF样品粉末6份,按照1.3.1方法制备供试品溶液,进样测定,计算槲皮素、异鼠李素、山奈酚、芦丁含量的RSD,评估提取方法的重复性。色谱条件如表1所示。
1.3.6 加样回收率测定 精密称取已知各成分含量的同一批IBFTF样品粉末6份,每份0.1 g,添加对照品溶液1 ml,按照1.3.1方法制备供试品溶液,进样测定,计算槲皮素、异鼠李素、山奈酚、芦丁的平均回收率及RSD。色谱条件如表1所示。
1.3.7 样品含量测定 测定3批不同时间提取的样品中槲皮素、异鼠李素、山奈酚、芦丁的含量,按照1.3.1方法制备供试品溶液,进样测定,记录峰面积,计算各成分含量。色谱条件如表1所示。
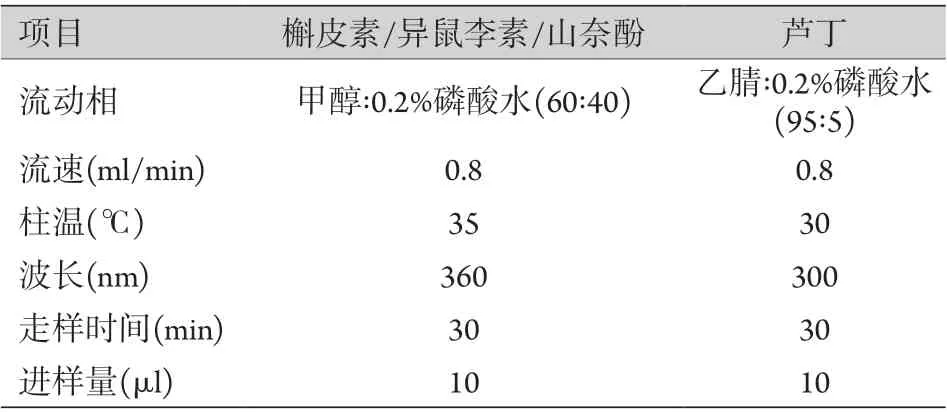
表1 HPLC色谱条件Tab.1 The chromatographic conditions of HPLC
1.4 细胞培养及衰老细胞模型建立 人皮肤成纤维细胞购自上海中乔新舟生物科技有限公司。人皮肤成纤维细胞在37 ℃、5% CO2条件下用含10%胎牛血清的DMEM高糖培养基培养,2~3 d换液1次,待细胞融合度达70%~80%时传代。传代细胞融合度达50%时,使用10 g/L D-gal诱导72 h,制备衰老细胞模型[14]。
1.5 CCK-8法检测细胞存活率 取对数生长期细胞200 μl,接种于96孔板中,细胞密度为1000个/孔,使用10 g/L D-gal诱导72 h,制备衰老细胞模型。使用不同浓度的IBFTF(10、20、30、40、50 mg/L)作用细胞24 h;对照孔不加IBFTF,空白孔加入200 μl培养基,均设5个复孔。换液,每孔加入200 μl培养基+20 μl CCK-8溶液,37 ℃孵育1 h。使用酶标仪测定450 nm处各孔吸光度(OD)值,计算细胞存活率,确定IBFTF的最佳作用浓度。
同上述方法,用96孔板接种细胞并制备衰老细胞模型,使用最佳浓度的IBFTF作用细胞12、24、36、48 h,如上法加入CCK-8溶液,使用酶标仪测定450 nm处各孔OD值,计算细胞存活率,确定IBFTF的最佳作用时间。
1.6 细胞分组与衰老特异性SA-β-Gal染色
1.6.1 细胞分组 将细胞分为对照组、IBFTF组、衰老模型组、衰老模型+IBFTF组。IBFTF组细胞融合度达70%~80%时,加入IBFTF处理;衰老模型组细胞融合度达50%时,加入D-gal 10 g/L诱导72 h;衰老模型+IBFTF组细胞融合度达50%时,使用10 g/L D-gal诱导72 h,然后加入IBFTF处理。对照组细胞无D-gal诱导,无IBFTF处理。IBFTF处理均选用最佳作用浓度及最佳作用时间。
1.6.2 SA-β-Gal染色 取融合度为80%的细胞,以2×104个/孔的密度接种到6孔板中,每组1个孔,并按上述细胞分组方法处理,行SA-β-Gal染色,具体操作参照SA-β-Gal细胞化学染色试剂盒说明书,37 ℃、无CO2培养箱中孵育过夜,普通光学显微镜下观察细胞染色情况,各孔随机选取5个视野,计数蓝染细胞,计算阳性细胞比例,取平均值。实验重复3次。
1.7 SOD、GSH-Px活性以及MDA含量测定 人皮肤成纤维细胞于细胞培养瓶中培养,分组及处理方法如上述,胰酶消化后,1000×g离心5 min,收集各组细胞,冰浴下超声破碎为细胞裂解液,按照试剂盒说明书步骤,使用酶标仪测定550 nm、340 nm、532 nm处各组的OD值,计算SOD、GSHPx活性以及MDA含量。
1.8 实时定量反转录-聚合酶链反应(qRT-PCR)检测lncRNA TERRA、Telomere、hTERT mRNA的表达 各组细胞接种于6孔板中,接种及处理方法同1.5,使用Trizol提取总RNA,根据TaKaRa反转录说明书步骤合成相应cDNA并扩增,以β-actin为内参,分析lncRNA TERRA、hTERT mRNA的表达情况,以及端粒的长度。反应总体系10 μl(TB Green 5 μl、DEPC水3.2 μl、正反引物各0.4 μl、cDNA 1 μl),每个样本3个复孔。扩增条件:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火30 s,共40个循环。采用2-ΔΔCt法计算lncRNA TERRA、Telomere、hTERT mRNA的相对表达量。引物序列如表2所示。

表2 细胞周期相关基因PCR引物序列Tab.2 The primers sequence of cell cycle-related genes
1.9 Western blotting检测hTERT、p53、p16蛋白的表达 各组细胞使用RIPA裂解液提取总蛋白,用BCA法测定裂解上清的蛋白浓度,然后电泳、转膜、封闭,4 ℃摇床过夜,加入一抗β-actin(1:3000)、p53(1:1000)、p16(1:500)、TERT(1:500),TBST洗膜,加入二抗(1:8000)室温孵育1 h,TBST洗膜,显影,使用ImageJ软件分析条带的灰度值。
1.10 统计学处理 采用SPSS 22.0软件进行统计分析,采用GraphPad 7.0软件进行统计学作图。每个实验重复3次。计量资料以±s表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD法。P<0.05为差异有统计学意义。
2 结 果
2.1 IBFTF成分及含量分析 标准曲线及线性关系分析结果显示,芦丁、槲皮素、山奈酚、异鼠李素4种成分的对照品浓度(x)与峰面积(y)的线性关系良好(R2均>0.95,表3)。
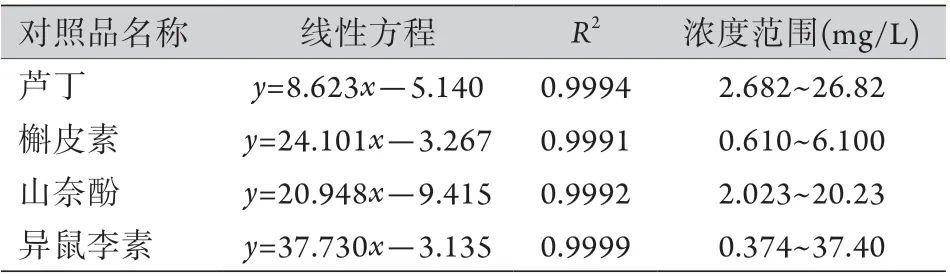
表3 IBFTF对照品的线性方程及其浓度范围Tab.3 Linear equations of IBFTF reference substances and their concentration range
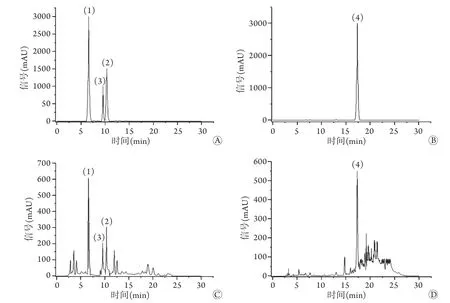
图1 IBFTF对照品和供试品的HPLC色谱图Fig.1 HPLC chromatogram of IBFTF reference and test samples
精密度试验结果显示,槲皮素、异鼠李素、山奈酚、芦丁峰面积的RSD分别为0.75%、0.12%、0.34%、0.52%,表明仪器精密度良好。稳定性试验结果显示,槲皮素、异鼠李素、山奈酚、芦丁峰面积的RSD分别为0.80%、1.12%、1.03%、0.97%,表明供试品溶液在24h内较稳定。重复性试验结果显示,槲皮素、异鼠李素、山奈酚、芦丁含量的RSD分别为1.47%、0.77%、1.32%、1.20%,表明提取方法重复性良好。加样回收率测定结果显示,槲皮素、异鼠李素、山奈酚、芦丁的回收率分别为98.56%、98.32%、97.87%、97.23%,RSD分别为0.74%、1.15%、1.28%、0.97%,表明加样回收率较高。样品含量测定结果显示,3批不同时间提取的样品中槲皮素、异鼠李素、山奈酚、芦丁的含量为6.447、2.044、1.272、0.781 mg/g(表4),对照品和供试品的HPLC色谱图如图1所示。
2.2 IBFTF的最佳作用浓度及最佳作用时间 CCK-8法检测结果显示,不同浓度的IBFTF作用于细胞后,与对照组相比,实验组(10、20、30、40、50 mg/L)细胞存活率均升高,当IBFTF浓度为30 mg/L时,细胞存活率最高,差异有统计学意义(F=330.021,P=0.000)。以30 mg/L IBFTF作用细胞,与对照组相比,实验组(12、24、36、48 h)细胞存活率均升高,并于24 h达到峰值,差异有统计学意义(F=76.722,P=0.000,图2)。后续实验采用IBFTF最佳作用浓度30 mg/L、最佳作用时间24 h处理细胞。
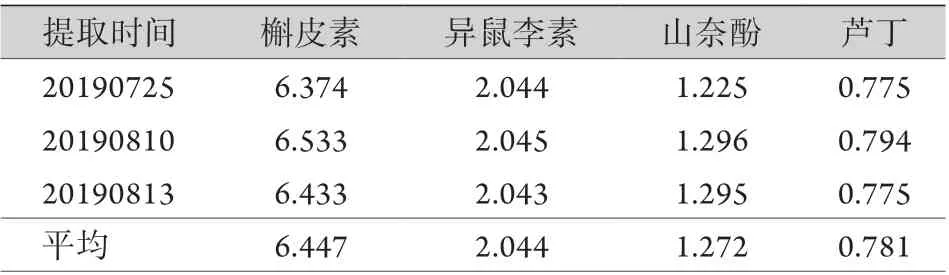
表4 3批不同时间提取的IBFTF成分含量测定结果(mg/g)Tab.4 Contents of IBFTF in 4 materials extracted in 3 batches (mg/g)
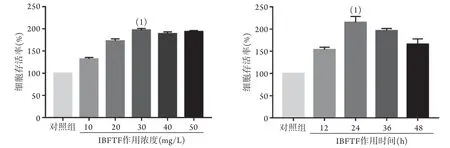
图2 IBFTF对衰老人皮肤纤维细胞存活率的影响(CCK-8法)Fig.2 Effect of IBFTF on the survival rate of fibrocytes in the senescent skin (by CCK-8)
2.3 IBFTF对各组细胞衰老特异性SA-β-Gal活性的影响 SA-β-Gal染色结果显示,与对照组比较,衰老模型组SA-β-Gal阳性细胞比例明显升高(P=0.000);IBFTF组与对照组SA-β-Gal阳性细胞比例差异无统计学意义(P=0.676)。与衰老模型组比较,衰老模型+IBFTF组SA-β-Gal阳性细胞比例明显降低(P=0.000,图3)。
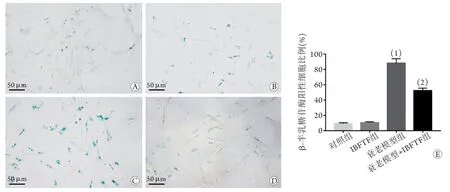
图3 IBFTF对各组细胞衰老特异性SA-β-Gal活性的影响Fig.3 Effect of IBFTF on the senescence-associated β-galactosidase in each group
2.4 IBFTF对各组细胞SOD、GSH-Px活性以及MDA含量的影响 酶标仪检测结果显示,与对照组比较,衰老模型组SOD、GSH-Px活性明显降低(P=0.000,P=0.002),MDA含量明显升高(P=0.000),表明D-gal诱导成功建立了衰老模型,降低了细胞的抗氧化防御能力。与衰老模型组比较,衰老模型+IBFTF组SOD、GSH-Px活性明显升高(P=0.000,P=0.001),MDA含量明显降低(P=0.000)。IBFTF组与对照组SOD、GSH-Px活性以及MDA含量差异无统计学意义(P=0.052,P=0.066,P=0.142,图4)。
2.5 IBFTF对各组细胞lncRNA TERRA、Telomere、hTERT mRNA表达的影响 qRT-PCR检测结果显示,与对照组比较,衰老模型组lncRNA TERRA的表达水平明显升高(P=0.000),Telomere、hTERT mRNA的表达水平明显降低(P=0.000,P=0.000);IBFTF组与对照组lncRNA TERRA、Telomere、hTERT mRNA的表达差异无统计学意义(P=0.766,P=0.205,P=0.055)。与衰老模型组比较,衰老模型+IBFTF组lncRNA TERRA的表达水平明显降低(P=0.000),Telomere、hTERT mRNA的表达水平明显升高(P=0.000,P=0.001,图5)。
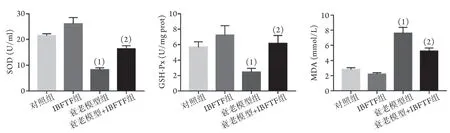
图4 IBFTF对各组细胞SOD、GSH-Px活性以及MDA含量的影响Fig.4 Effect of IBFTF on the activities of SOD, GSH-Px and MDA content
2.6 IBFTF对各组细胞hTERT、p53、p16蛋白表达的影响 Western blotting检测结果显示,与对照组比较,衰老模型组hTERT蛋白的表达水平明显降低(P<0.05),p53、p16蛋白的表达水平明显升高(P<0.05);与衰老模型组比较,衰老模型+IBFTF组hTERT蛋白的表达水平明显升高(P<0.01),p53、p16蛋白的表达水平明显降低(P<0.01,图6)。
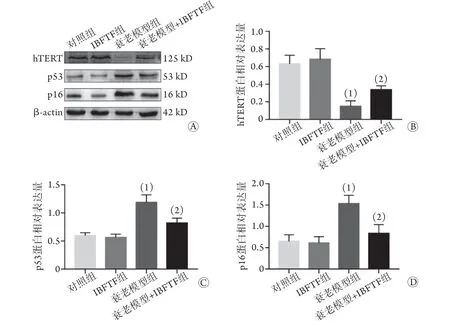
图6 IBFTF对各组细胞hTERT、p53、p16蛋白表达的影响(Western blotting)Fig.6 Effect of IBFTF on the expressions of hTERT, p53 and p16 protein in each group (Western blotting)
3 讨 论
在机体衰老生物学特性研究中,通常采用诱导成纤维细胞衰老的方法来构建衰老细胞模型[15]。IBFTF作为天然抗衰老药物,具有极强的抗氧化、抗衰老功效[12]。本研究依据文献[16-17]选择4种功效成分即槲皮素、异鼠李素、山奈酚、芦丁,建立了HPLC分析方法,该方法经过方法学考察,重复性与稳定性良好,回收率高,可作为IBFTF的成分定量方法。本研究以不同浓度的IBFTF作用于D-gal诱导的衰老成纤维细胞,发现IBFTF可明显提高衰老细胞的存活率,通过CCK-8法检测明确了IBFTF的最佳作用浓度和最佳作用时间为30 mg/L和24 h。
细胞衰老是一种不可逆转的阻滞增殖状态,衰老细胞在体外和体内都表现出特征性的表型和分子特征,衰老特异性的SA-β-Gal和氧化应激生化指标目前常用于衰老特征检测[18-19]。本研究使用D-gal诱导人皮肤成纤维细胞建立衰老模型,发现其SAβ-Gal阳性细胞比例较对照组明显升高,用IBFTF处理后,SA-β-Gal阳性细胞比例较衰老模型组下降,表明IBFTF可降低成纤维细胞SA-β-Gal的活性。衰老细胞内可产生聚集大量活性氧(ROS),导致氧化应激而引起细胞损伤,而MDA、SOD和GSH-Px为常用的氧化应激生化指标[19]。MDA是体内脂质过氧化作用的产物,可反映过量ROS引起的细胞损伤程度;SOD可抑制MDA及自由基代谢产物的产生,清除细胞内超氧阴离子自由基,减缓机体的衰老;GSH-Px是体内重要的抗氧化剂和自由基清除剂[20]。本研究中IBFTF可恢复衰老模型组细胞中SOD、GSH-Px的活性,显著降低MDA含量。
p53和p16是目前最常用的衰老标志物[21]。p53通过诱导细胞周期抑制因子p21的表达,导致细胞生长停滞[22]。Liu等[23]发现,p16在衰老细胞中表达增加,而在正常或永生化的人类细胞中过表达会导致衰老。本研究中,在D-gal的诱导下,p53和p16蛋白的表达较对照组明显上调,加用IBFTF后,p53和p16的蛋白表达较衰老模型组明显下调,表明D-gal成功诱导建立了人成纤维细胞衰老模型,而IBFTF可通过降低SA-β-Gal活性、减弱细胞氧化应激来达到延缓衰老的目的。
LncRNA TERRA是一种长链非编码RNA,近年来研究发现,TERRA异常表达可抑制成纤维细胞端粒延长而出现衰老[24]。Feuerhahn等[25]发现,TERRA水平升高可导致衰老相关疾病的发生,而抑制TERRA的表达可通过延长成纤维细胞端粒长度,进而抑制细胞衰老。本研究通过qRT-PCR验证了在D-gal诱导的衰老细胞模型中TERRA呈高表达,而IBFTF可使TERRA的表达水平降低。由此推测TERRA表达水平的升高与端粒及端粒酶功能障碍 有关。
目前研究发现,端粒及端粒酶在衰老机制中起着关键作用[26]。端粒酶作为一种核糖核酸反转录酶,可将端粒DNA合成为染色体末端。端粒酶的核心成分为其催化亚基——人端粒酶反转录酶(hTERT),而hTERT mRNA的表达对端粒酶的活性和端粒长度稳态起决定性作用[27-28]。端粒酶重新激活被认为是延缓细胞衰老的主要机制,端粒长度的动态平衡是由端粒长度依赖于染色体末端端粒酶的调节而实现的[29]。LncRNA TERRA可抑制端粒延长,因其与TERRA转录本中存在大量的端粒UUAGGG重复拷贝有关,重复跨度约为200 nt[30],致使TERRA成为端粒酶的高亲和力配体,从而成为竞争性抑制剂,对RNA模板和hTERT多肽起到抑制作用[31]。本研究发现,在细胞发生衰老时,端粒长度缩短,hTERT mRNA及蛋白表达水平降低,而IBFTF可下调TERRA的表达,使细胞通过恢复端粒酶的活性而补充端粒序列,从而达到延长端粒、延缓衰老的目的。
笔者认为,同既往其他抗衰老药物的研究结果类似,抗衰老药物或干预措施(如IBFTF)对衰老细胞的衰老有抑制作用,而对正常细胞作用不明显。分析原因如下:①本研究qRT-PCR检测结果显示,lncRNA TERRA、端粒及端粒酶在衰老细胞与正常细胞中存在显著的差异性表达,由此推测,lncRNA TERRA及端粒是细胞衰老的重要调节机制;②加入IBFTF后,衰老细胞的SA-β-Gal、SOD、GSH-Px活性,MDA含量,以及p53、p16蛋白表达发生明显变化,而正常细胞无明显变化;同时加入IBFTF后,衰老细胞的lncRNA TERRA、端粒及端粒酶也有明显变化,而正常细胞无明显变化,因此lncRNA TERRA、端粒及端粒酶可能是IBFTF抑制人皮肤成纤维细胞衰老的重要机制,且这种抗衰老作用对衰老细胞的影响更明显;③上述结果及结论与既往相关研究结果类似,如Min等[9]的研究发现,中药黄芩苷对衰老的皮肤成纤维细胞具有明显的抗衰老作用,但对正常皮肤细胞的作用不明显。
综上所述,本研究结果表明,IBFTF可降低D-gal诱导的衰老人成纤维细胞lncRNA TERRA的表达,发挥抗衰老作用,其机制可能与恢复端粒酶活性、延长端粒长度有关,该结果为IBFTF的临床推广应用提供了理论依据。
