两例GCK基因突变家系的分子遗传学分析及临床思考
2020-12-17王志新左庆瑶
王志新,左庆瑶,李 伟,陈 佳,邓 微
(北京积水潭医院 北京大学第四临床医学院 内分泌科, 北京 100035)
在中国,糖尿病是常见病、多发病,其中最常见的是2型糖尿病和1型糖尿病。随着分子遗传学和检测技术的发展,有越来越多的特殊类型糖尿病被发现和诊断,其中包括青少年的成人发病型糖尿病(maturity-onset diabetes of the young,MODY)。有14个基因的基因突变可导致MODY,最常见的是GCK基因突变导致的MODY2和HNF1A基因突变导致的MODY3。前期的临床研究已经发现,MODY2在中国的患病率约50/10万[1],虽然该患病率并不高,但考虑到中国庞大的人口基数,MODY2患者的总体数量是不容忽视的。又由于该病是常染色体显性遗传性疾病,其明确诊断对患者的治疗、预后判断和遗传咨询均有重要意义,因此临床应予以重视。本研究报告两例GCK基因突变导致的MODY2家系及其GCK基因检测结果,并分析其临床特征,探讨如何加强对该疾病的诊治。
1 资料与方法
1.1 病例来源
病例为2015年4月至2015年12月于北京积水潭医院内分泌科疑诊为特殊类型糖尿病的两例患者及其家系成员。所有受试者均签署知情同意书,对于年龄小于18周岁的研究对象,获得其监护人的知情同意并签署知情同意书。该研究经北京积水潭医院伦理委员会批准(伦理审批编号:201805-17)。
1.2 研究方法
1.2.1 收集临床资料:询问先证者病史,查阅其既往病例资料。测量身高、体质量,计算体质指数(BMI)。统计化验指标:空腹血浆葡萄糖、餐后2 h血浆葡萄糖水平、糖化血红蛋白(HbA1c)、肝肾功能及血脂水平。记录未用药时口服75 g无水葡萄糖耐量试验(oral glucose tolerance test,OGTT)结果。对先证者进行1型糖尿病相关抗体检测:谷氨酸脱羧酶自身抗体(glutamic acid decarboxyl-ase antibody,GADA)、胰岛细胞抗体(islet cell antibody,ICA)、胰岛素自身抗体(insulin autoantibody,IAA),条件允许时同时测定蛋白酪氨酸磷酸酶IA-2自身抗体(autoantibody against protein tyrosine phosphatase IA-2, IA2A)[GADA、IAA和IA2A采用酶联免疫吸附法(ELISA)、ICA采用间接免疫荧光法测定。
1.2.2 基因检测:抽取研究对象外周血,采用全血基因组DNA快速提取试剂盒(北京博迈德科技发展有限公司)按操作说明提取DNA。采用文献[2]的引物序列扩增GCK基因(NM_000162.4、NP_ 000153.1)1~10号外显子及外显子和内含子交界区后进行直接测序(北京博迈德科技发展有限公司ABI3730XLDN分析系统)。测序结果通过美国加州大学圣克鲁斯分校 (UCSC)数据库(http://genome.ucsc.edu/cgi-bin/hgBlat)进行在线序列比对。对于检测到的基因突变或变异,与dbSNP147数据库、Clinvar数据库和人类基因突变数据库(http://www.hgmd.org,2017年公共版)进行比对。
2 结果
2.1 研究对象临床资料
病例1(图1A):先证者女,18岁,汉族。足月出生,出生体质量3.3 kg,母乳喂养。患者10岁时因颈部淋巴结炎检查发现空腹血糖升高,空腹血糖波动在6.2~6.8 mmol/L,餐后2 h血糖6.8 mmol/L,糖化血红蛋白波动在6.3%~6.5%,诊断为“糖尿病”。患者曾应用格列喹酮治疗,因效果不佳停药,停药后血糖稳定,无酮症酸中毒史。既往史:可疑有“先天性梨状窝瘘”。家族史:先证者父亲于40岁时因“头晕”检查发现血糖升高,空腹血糖12.0 mmol/L,无酮症酸中毒病史,诊断为“2型糖尿病”,平素服用二甲双胍500 mg 每日两次治疗,监测空腹及餐后2 h血糖均在8~9 mmol/L。有高脂血症、冠心病冠脉支架植入病史。先证者母亲血糖正常。查体:身高155 cm,体质量61 kg,BMI 25.4 kg/m2。化验肝肾功能、血脂、尿酸均正常,尿蛋白阴性,GAD、ICA、IAA、IA-A2均阴性。OGTT提示胰岛素分泌高峰后移(表1)。先证者父亲身高174 cm,体质量91 kg,BMI 30.1 kg/m2。
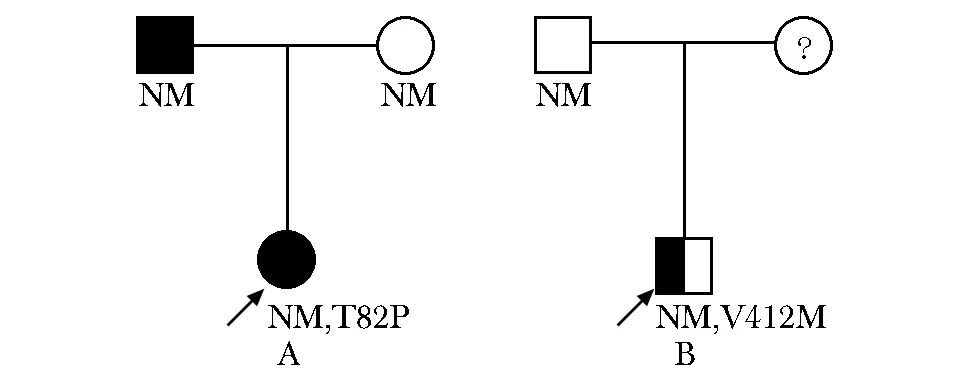
A.family 1; B.family 2; the black arrow indicates probands; square symbols indicate males, and round symbols indicate females; full filled quadrant indicates diagnosis of diabetes; semifilled indicates diagnosis of impaired fasting glucose regulation; question mark indicates that blood glucose and gene detection are unknown; NN indicates normal GCK gene; NM indicates the corresponding GCK gene heterozyg-ous mutation图1 两病例家系图Fig 1 Pedigrees of two families with hyperglycemia
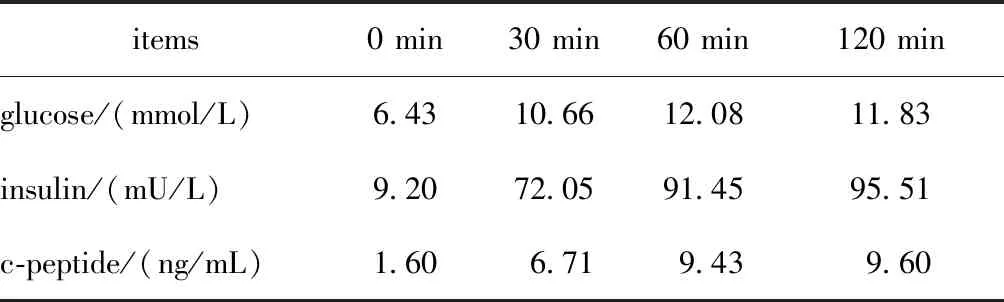
表1 先证者1的口服葡萄糖耐量试验结果Table 1 Oral glucose tolerance test results of proband 1
病例2(图1B):先证者,男,16岁,汉族。足月出生,出生体质量不详。患者15岁时偶然发现空腹血糖6.4 mmol/L,HbA1c 6.4%,后复查空腹血糖5.8 mmol/L,OGTT服糖后2 h血糖7.4 mmol/L, HbA1c 6.0%,诊断为“糖尿病前期”,通过运动控制血糖,未用药。既往史:有高尿酸血症病史。家族史:父亲空腹血糖4.9~5.5 mmol/L,HbA1c 5.8%。母亲血糖不详。查体:身高172 cm,体质量60 kg,BMI 20.3 kg/m2。化验肝肾功、血脂均正常,尿酸 499 μmol/L,尿蛋白阴性。GAD、ICA、IAA抗体均阴性。
2.2 葡萄糖激酶(GCK)基因的检测
于病例1先证者及其父亲发现GCK基因第3外显子c.244A>C杂合突变(图2A,B),该突变导致第82位苏氨酸突变为脯氨酸(p.Thr82Pro),经与数据库比对,该突变为新报告的突变。采用生物信息学软件PolyPhen-2(http://genetics.bwh.harvard.edu/pph2/)预测该突变为“很可能有害”(probably damaging,评分 0.992),采用PROVEAN(http://provean.jcvi.org/seq_submit.php)软件预测该突变为“有害”(deleterious,评分-4.891)。
于病例2先证者中发现GCK基因第9外显子c.1234G>A杂合突变(图2C,D),该突变导致第412位缬氨酸突变为甲硫氨酸(p.Val412Met)。经与数据库比对,该突变为致病性突变,且已在多个家系中被报告过[3],其HGMD登记号为CM096950。先证者父亲血糖正常,未检测到该突变,先证者母亲血糖情况不详,拒绝进行基因检测。
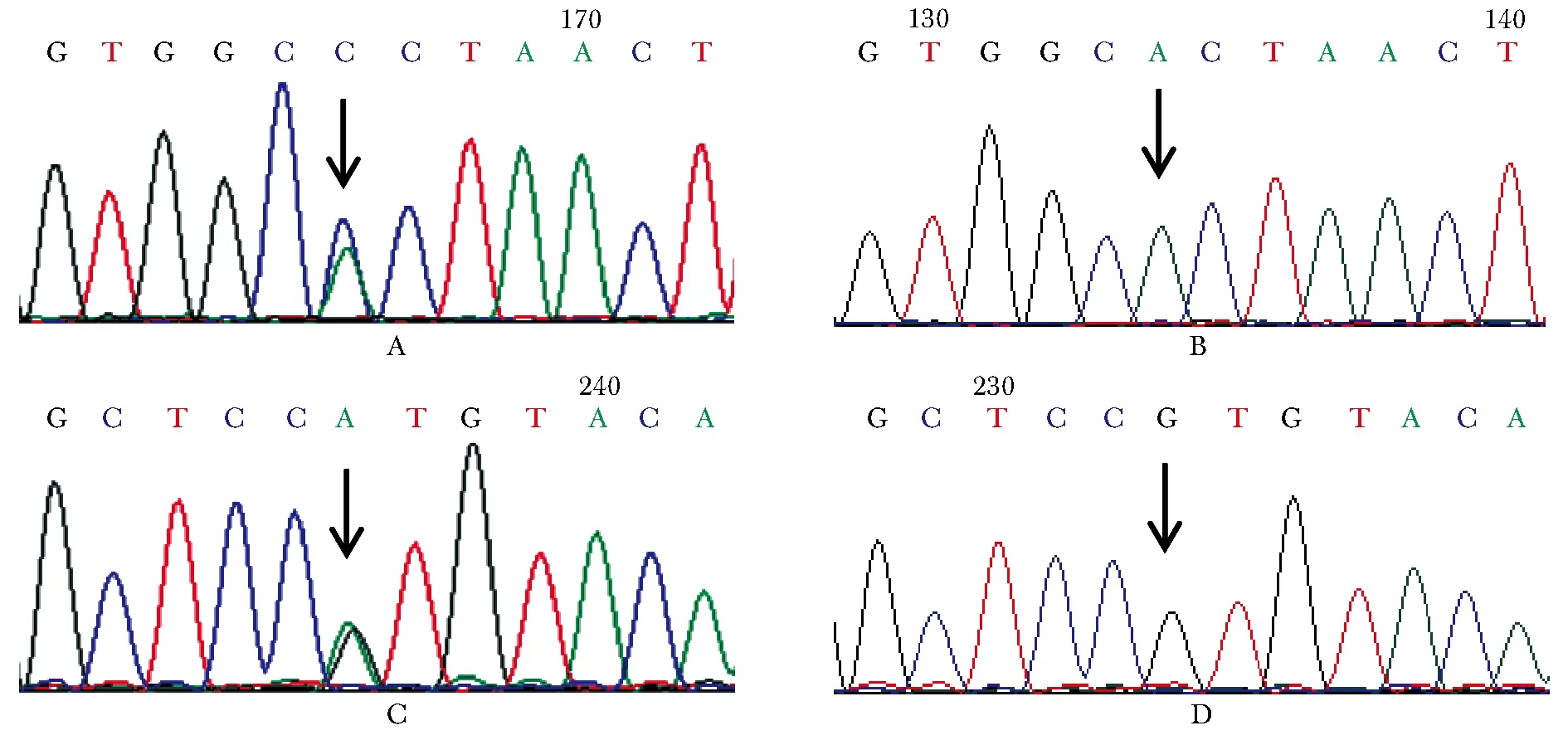
A.showed the heterozygous mutation of GCK gene c.244A>C in the proband of family 1; B showed the normal control of this locus; C showed the heterozygous mutation of GCK gene c.1234G>A in the proband of family 2; D.showed the normal control of this locus
2.3 病例随访
病例1: 已随访先证者至22岁。先证者21岁时因闭经、 肥胖(身高155 cm, 体质量72 kg, BMI 30.0 kg/m2)、空腹血糖升高(8.5 mmol/L)外院诊断为“多囊卵巢综合征”(具体不详),行减重手术(胃部分切除术)。术后月经恢复规律,体质量降至47.5 kg(BMI 19.8 kg/m2)并保持稳定,复查空腹血糖5.7 mmol/L,未应用降糖药物。先证者的父亲继续服用二甲双胍治疗,未规律监测血糖,曾两次患肛瘘。
病例2:已随访先证者至19岁。身高175 cm,体质量约62 kg,BMI 20.2 kg/m2,监测空腹血糖波动在5.6~6.4 mmol/L,HbA1c波动在 5.9%~6.2%,血脂水平正常,尿酸波动在444~545 μmol/L,无痛风发作史,未应用降糖及降尿酸药物。
3 讨论
GCK基因编码葡萄糖激酶,在ATP的参与下,将葡萄糖磷酸化为6-磷酸葡萄糖。Thr82位于该酶的ATP结合区,该位点的突变可能影响酶与ATP的结合[4]。目前有Thr82Ala和Thr82Ile自然突变导致MODY2的报告[5-6],本文的Thr82Pro为新报告的突变。结合Thr82位置的重要性及功能学软件预测的结果,推测Thr82Pro突变很可能为致病性突变。Val412Met亦见于其他已报告的MODY2家系[3]。
GCK基因突变导致的遗传性高血糖通常是轻中度的,多为偶然发现而诊断[7-8],且由于发病率低,很容易被误诊为发病率更高的1型或2型糖尿病。临床上,如若1型糖尿病患者在诊断3~5年后仍存在内源性胰岛素分泌,或2型糖尿病患者发病年龄较早且不伴有胰岛素抵抗,应当考虑MODY的可能,并应进一步行基因检测[9]。GCK基因突变的血糖特点也有助于MODY2患者的发现和诊断,包括空腹血糖水平通常在5.5~10 mmol/L[10-11],OGTT服糖后2 h血糖与空腹血糖水平差值小于4.6 mmol/L[12],HbA1c通常小于8.0%[9]。此外,MODY2患者通常不需要药物治疗,也少有糖尿病并发症发生[13]。
但是MODY2是GCK单基因突变的糖尿病,其患者合并发生1型或2型糖尿病的概率与背景人群是一致的。国内外研究已报告,MODY2患者可同时患有2型糖尿病或存在2型糖尿病高危因素,如肥胖、胰岛素抵抗和血脂异常[14-15]。胰岛素抵抗和血脂异常可能参与MODY2患者的糖耐量恶化和不良结局发生[16-17]。对于不伴有胰岛素抵抗的MODY2患者,传统降糖治疗无效,而对伴有胰岛素抵抗的患者,可能需要降糖治疗[15]。本文中的3例GCK突变患者均具有不同的代谢综合征表现,因此应长期随访,根据其不同的代谢异常给与合适的治疗。
总之,临床上应当关注不典型的1型或2型糖尿病患者,对诊断存疑的应尽可能进行基因检测并加强随访。对于确诊的MODY2患者,应当关注其总体代谢目标的实现。
