新型冠状病毒S蛋白RBD的糖基化及其长度对蛋白疫苗免疫原性的影响
2020-12-17王志荣许雪梅
张 婷,王志荣,许雪梅
(中国医学科学院基础医学研究所 北京协和医学院基础学院 生物物理及结构生物学系, 北京 100005)
鉴于目前尚无新型冠状病毒(severe acute respiratory coronavirus 2, SARS-CoV-2)特效治疗药物,疫苗是控制SARS-CoV-2大流行的关键措施。目前已有多种不同形式的疫苗进入临床试验[1],包括灭活疫苗、病毒载体疫苗、核酸疫苗及蛋白疫苗,其中蛋白疫苗诱发产生的中和抗体水平较高[2]。迄今上市的采用非传统技术生产的疫苗均为蛋白疫苗,如乙肝病毒样颗粒(virus-like particle, VLP)疫苗、HPV VLP疫苗、带状疱疹病毒糖蛋白疫苗及流感蛋白疫苗,该类疫苗安全性好,且在诱发中和抗体方面具有优势。
SARS-CoV-2为有包膜的正链RNA病毒,与SARS-CoV及中东呼吸道综合征冠状病毒(Middle East respiratory syndrome coronavirus,MERS-CoV)同属冠状病毒β属,均可诱发急性呼吸系统综合征,其中SARS-CoV-2和SARS-CoV的同源性很高[3]。病毒有4种结构蛋白(S、M、N、E),其中S蛋白是感染入侵的关键蛋白,以三聚体形式分布在包膜表面,其N端含有细胞受体结合域(receptor binding domain, RBD),是冠状病毒疫苗研究的主要靶抗原[4]。RBD与宿主细胞的血管紧张素转化酶2(angiotensin converting enzyme 2, ACE2)结合后,S蛋白发生变构,启动病毒感染入侵[5-6]。SARS-CoV-2的S蛋白高度糖基化,其RBD中至少有4个潜在糖基化位点[7]。目前,SARS-CoV-2的S蛋白糖基化水平对其免疫原性的影响尚不清楚。
SARS-CoV的病毒学及疫苗学研究为SARS-CoV-2疫苗的研发提供了有力的技术支持。首先,研究发现,与SARS-CoV一样,SARS-CoV-2的S蛋白融合前状态的维持也有利于RBD依赖的中和抗体的诱发。目前,进入临床试验的以S全长蛋白为基础的不同形式SARS-CoV-2疫苗均采用可保持融合前状态的S蛋白突变体基因(S-2P)[2,8],即将aa.986-987置换为2个脯氨酸。其次,SARS-CoV的研究发现,单独表达RBD片段也可诱发高滴度的中和抗体和保护反应[9-10],且不受S蛋白融合前状态的限制。与全长S蛋白相比,RBD片段的长度适中,易于改造和在多种不同表达体系进行高水平的表达及纯化。目前分离了多种RBD依赖的中和单抗[11-12],其识别表位是构象依赖的,表明RBD的中和表位具有一定的空间构象,其旁侧序列对表位构象的维持可能有一定的影响,目前有关不同长度RBD的报道较少。
酵母及CHO细胞表达SARS-CoV的RBD(aa.318-536)蛋白的研究目前已有报道[10,13],尚未见在昆虫表达体系的报道。昆虫细胞表达体系具有表达量高、易于悬浮培养、操作简单、表达蛋白的糖基化与哺乳动物接近等优点,特别适于真核来源的蛋白表达。本研究采用三聚体蛋白疫苗的形式,利用杆状病毒-昆虫细胞表达体系,表达获得3种不同的去除N-糖基化残基的SARS-CoV-2 RBD(aa.331-550)蛋白及糖基化位点正常的2种不同长度的RBD蛋白。结果显示,N-糖基化的去除可提高RBD三聚体蛋白在昆虫细胞中的表达水平,且免疫原性不受影响,长片段的RBD三聚体蛋白的免疫原性比短片段的好。
1 材料与方法
1.1 材料
293T细胞(本实验室保存);Huh-7细胞(中国医学科学院基础医学研究所刘力教授惠赠);草地夜蛾卵巢细胞Sf9、E.coliDH10Bac(Invitrogen公司);原核表达的RBD蛋白(中国科技大学金腾川教授惠赠);含G蛋白缺陷骨架的VSV病毒(本实验室构建);pcDNA3.1-hS质粒(本实验室构建);His标签抗体(OriGene公司);HisTrapTM HP预装柱(GE公司);氢氧化铝凝胶佐剂、MPL佐剂(InvivoGen公司);雌性Balb/c小鼠30只[斯贝福(北京)生物技术有限公司,合格证号:1103242011001338]。
1.2 方法
1.2.1 RBD融合基因重组穿梭质粒Bacmid的构建:在SARS-CoV-2 S蛋白序列(GenBank序列号为QHD43416.1)氨基酸319-591位(aa.319-591)或氨基酸331-550位(aa.331-550)的N端融合杆状病毒包膜糖蛋白gp64的信号肽序列(GenBank序列号为AIU56980.1,aa.1-38),C端融合T4噬菌体三聚化结构域(PDB序列号为1AVY_A,aa.45-71),并在下游进一步融合His标签序列(8个组氨酸),分别获得长片段的RBDST融合蛋白及短片段的RBDT融合蛋白。在RBDT的基础上,删除N331氨基酸,获得RBDT-N1融合蛋白;进行N343S突变,获得RBDT-N2融合蛋白;进行N360A突变,获得RBDT-N3融合蛋白。根据 Sf9 偏性密码子对上述RBD蛋白的基因序列进行优化,合成获得的RBD融合基因分别插入 pFastBac1 载体,转化DH10Bac感受态,PCR鉴定获得重组Bacmid,提取备用。
1.2.2 RBD蛋白的表达及鉴定:将携带RBD融合基因的重组Bacmid转染Sf9细胞,构建重组杆状病毒,感染Sf9细胞后(MOI=0.1),27 ℃培养约88 h,离心收集培养上清。12% SDS-PAGE及Western blot分析培养上清中的RBD蛋白表达情况。一抗为His标签抗体,二抗为 HRP标记的羊抗小鼠IgG。
1.2.3 RBD蛋白的纯化:表达不同RBD融合蛋白的培养上清在PBS中4 ℃透析24 h,经HisTrapTMHP亲和层析纯化,按GE公司说明书中提供的纯化方案纯化融合蛋白。
1.2.4 小鼠免疫:4~6周雌性Balb/c小鼠5只/组,RBD融合蛋白抗原10 μg/剂,联合50 μg/剂的氢氧化铝佐剂及5 μg/剂的MPL佐剂,于第 0、3、6周皮下免疫,设PBS免疫小鼠为对照组,于第5、8周尾静脉采集血清。
1.2.5 ELISA检测血清中RBD特异性IgG抗体水平:用PBS将原核表达的RBD蛋白稀释至1 μg/mL,包被96孔板(100 μL/孔);使用5% BSA封闭(200 μL/孔);用PBS倍比稀释待测血清,加入96孔板,4 ℃孵育过夜;加入HRP标记的羊抗小鼠IgG(1∶3 000),37 ℃孵育1 h;OPD底物显色(100 μL/孔),37 ℃反应5 min;2 mol/L硫酸(50 μL/孔)终止反应;检测A490。A490数值大于0.2且大于阴性对照2倍的最大血清稀释度视为特异性IgG抗体滴度。
1.2.6 假病毒的制备:制备方法如文献所述[14],使用S蛋白表达质粒pcDNA3.1-hS转染293T细胞,37 ℃培养24 h后,用含G蛋白缺陷骨架的VSV病毒感染细胞(MOI=4),37 ℃培养48 h。收集培养上清,检测假病毒的滴度。
1.2.7 假病毒中和实验:如文献所述[14],使用DMEM完全培养基稀释假病毒,将稀释后的假病毒与倍比稀释的待测血清等体积混合,4 ℃孵育1 h,然后加入预先铺好的Huh-7细胞中(2×104个/100 μL/孔,MOI=0.05)。37 ℃孵育24 h,使用流式细胞仪检测各孔细胞的感染抑制率。感染抑制率=(1-待测血清样品中的荧光细胞百分数/阴性对照样品中的荧光细胞百分数)×100%。感染抑制率大于50%的最高稀释倍数即为中和抗体滴度。
1.3 统计学分析
使用Graphpad软件分析实验数据并作图,ELISA抗体及中和抗体水平以平均滴度(GMT)±SD表示。
2 结果
2.1 RBD蛋白的表达鉴定
取等体积(60 μL)相同表达条件的各种RBD蛋白的表达上清进行12% SDS-PAGE及Western blot分析。结果显示,5种RBD蛋白均可在Sf9细胞中分泌表达,其中RBDST的分子质量约40 ku(图1,泳道1),其余4种RBD蛋白的分子质量约37 ku(图1,泳道2-5),上述5种RBD蛋白的表观分子质量均大于理论值,提示RBD蛋白在昆虫细胞中表达时发生了糖基化。值得注意的是,3种去糖基化的蛋白RBDT-N1、RBDT-N2及RBDT-N3的表达水平均高于RBDT(图1,泳道2-5),提示糖基化的去除可提高RBD蛋白在昆虫细胞中的表达水平。
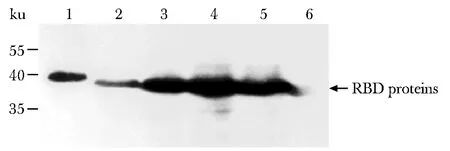
1.RBDST; 2.RBDT; 3.RBDT-N1; 4.RBDT-N2;5.RBDT-N3; 6.control medium图1 Western blot分析Sf9表达上清中的RBD蛋白Fig 1 Western blot analysis of RBD proteins in the culture media of Sf9 cells
2.2 去糖基化的RBD蛋白免疫血清RBD特异性IgG水平分析
为明确去糖基化对RBD蛋白免疫活性的影响,本研究比较了RBDT与3种去糖基化蛋白RBDT-N1、RBDT-N2及RBDT-N3诱发的RBD特异性IgG水平。结果显示,2次免疫后各组的RBD特异性IgG滴度在320~560,3次免疫后各组的特异性IgG滴度在6 400~11 200,组间均无统计学差异(图2)。PBS对照组未检测到RBD特异性IgG。

图2 糖基化不同的RBD蛋白诱发的血清特异性IgG抗体水平分析Fig 2 Analysis of RBD-specific IgG titers induced by RBD proteins with different glycosylation
2.3 不同长度的RBD蛋白免疫血清RBD特异性IgG水平分析
为明确片段长度对RBD蛋白免疫活性的影响,本研究比较了较短的RBDT与较长的RBDST诱发的RBD特异性IgG抗体水平。结果显示,2次免疫及3次免疫后,RBDST诱发的特异性IgG滴度分别为880和33 280,均显著高于RBDT免疫组(P<0.05,P<0.01)(图3)。

*P<0.05,**P<0.01 compared with RBDT group图3 不同长度的RBD蛋白诱发的血清特异性IgG抗体水平分析Fig 3 Analysis of RBD-specific IgG titers induced by RBD proteins with different length
2.4 RBD蛋白免疫血清中和抗体水平分析
本研究采用VSV骨架的SARS-CoV-2假病毒检测各组RBD蛋白3次免疫后的血清中和抗体水平。结果显示,RBDST诱发的中和抗体滴度最高,显著高于RBDT(P<0.01)及3种去糖基化的RBD蛋白(P<0.001)诱发的中和抗体(图4)。

*P<0.01,**P<0.001 compared with RBDST group图4 RBD蛋白诱发的SARS-CoV-2假病毒中和抗体分析Fig 4 Analysis of SARS-CoV-2 pseudovirus neutralization titers induced by RBD
3 讨论
杆状病毒-昆虫细胞表达体系具有表达水平高、安全性好、易于操作等优点。目前利用该体系生产获批上市的疫苗有HPV VLP疫苗、甲状腺癌治疗性蛋白疫苗及赛诺菲巴斯德的四价流感蛋白疫苗。研究发现,Sf9昆虫细胞表达的SARS-CoV RBD蛋白(aa.318-510)诱发的中和抗体滴度显著高于原核表达的[15]。本研究采用昆虫细胞表达体系对RBD(aa.331-550)的不同糖基化敲除突变体及两种不同长度的RBD蛋白进行表达,分析其免疫原性。结果显示,分别去除N331、N343和N360糖基化均可提高蛋白在昆虫细胞中的表达水平而不影响其免疫原性。SARS-CoV-2 RBD(aa.319-545)蛋白糖基化位点分析的结果[16]显示,N331、N343位点位于RBD受体结合基序结构的基部,即这2个位点不参与结合ACE2。本研究的3个糖基化位点中,N331和N343为典型的糖基化位点基序(NXT/Y)[7,17],N360为尚未确认的潜在糖基化位点。本研究获得的3个去糖基化的突变体免疫原性没有改变,可能是由于这些位点不在与ACE2结合的基序中。但采用SARS-CoV-2假病毒变异株的体外分析显示,N331突变增加了突变株对康复者血清的敏感性[18],因此N331突变株的抗原性值得深入研究;另外,酵母表达的去糖基化的SARS-CoV RBD蛋白分析[13]显示,去除N331同源的糖基化位点后,其表达水平显著降低,免疫血清的中和抗体水平(假病毒中和抗体水平不变,真病毒中和抗体水平显著提高)有待于进一步分析,而另2个突变体(N343、N360同源位点去糖基化)的表达极低,没有深入研究,这可能是采用的实验评价方法或表达体系不同造成的。本研究还发现,RBD长片段(aa.319-591)的免疫原性较短片段(aa.331-550)的高。结构分析显示,SARS-CoV-2 S蛋白的RBD区为aa.319-541区域,其中aa.437-508区域为受体结合基序(receptor binding motif,RBM)。在SARS-CoV的前期研究中发现,包含RBM的不同长度的RBD片段均可诱发中和抗体,目前SARS-CoV报道的RBD蛋白有2种长度,即193个氨基酸(aa.318-510)[9,13]和219个氨基酸(aa.318-536)[10,13]。最近又报道了两种不同长度的RBD蛋白疫苗,分别是长度为227个氨基酸的SARS-CoV-2 RBD (aa.319-545)蛋白疫苗[16],及长度为223个氨基酸的RBD(aa.319-541)单链二聚体的蛋白疫苗[19]。本课题组目前正在进一步比较这些不同长度RBD蛋白的免疫原性,同时进行去糖基化长片段RBD的研究。
理想的疫苗需同时诱发体液及细胞免疫反应,体液免疫的评价主要检测保护性抗体。康复者血清及S蛋白依赖的中和抗体的被动免疫试验证明,中和抗体在阻断病毒感染中起重要作用[20-22]。目前新冠疫苗研发免疫活性的指标主要是对抗体水平进行分析,因此本研究重点分析三聚体蛋白诱发的特异性IgG及中和抗体水平。结果显示,RBD三聚体诱发的IgG抗体最高可达104,中和抗体水平较IgG抗体低1个数量级。有文献报道的SARS-CoV-2疫苗的ELISA抗体滴度较高(可达105),但其与假病毒中和抗体滴度的比值也很高(100:1)[16,19],有些文献报道的ELISA滴度相对较低,但其与假病毒中和抗体的滴度比值较低(约10∶1)[2],这主要是不同研究采用的试验体系不同造成的,影响因素主要包括假病毒体系的不同(假病毒的骨架、S蛋白的密度)、分析用细胞系的不同等。因此,目前SARS-CoV-2疫苗的临床研究中经常用康复者血清的中和抗体滴度作为参照。在本研究基础上,本课题组将深入系统地优化RBD蛋白的结构及组成方式,进一步筛选产量高、免疫原性强的蛋白疫苗,届时将全面分析疫苗诱发的细胞免疫、体液免疫及体内保护活性。
总之,本研究发现,SARS-CoV-2 RBD去糖基化修饰可提高其在昆虫细胞中的表达水平,同时又不影响其免疫原性;较长片段的RBD蛋白疫苗(aa.319-591)免疫活性优于短片段的RBD蛋白疫苗。研究结果不仅可用于蛋白疫苗的研究,也可用于基于RBD蛋白抗原的病毒载体疫苗及核酸疫苗。
