胃癌高发区幽门螺杆菌对胃上皮细胞系GES1蛋白质组的影响
2020-12-17魏思思邓晓晴薛永娴黄永胜赵连梅单保恩
魏思思,邓晓晴,王 苋,薛永娴,黄永胜,赵连梅,单保恩*
(1.河北医科大学第四医院 科研中心, 河北 石家庄 050011; 2.石家庄市疾病控制与预防中心,河北 石家庄 050011; 3.中国医学科学院基础医学研究所 北京协和医学院基础学院, 北京 100005)
幽门螺旋杆菌(Helicobacterpylori,H.pylori)感染是胃癌发生的重要危险因素[1]。世界卫生组织(WHO)已将H.pylori归类为“Ⅰ类”致癌因子[2]。胃癌在全球范围内发病率排名第5(5.7%),死亡率排第3(8.2%)[3]。H.pylori还能够引起其他多种消化道疾病,包括胃炎、消化性溃疡病、胃食管反流病和消化不良等[4]。毒力因子cagA(cytotoxin-associa-ted gene A)和vacA(vacuolating cytotoxin A)是H.pylori相关疾病主要决定因素[5]。研究表明,慢性炎性反应被认为是癌的标志,免疫细胞的异常激活和炎性细胞因子的过度分泌促进胃癌的发展[6]。H.pylori可直接导致DNA双链断裂,并通过刺激产生间接导致DNA损伤的活性氧和活性氮[7]。因此,本研究分离了胃癌高发区H.pylori菌株,旨在通过研究高致病性H.pylori对GES1细胞系蛋白质组的影响,进一步阐明H.pylori诱导胃癌的具体机制。
1 材料与方法
1.1 材料
1.1.1 细胞系:人永生化胃上皮细胞系GES1(北京肿瘤防治研究所柯杨教授课题组惠赠)。
1.1.2 试剂及试剂盒:胎牛血清(BI),1640培养基(Gibco公司),Trizol试剂、反转录酶和SYBR Green PCR Kit(Promega公司),RIPA裂解液(Thermo Fisher Scientific公司)。
1.2 方法
1.2.1 GES1细胞和H.pylori的培养:GES1细胞在含有10%胎牛血清的1640培养基中,37 ℃、5% CO2条件下培养。
河北省胃癌高发区井陉县用C-13呼气实验鉴定阳性患者,胃镜下取胃黏膜,彻底研磨后接种在Karmali血平板上,37 ℃、微需氧(CO210%、O25%、N285%)条件下培养3~4 d,纯化出单个菌落后,并对基因型进行鉴定,命名为H.pylori-400。H.pylori-400以MOI=50的比例与GES1细胞共培养48 h。
1.2.2 RT-qPCR:GES1细胞与H.pylori-400共培养48 h后,加入Trizol试剂提取总RNA。用MMLV反转录酶反转为cDNA。用SYBR Green PCR Kit进行q-PCR反应。引物为IL-8: 上游引物5′-TACTCC AAACCTTTCCACCC-3′,下游引物 5′-CCTACAACAG ACCCACACAAT-3′; IL-1β:上游引物5′-AGCTAC GAATCTCCGACCAC-3′, 下游引物 5′CGTTATCC CATGTGTCGAAGAA3′; TNF-α:上游引物 5′-TTTCC GTGAAAACGGAGCTG-3′, 下游引物 5′-CACCCAC AAGAAGAGGCAGAT-3′。基因相对表达水平用2-ΔΔCt方法测定。
1.2.3 蛋白的提取和消化 GES1细胞与H.pylori-400共培养48 h后,用细胞刮刮下细胞,3 000 r/min,离心5 min,收集细胞沉淀,加入RIPA裂解30 min,超声6次,95 ℃ 2 min使蛋白变性,12 000 r/min,离心10 min去除细胞碎片,收集蛋白上清液进行蛋白质组学实验,BCA定量检测蛋白浓度。
用FASP酶解消化蛋白(filter-aided sample preparation)。取150 μg蛋白加入10 k超滤管中离心浓缩;用含50 mmol/L DTT 的300 μL UA缓冲液(8 mol/L尿素,0.1 mol/L Tris-HCl, pH 8.5)37 ℃孵育 30 min打开二硫键;用含50 mmol/L IAA的300 μL UA缓冲液暗处反应30 min进行烷基化;300 μL UA缓冲液置换3次,300 μL 50 mmol/L NH4HCO3置换2次;加入胰蛋白酶1∶100 (w/w) 37 ℃消化18 h。消化完成后,离心洗脱肽段,用自制C18小柱脱盐,冻干后用0.1% FA溶解,最后肽段定量后进行质谱检测。
1.2.4 高效液相色谱-质谱联用技术检测蛋白质组:用液-质联用技术对H.pylori处理过的GSE1细胞蛋白质组进行分析,每个反应上样量为1 μg肽段。高效液相色谱分析用HPLC Easy-nLC 1200(Thermo Fisher Scientific公司),流速为300 nL/min。缓冲液 A 为0.1% FA缓冲液,缓冲液B为0.1% FA的80% ACN。液相梯度设置如下:2%~8%缓冲液 B 1 min; 8%~28%缓冲液 B 60 min; 28%~37%缓冲液B 14 min; 37%~100%缓冲液B 5 min; 100%缓冲液B 10 min。蛋白质组学分析采用Q Exactive HF质谱仪 (Thermo Fisher Scientific公司),设置为阳离子模式,喷雾电压2.1 kV,离子传输管温度为320 ℃,Xcalibur软件进行数据依赖性采集。MS1设置为分辨率60 000,AGC target 3e6, maximum IT 20 ms,选择top 20进行MS2,分辨率为15 000,AGC target 1e5,maximum IT 45 ms。其他设置为fixed first mass 110.0 m/z,isolation window 1.6 m/z,NCE 27%,dynamic exclusion time 45 ms。
1.2.5 质谱数据分析:所有原始数据采用PD2.2软件进行lable-free定量分析,鉴定数据库为Uniprot上下载的human FASTA文件。按照abundance ratio≥2或≤0.5的标准选择差异表达蛋白。用在线软件enrich.shbio.com进行KEGG通路分析, Cytoscope的ClueGo插件进行GO富集分析。
1.3 统计学分析

2 结果
2.1 分离、培养并鉴定胃癌高发区H.pylori-400
分离出胃癌高发区的幽门螺杆菌临床菌株后,革兰染色下可以看到螺旋状、S型和海鸥状等不规则的革兰阴性弯曲杆菌(图1);胃幽门螺杆菌检测试剂盒显示,尿素酶实验阳性。因此,初步鉴定为幽门螺杆菌。
图1 革兰染色鉴定幽门螺杆菌Fig 1 Identification of Helicobacter pylori by Gram staining
进而,飞行时间质谱技术和16S rRNA测序方法证实为幽门螺杆菌。其基因型为CagA(+)、VacA(s1a、s2、m1b、i1)、iceA1、cagE2,并将其命名为H.pylori-400。
2.2 H.pylori-400对GES1细胞炎性因子表达的影响
与对照组相比,GES1细胞加入H.pylori-400后,细胞内IL-8、IL-1β和TNF-α的表达水平均显著升高(P<0.05)(图2)。
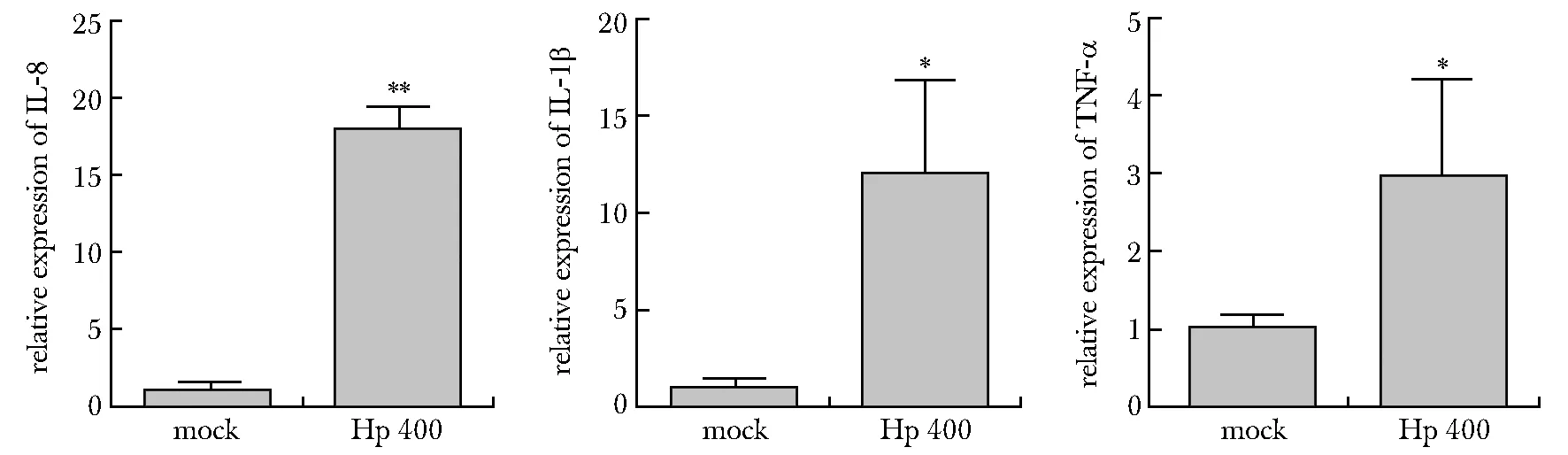
*P<0.05, **P<0.01 compared with mock group图2 H.pylori-400感染GES1细胞后对炎性因子表达的影响Fig 2 Effect of H.pylori-400 infection on the expression of inflammatory factors in GES1 cells
2.3 Lable-free定量质谱分析
高效液相色谱联合质谱共鉴定出3 959个蛋白,差异表达蛋白为665,如图3A火山图所示。将这些差异表达蛋白进行分析,筛选出蛋白FDR可信度高,且在每个样品中表达丰度都高的差异表达蛋白,共373个蛋白,其中143个蛋白降低,230个蛋白升高,热图分析如图3B。
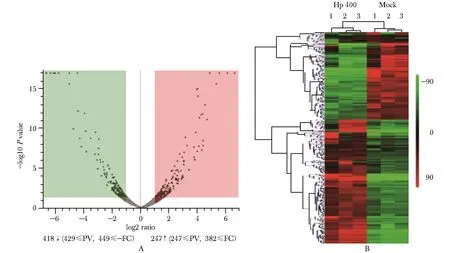
A.volcano plots; B.heat map图3 质谱分析筛选H.pylori-400感染GES1细胞后的差异表达蛋白Fig 3 Screening of differentially expressed proteins in GES1 cells infected with H.pylori-400 by mass spectrometry
2.4 差异蛋白富集分析
用Cytoscape的ClueGo软件对差异表达蛋白进行GO富集分析,在线软件enrich.shbio.com进行KEGG通路分析,这些通路包含细胞周期调节、周期依赖蛋白激酶活性调控、T细胞免疫活性和细胞组分重组等(图4A, B)。
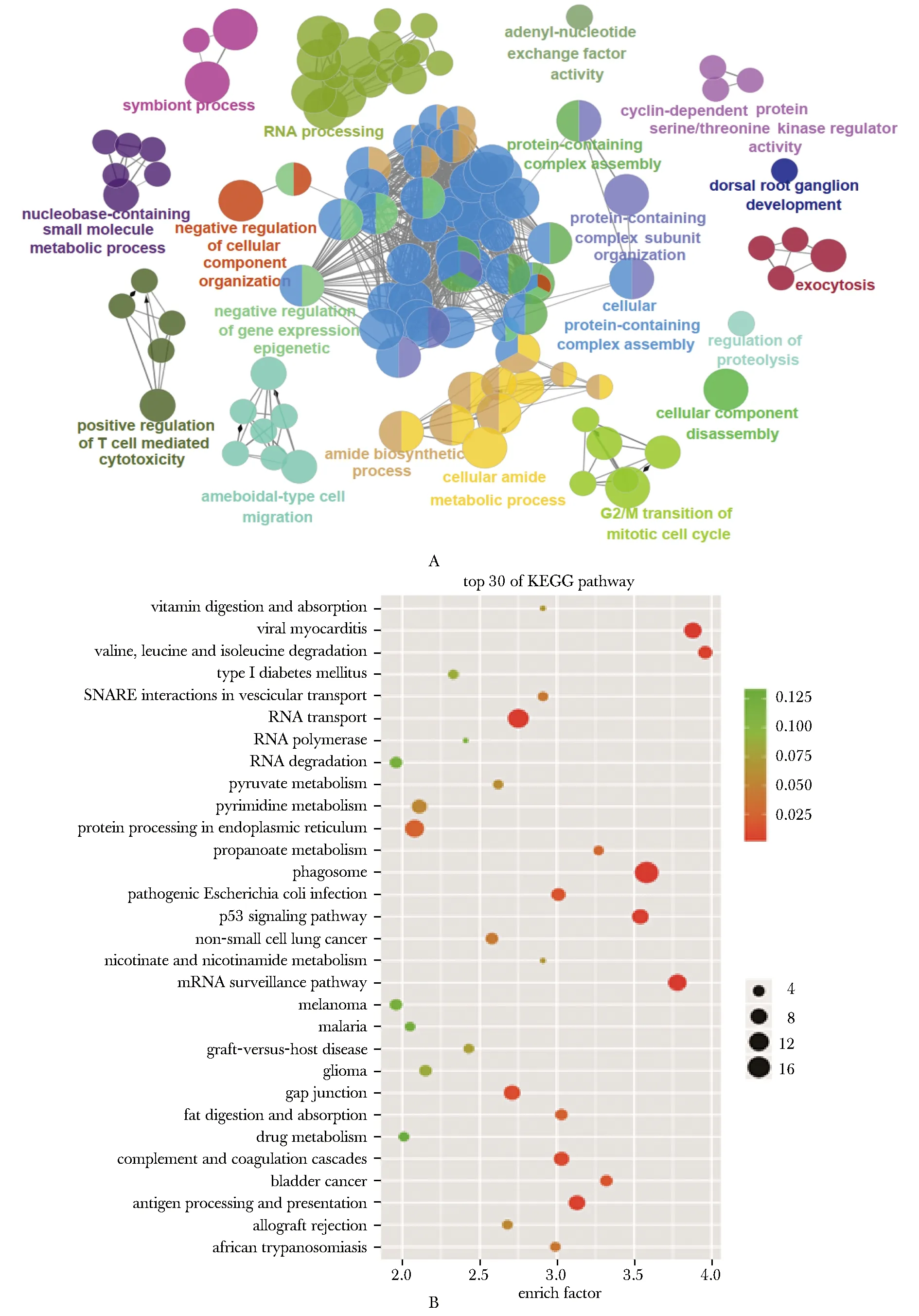
图4 差异表达蛋白的GO富集分析(A)和KEGG通路分析(B)Fig 4 Go enrichment analysis (A) and KEGG pathway analysis (B) of differentially expressed proteins
2.5 Hub基因选择及与预后的关系
通过String和Cytoscape的cytohubba插件联合找出差异表达蛋白的蛋白相互作用(PPI)网络的前10位关键基因(hub)(图5A,B)。其中ALB、RPL9、CASP3、WDR12、BOP1、POLR1A和EIF4A1在H.pylori-400感染的GES1细胞中表达升高(表1),在the human protein atlas网站上预测hub基因与生存的关系,发现蛋白高表达与胃癌、肝癌和肾癌生存呈显著负相关(图5C)。
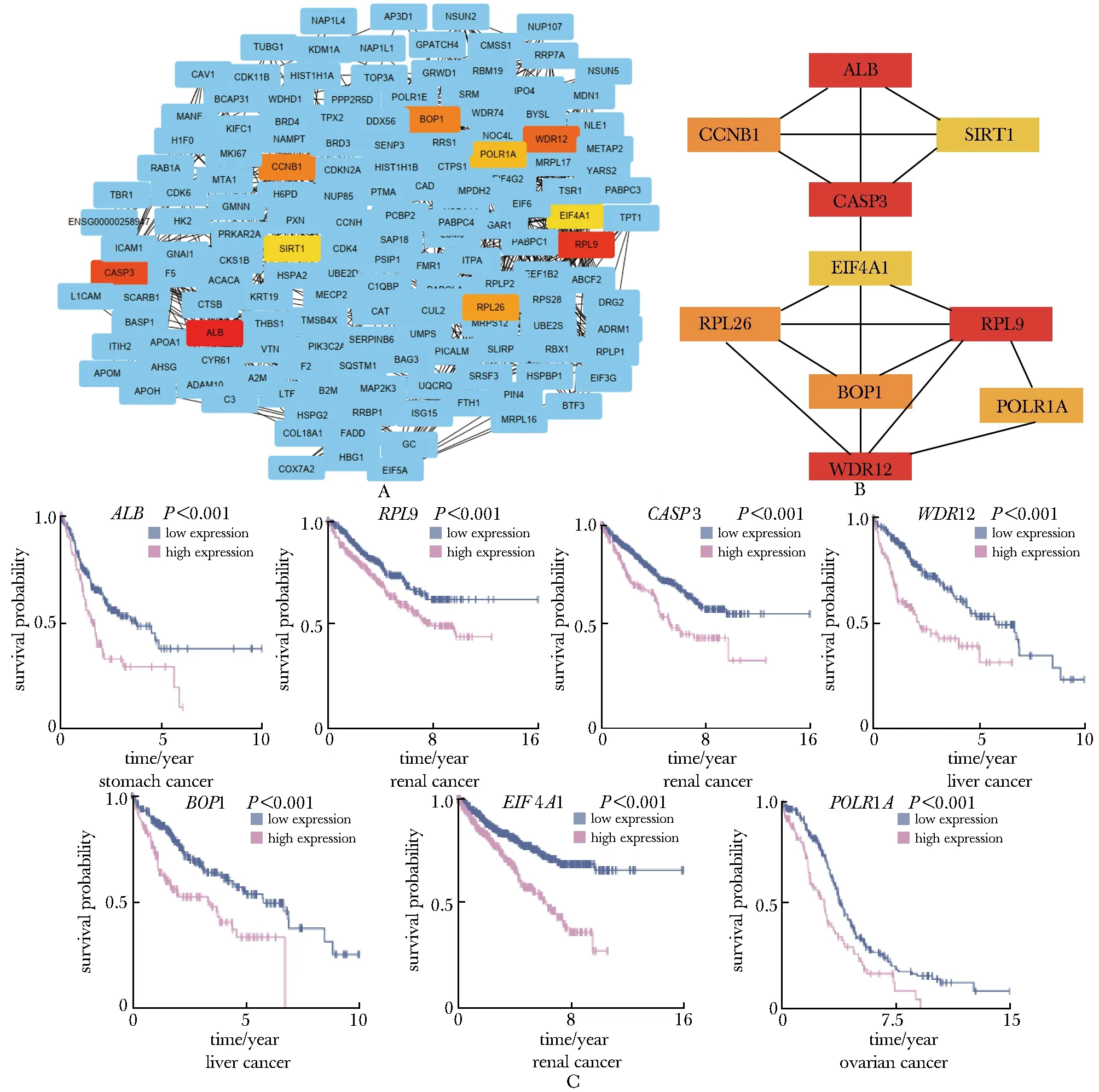
图5 差异表达蛋白的PPI中排名前10的关键基因(Hub)(A,B)及其与肿瘤预后的关系(C)Fig 5 Top 10 hub genes in PPI of differentially expressed proteins(A,B) and their relationship with tumor prognosis(C)
3 讨论
H.pylori是已知的胃癌的最强危险因素,因此,本研究分离了胃癌高发区的H.pylori-400,检测了基因型,进一步用质谱技术检测了H.pylori-400导致的正常胃上皮细胞GES1蛋白质组的改变,初步探索该病原体引发胃癌的具体机制。
H.pylori的致病因子包括vacA、cagA、babA、hopQ、oipA和homA/B,其中,cagA和vacA是主要的毒力因子,vacA能够促进胃上皮细胞空泡化,并启动细胞凋亡[8],cagA参与胃癌前病变,促进黏膜炎性反应和细胞增殖[9]。本研究中,临床菌株H.pylori-400的基因型为vacA(s1a、s2、m1、i1),cagA阳性,明确其致病机制则更有意义。
胃癌的发病机制为慢性炎性反应,继而形成慢性非萎缩性胃炎,慢性萎缩性胃炎,肠化生,异型增生,最终形成胃腺癌。多种炎性因子参与H.pylori感染相关胃癌的发生及进展。比如,H.pylori感染能够诱导IL-1升高,IL-1是胃癌进展的主要风险因子[10]。IL-8是一种有效的中性粒细胞趋化因子和激活因子,介导了强烈的促炎反应[11]。肿瘤坏死因子(TNF)是一种参与全身炎性和Th1反应的细胞因子[12]。H.pylori-400感染GES1细胞后,炎性因子IL-8、IL-1β和TNF-α表达升高,表明H.pylori-400能够促进胃上皮炎性反应。
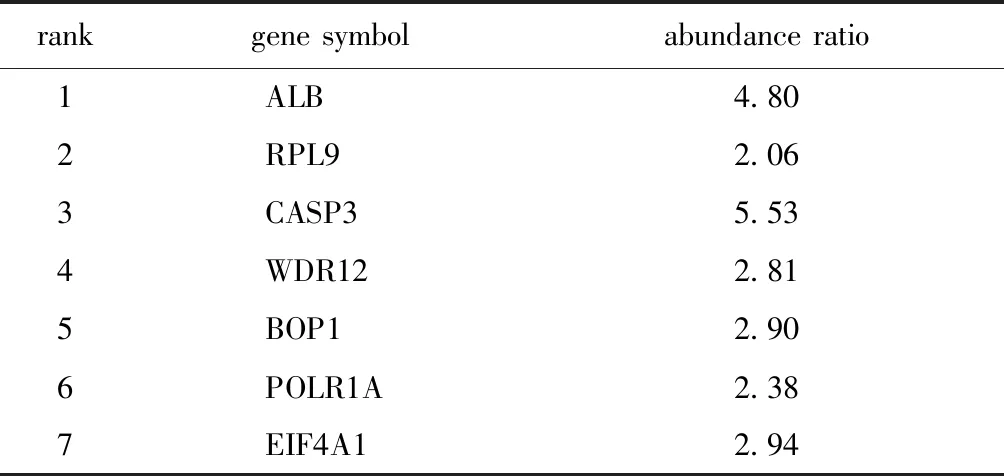
表1 质谱分析Hub基因的表达Table 1 Expression of hub genes analyzed by MS data
本研究利用HPLC-MS技术筛选出H.pylori-400感染后胃上皮细胞GES1中发生变化的蛋白,进行富集分析后确定了许多典型的信号通路,这些通路通常在H.pylori感染时被激活,比如T细胞介导细胞毒性反应、细胞迁移能力、细胞组分重配、细胞周期蛋白活性及P53信号通路等发生改变,促进肿瘤的发生。对这些网络更透彻的了解将有助于开发有针对性的途径和效应器,以提高临床治疗效益和疾病预防。
此外,本研究在差异表达蛋白的相互作用网络中筛选出了前10位Hub基因,它们与多种肿瘤的预后都显著相关,其中BOP1在人结直肠癌细胞中通过JNK通路促进细胞的迁移和侵袭能力[13]。在哺乳动物细胞中,沉默POLR1A的表达可以稳定抑癌基因P53信号通路[14]。EIF4A1的异常高表达促进胃癌细胞的EMT过程,并且与胃癌预后呈显著负相关[15]。
综上所述,本文利用蛋白质组学方法能够确定胃上皮细胞对H.pylori-400感染的反应,这一技术和方法允许识别和验证新的蛋白靶点,这些靶点在H.pylori诱导的胃癌发生中起重要作用。
