溴乙烷制备实验的溴乙烷产率影响因素研究
2020-12-16王玉林
王 珏,王玉林,李 换
(黔南民族师范学院化学化工学院,贵州 都匀 558000)
制备实验是基础有机化学实验课教学内容的重点,溴乙烷的制备是一个以SN2双分子亲核取代反应为原理进行合成的实验。用乙醇、溴化钠和硫酸作用是实验室制备溴乙烷的常用方法。目前,高等教育有机化学实验众多教材中所介绍的“溴乙烷的制备”都采用了相同的方法和步骤,只是反应物的用量和实验规模大小的不同,但普遍存在产率过低的问题,与理论产量的差距甚大,导致实验效果不够明显。为了改进该实验,有些学者研究了加料顺序[1]对溴乙烷产率的影响,或者是提高乙醇的配比[2]而增加溴乙烷产量。但缺乏系统地对实验条件的影响溴乙烷产率的研究。为了掌握实验条件对溴乙烷产率的影响,笔者通过改变实验条件:如改变加料顺序、改变实验装置、改变水的用量、改变硫酸的用量、改变溴化钠的用量,对产物产量的影响,寻找出能够使产物的量最大的最佳实验条件。
1 实验过程
1.1 实验室制备溴乙烷的反应原理


实验中又涉及如下副反应:


1.2 实验仪器
圆底烧瓶;球形冷凝管;接受弯头;温度计;蒸馏头;分液漏斗;锥形瓶。
1.3 实验药品
无水乙醇;溴化钠(无水);浓硫酸(d=1.84);饱和亚硫酸氢钠;无水氯化钙。
1.4 实验步骤
文献[1-7]均有下列步骤:
(1)在圆底烧瓶中加入10 mL(0.15 mol)无水乙醇及9 mL水,在不搅拌下缓缓加入浓硫酸19 mL(0.34 mol),混合冷却至室温;
(2)在搅拌下加入研细的溴化钠15 g(0.15 mol)和几粒沸石,装配成普通的蒸馏装置;
(3)接受瓶置于冰水浴中冷却,接引管的支口用橡皮管导入到下水道或室外;
(4)小火加热烧瓶,控制火焰的大小,约30~35 min后慢慢加大火焰到无油滴蒸出为止;
(5)将接收器中的液体进行分液,用1~2 mL浓硫酸洗涤粗产物,再分去下层的硫酸层,溴乙烷层倒入蒸馏瓶中,收集35~40 ℃馏分。
2 实验结果
2.1 实验装置的改变对产物量的影响
文献[1]教材的装置是一般的普通回流装置,笔者认为,因为溴化氢容易挥发,有可能来不及参与乙醇反应而从尾接管逸出,所以将装置在原有的基础上加上一个回流装置,上口堵塞,从而使溴化氢有一定的缓冲区域和停留时间而得到充分利用。装置使用标准磨口玻璃仪器,改进的装置图如图1所示。
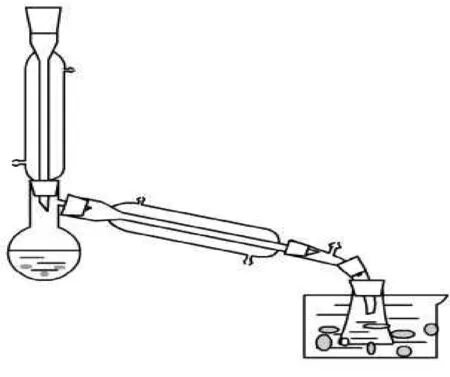
图1 实验室制备溴乙烷的改进装置
以文献[1]教材的实验装置和改进后的装置分别操作实验,实验步骤同上,加料顺序:水→浓硫酸→乙醇→溴化钠,实验结果见表1。

表1 实验装置对溴乙烷产量的影响
装置的合理与否是关系合成成败或产量高低的关键,我认为采用改进后的装置应用于此反应较为合理,恰当,可以明显提高产率。
2.2 水量的改变对产物量的影响
用19 mL(d=1.84)(35 g 0.34 mol)浓硫酸,10 mL无水乙醇,15 g(0.145 mol)溴化钠,5~18 mL水,饱和亚硫酸氢钠溶液进行实验。
实验步骤:同上,加料顺序同上。
实验结果:见图2。

图2 水量对产物的影响
实验结论:通过以上实验数据可以看出,当水量为13 mL时,溴乙烷的产量最高;水量较多或者较少时,溴乙烷的产量都会降低,而且在实验过程中发现粗品的颜色会随着水量的增加而变浅,由此得出本实验的最佳的用水量为13 mL。此条件下实验时,产物的产量为7.12 g。
分析:(1)反应是SN2双分子亲核取代反应,反应物乙醇的空间位阻小,有利于亲核试剂进攻,反应速率与反应物的浓度和试剂浓度都成正比,而乙醇又能与水形成氢键,与水任意比混溶。因此,水量的增加可以提高溴乙烷的产量,但是水量较多也会降低硫酸的浓度,导致硫酸的洗涤和催化效果变差,从而使最后的产物产量降低。
2.3 溴化钠用量对产物量的影响
用13 mL 0.72 mol水;10 mL无水乙醇;11~21 g的溴化钠;19 mL(d=1.84)(35 g,0.34 mol)浓硫酸和饱和亚硫酸氢钠进行实验。
实验步骤:同上,加料顺序参照文献[2]的结论。
实验结果:见图3。

图3 溴化钠用量对产物的影响
实验结论:如果不是乙醇过量而是溴化钠过量,产量会明显降低,当溴化钠的用量为17 g之前,乙醇过量,溴乙烷的量随溴化钠用量的增多而增多,溴化钠的用量为17 g时,相同的实验操作条件下,产物的产量最大,约为7.78 g,之后随溴化钠用量的增多产物溴乙烷的量反而减少。
分析:溴化钠的用量增加时可以增加溴乙烷的产量,但也不是越多越好,其用量有一个度的问题,所以溴化钠的用量一定要把握好,否则因为溴化钠量多而因为其吸水性使水量减少,产物的产量降低,再者溴化钠较昂贵,若使其过量是不经济的。
3 结 论
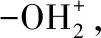

但是,如果按照最佳物料配比:13 m水;10 mL乙醇;17 g溴化钠的配比进行实验,此时,溴化氢的还原电位为-1.11 V,硫酸的氧化电位为-0.95 V,很难发生上述的副反应,也即使硫酸在最佳实验条件下的氧化性可以忽略,故解释了最佳实验条件选择的根本原因。可以得出最佳实验装置以及三种物料量的最佳数值:水量为13 mL、浓硫酸为19 mL、乙醇的体积为10 mL、溴化钠的用量为17 g,四者用量的质量比约为13:35:7:17,在此实验条件下,产物的产量约为7.8 g,折光率为1.4234(20 ℃)。
(2)本实验通过改变改变加料顺序、改变实验装置、改变水的用量、改变硫酸的用量、改变溴化钠的用量等,较系统地探究了实验条件对产物产量的影响。对如何改变教学的僵化实现教学不断进步、如何强化实际教学效果与理论的结合,进行了有益的尝试。对培养了学生的严谨的科学态度、敢于怀疑批判的科学精神、敢于失败中求真的毅力、勇于践行的科学素养等的教学效果良好。
