电导法测定弱电解质电离平衡常数实验的改进*
2020-12-16阴军英
阴军英
(滨州学院化工与安全学院,山东 滨州 256600)
电导法测定弱酸电离平衡常数实验是典型的物理化学实验,其中弱电解质经常选用弱酸,通过准确标定弱酸溶液的浓度,并测其电导率,来计算溶液的电离平衡常数。通过实验能够使学生加深理解电离平衡常数、电离度、电导率等,学会电导率的使用,明了弱电解质随浓度的一个变化规律。但是,一般选用的弱酸是醋酸。不具有普遍性[1-4]。
本实验拟选用新的一个一元弱酸-甲酸,先配置不同浓度的甲酸和甲酸钠溶液,在恒温条件下,分别测它们的电导率的值,根据电离平衡常数的定义式以及科尔劳乌施(Kohlrausch)公式计算甲酸的电离平衡常数,根据弱酸电导率,摩尔的电导率以及电离度之间的关系,研究出一种新的对于广泛性的一元弱酸其电离平衡常数的测定方法[5-8]。
同时也能够使学生从本实验的改进中,更加透彻地理解电导率、摩尔电导率、无限稀释摩尔电导率等相关概念,掌握及它们之间的区别与相互关系,并启发学生在设计实验时能用利用所学理论知识和灵活的的思维方式去开发新的实验设计思路和方法。
1 实 验
1.1 仪器与试剂
DDSJ-308A型电导率仪,上海雷磁仪器有限公司;DJS-1型铂黑电极,上海雷磁仪器有限公司;恒温水浴锅;8个烧杯(50 mL);8个容量瓶(100 mL);吸量管(10 mL)。
标准甲酸溶液(0.1000 mol/L);标准甲酸钠溶液(0.1000 mol/L);电导池;电导水。
1.2 实验步骤
首先,分别移取标准甲酸溶液3.00 mL、5.00 mL、7.00 mL、9.00 mL于100 mL容量瓶中,稀释至刻度,摇匀,标好1~4#样品。然后,分别移取标准甲酸钠溶液3.00 mL、5.00 mL、7.00 mL、9.00 mL于100 mL容量瓶中,稀释至刻度,摇匀,标好5~8#样品。
其次,调节恒温水浴锅温度25 ℃,将1~8#样品倒入电导池中,放入恒温水浴锅中恒温10 min,同时打开电导率仪,预热10 min。
最后,用蒸馏水充分浸泡电导池和铂黑电极,再用少量待测液荡洗数次,然后注入待测液,使液面超过电极1~2 cm,进行测量,测量时在恒温水浴锅中进行。按照浓度从小到大的顺序,分别测定1~8#样品的电导率的值。
2 结果与讨论
甲酸在水中存在如下电离平衡:
HCOOH↔HCOO-+H+
假设甲酸浓度为c,甲酸在水中的电离度为α,则电离平衡时,水溶液中甲酸的浓度为c(1-α),氢离子和甲酸根离子的浓度均为cα,则电离平衡常数KC的表达式为:
(1)
一定温度下KC为常数,因此可以通过测定甲酸在不同浓度水溶液中的电离度α带入公式1中,求出KC的值。
而电离度α与摩尔电导率Λm存在下列关系:
(2)
依据电离度α和电导率κ的关系,可得
(3)
查表得[2]:
对于强电解质的稀溶液存在下列关系式[3]:
(4)
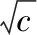
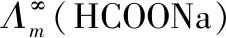
将公式3带入公式1,得KC的表达式:
(5)
将上式转换后得
(6)
再配制一系列不同浓度的甲酸溶液,测得其电导率的值,以cΛm对1/Λm作图,即可得KC的值。
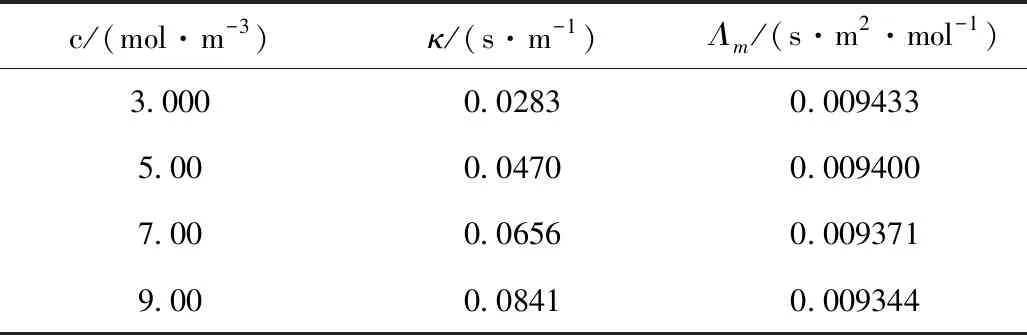
表1 25 ℃时不同浓度甲酸钠溶液的实验测定结果
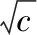
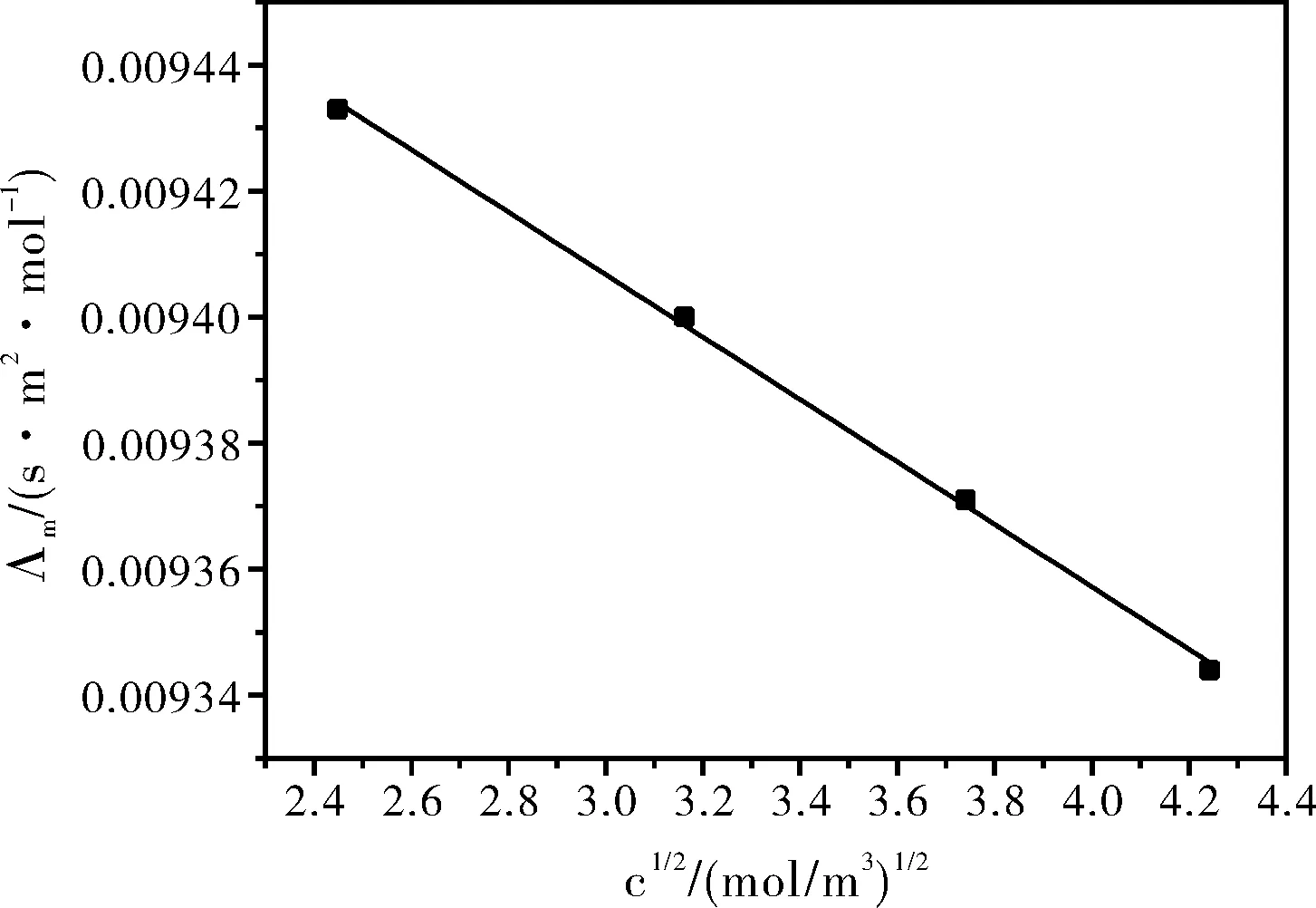
图1 25 ℃时甲酸钠水溶液中摩尔电导率与浓度关系图
表2为实验测得25 ℃时不同浓度甲酸溶液的电导率值,以cΛm对1/Λm作图,得图2,根据公式6,计算得KC=1.78×10-4,与文献报道[3-6]值1.77×10-4-1.80×10-4基本一致。

表2 25 ℃时不同浓度甲酸溶液的实验测定结果
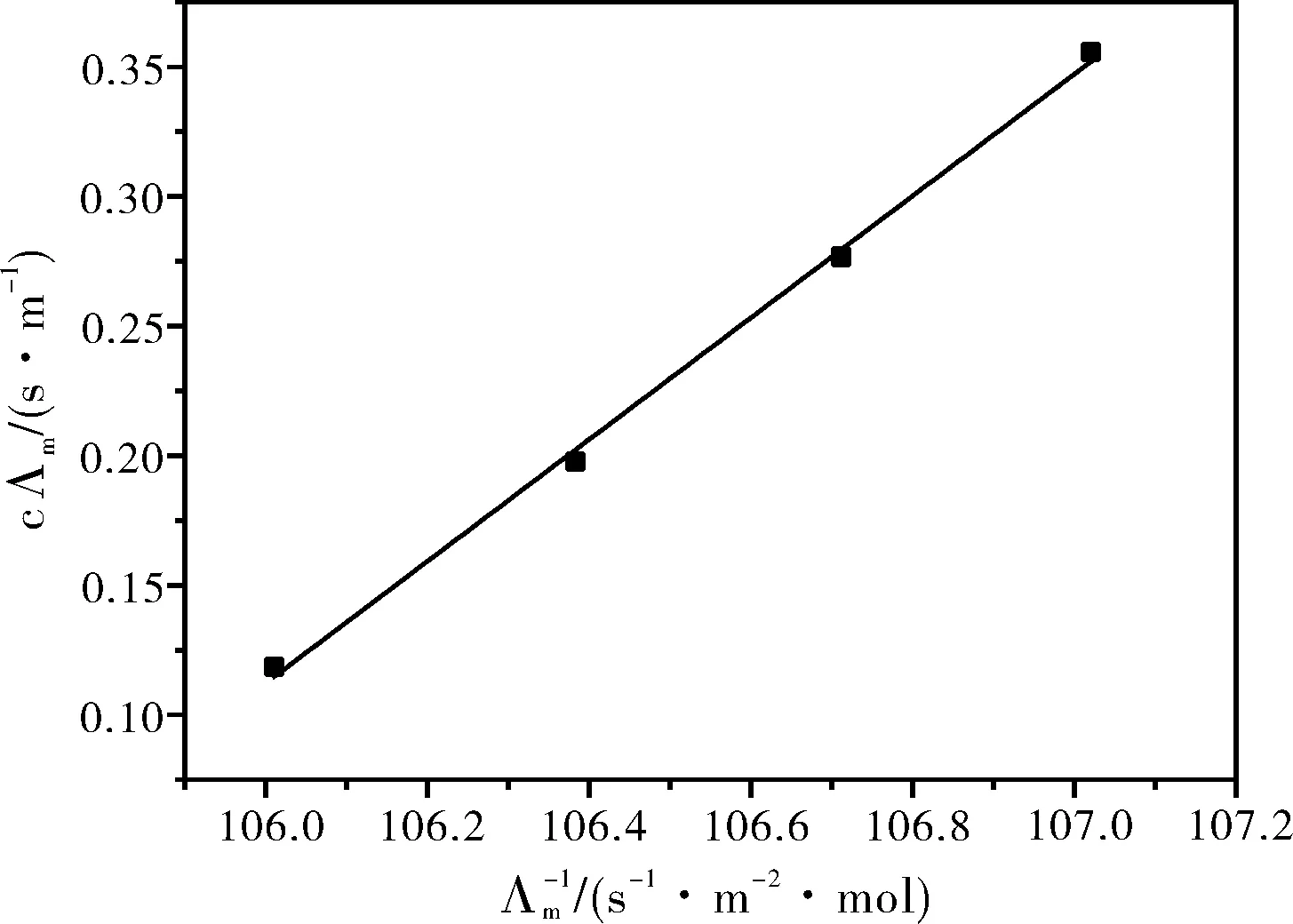
图2 25 ℃时甲酸水溶液中摩尔电导率与浓度关系图
3 结 论
选用新的一个一元弱酸-甲酸,配制了甲酸和甲酸钠溶液,在恒温条件下,分别测定它们的电导率的值,根据弱酸电导率,摩尔的电导率以及电离度之间的关系,计算出甲酸的电离平衡常数,与文献报道结果相一致。研究出了一种新的对于广泛性的一元弱酸其电离平衡常数的测定方法,同时使学生能够从本实验的改进中、更加透彻地掌握电导率、摩尔电导率等相关概念,及它们之间的相互关系,并启发学生在设计实验时能用利用所学理论知识和灵活的的思维方式去开发新的实验设计思路和方法。
