大动脉粥样硬化型和小动脉闭塞型脑梗死患者Lp-PLA2水平与颈动脉粥样硬化斑块的关系
2020-12-16张炎钱小燕沈芳缪桂华唐晴陆丽芸吴亚平毛慧慧王万华张露远
张炎,钱小燕,沈芳,缪桂华,唐晴,陆丽芸,吴亚平,毛慧慧,王万华,张露远
脑梗死在我国具有高患病率、致残率及病死率的特点,并且对社会和家庭产生严重的经济负担,找到阻止其发生发展的途径是当前研究的热点。脑梗死在临床上通常采用国际上公认的TOAST分型进行病因分型[1],其包括大动脉粥样硬化型(LAA)、小动脉闭塞型(SAO)、心源性脑栓塞、其他原因及原因不明等五种亚型。我国主要以LAA型及SAO型最常见[2,3]。LAA型主要是大动脉粥样硬化导致的大面积的梗死,而SAO型主要是穿支动脉或终末小动脉本身的病变引起的小腔隙性梗死。二者都是脑缺血性疾病,有着共同的危险因素,如高血压、糖尿病、高血脂、吸烟、饮酒等,目前临床治疗基本都是抗血小板聚集、抗凝、调脂、稳定斑块、促进循环等。影像学显示:SAO型患者多伴有大动脉粥样硬化,而LAA型患者也会有一些腔隙性梗死灶,因此寻找病因或相关致病因子,对于针对性治疗显得尤为重要。血浆脂蛋白相关磷脂酶A2(Lp-PLA2)是近年来发现的与脑梗死相关的炎性标志物[4,5],由成熟的巨噬细胞、T-淋巴细胞、肥大细胞合成和分泌,并受炎性物质的调节,能够水解血小板活化因子,与LDL结合[6],水解LDL上氧化的鳞脂,生产新的促炎物质和促进动脉粥样硬化的形成[7-9]。本文通过比较LAA型及SAO型的二者相关危险因素及Lp-PLA2水平,Lp-PLA2与颈动脉粥样硬化斑块之间的关系,找寻Lp-PLA2在两型中的作用,为针对性的治疗提供依据。
1 对象和方法
1.1 研究对象收集2016年1月至2018年6月于昆山市第一人民医院神经内科住院的脑梗死患者191例,入选标准符合2014年中国缺血性卒中诊治指南[10],入院后经TOAST分型分为LAA型和SAO型两组,LAA型是指脑梗死神经功能缺损相对应的颅内外大动脉闭塞或狭窄≥50%,主要通过血管影像学确认,且至少有一个以上的危险因素或者其他动脉粥样硬化证据。排除标准:①心源性或者危险因素为中度以上导致的心源性脑梗死;②狭窄≥50%或脑大动脉完全闭塞导致动脉供血部位以外的脑梗死病灶。SAO型包括:①有明显腔隙性脑梗死的临床表现,且与神经功能缺失相符合的影像学边界清晰的病灶(最大直径<1.5 cm);②无明显腔隙性脑梗死的临床表现,且影像学病变较小(直径<1.5 cm);③有腔隙性梗死的症状,但并不明显,影像学也未检查出明显相符的病变部位,相关检查需进一步完成。若患者既往有高血压、糖尿病可作为支持条件[11]。排除标准:①心源性脑梗死或颅内外大动脉病变而导致的腔隙性脑梗死;②皮质及皮质以下≥1.5 cm的梗塞灶。符合LAA型114例和SAO型77例,排除其他TOAST分型,包括心源性、其他原因及原因不明型,心源性脑栓塞型是指包括心脏疾病(可产生心源性栓子)所引起的脑栓塞[12]。病史中反复的短暂脑缺血发作(TIA)或卒中以及其他部位栓塞,而且至少有一种心源性疾病或者有引起心源性栓子的原因。其他原因型:较为少见,包括感染性疾病、免疫性疾病、非免疫性血管病、血液的高凝状态、血液病、遗传性血管病以及吸毒等原因所致急性脑梗死。不明原因型是患者经过临床检验及影像学等检查仍未找出其发病原因的。
1.2 实验室检测患者于入院后清晨(24 h内)空腹12 h以上后抽取肘静脉血液5 ml,采用全自动生化分析仪及配套试剂测定血清中的谷丙转氨酶(ALT)、谷草转氨酶(AST)、血肌酐(CREA)、血尿素氮(BUN)、尿酸(UA)、三酰甘油(TG)、血清总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、血清游离三碘甲腺原氨酸(FT3)、血清游离甲状腺素(FT4)、促甲状腺激素(TSH)、血同型半胱氨酸(HCY)、活化部分凝血活酶时间(APTT)、血浆纤维蛋白原(FIB)、D-二聚体(DD)值,同时抽血采用酶联免疫吸附法检测Lp-PLA2水平,严格按照说明书要求进行操作。Lp-PLA2试剂盒由北京热景生物技术股份有限公司生产,产品批号20160103-20180203。
1.3 颈动脉斑块测量方法患者入院时即采用Philips EPIQ 5彩色多普勒超声仪检测其双侧颈总动脉、颈内动脉、颈外动脉及颈动脉分叉等部位的各个独立斑块的厚度。斑块为局限性回声结构(可不均匀或伴声影)突出管腔,并且厚度>1.3 mm。所有斑块厚度相加为该患者斑块总积分(Crouse积分)[13],对于颈动脉内膜厚度(IMT)正常或IMT增厚但无明显斑块形成的,不计算在内,并且测量最大的斑块厚度及斑块个数。
1.4 统计学方法所有的数据分析采用SPSS 19.0统计软件,计量资料用均数±标准差(±s)表示,采用单因素方差分析及t检验,计数资料采用例数(构成比)表示,组间比较采用χ2检验或校正χ2检验。使用Spearman进行相关性分析,P<0.05为差异有统计学意义。
2 结果
2.1 LAA组和SAO组患者一般临床资料比较两组患者在年龄、性别比、病史及入院时血压、血糖均无明显统计学差异(P>0.05,表1)。
表1 LAA组和SAO组患者一般临床资料比较(±s)
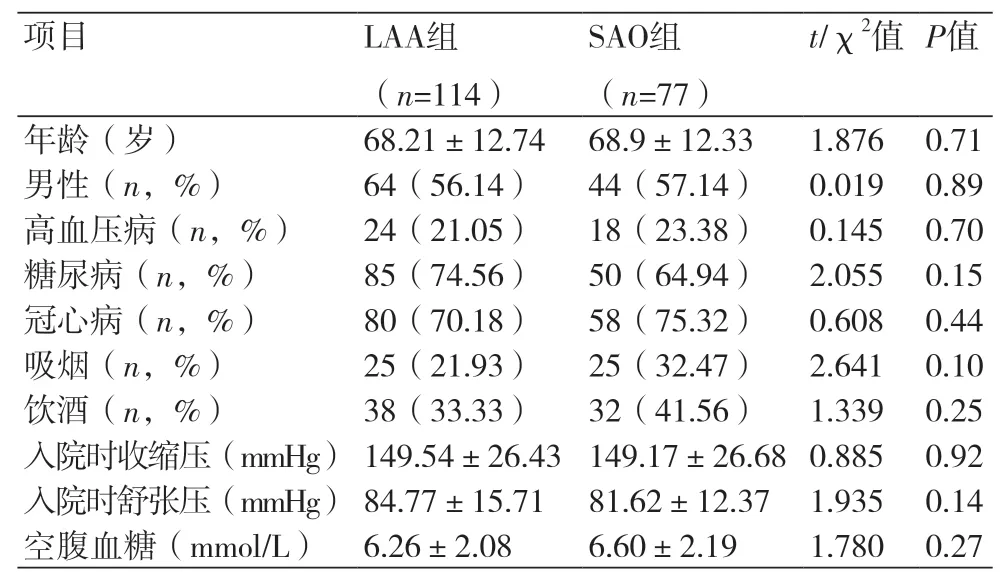
表1 LAA组和SAO组患者一般临床资料比较(±s)
项目 LAA组(n=114)SAO组(n=77)t/χ2值P值年龄(岁) 68.21±12.74 68.9±12.33 1.876 0.71男性(n,%) 64(56.14) 44(57.14)0.019 0.89高血压病(n,%) 24(21.05) 18(23.38)0.145 0.70糖尿病(n,%) 85(74.56) 50(64.94)2.055 0.15冠心病(n,%) 80(70.18) 58(75.32)0.608 0.44吸烟(n,%) 25(21.93) 25(32.47)2.641 0.10饮酒(n,%) 38(33.33) 32(41.56)1.339 0.25入院时收缩压(mmHg)149.54±26.43 149.17±26.68 0.885 0.92入院时舒张压(mmHg)84.77±15.71 81.62±12.37 1.935 0.14空腹血糖(mmol/L)6.26±2.08 6.60±2.19 1.780 0.27
2.2 LAA组和SAO组患者生化指标比较两组患者在肝肾功能、血脂、甲功、同型半胱氨酸、凝血功能上比较,差异均无统计学意义(P>0.05,表2)。
2.3 LAA组和SAO组患者Lp-PLA2及Crouse积分、最大斑块厚度和斑块数量比较LAA组患者Lp-PLA2水平明显高于SAO组,差异具有统计学意义(P<0.05);在由颈部血管超声基础上测得的Crouse积分、最大斑块厚度、斑块数量也明显高于SAO组,差异有统计学意义(P<0.05,表3)。
表2 LAA组和SAO组患者生化指标比较(±s)
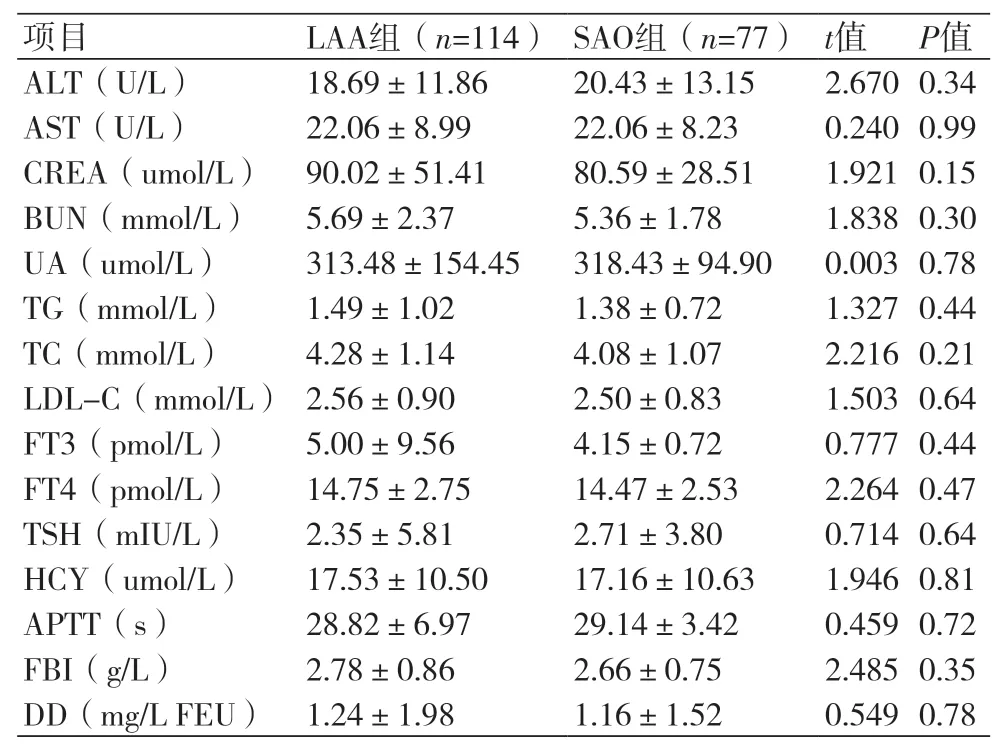
表2 LAA组和SAO组患者生化指标比较(±s)
注:ALT:谷丙转氨酶;AST:谷草转氨酶;CREA:肌酐;BUN:尿素氮;UA:尿酸;TG:三酰甘油;TC:总胆固醇;LDL-C:低密度脂蛋白胆固醇;FT3:游离三碘甲状腺原氨酸;FT4:血清游离甲状腺素;TSH:促甲状腺激素;HCY:同型半胱氨酸;APTT:活化部分凝血活酶时间;FBI:纤维蛋白原;DD:D-二聚体
项目 LAA组(n=114)SAO组(n=77)t值 P值ALT(U/L) 18.69±11.86 20.43±13.15 2.670 0.34 AST(U/L) 22.06±8.99 22.06±8.23 0.240 0.99 CREA(umol/L)90.02±51.41 80.59±28.51 1.921 0.15 BUN(mmol/L) 5.69±2.37 5.36±1.78 1.838 0.30 UA(umol/L) 313.48±154.45 318.43±94.90 0.003 0.78 TG(mmol/L) 1.49±1.02 1.38±0.72 1.327 0.44 TC(mmol/L) 4.28±1.14 4.08±1.07 2.216 0.21 LDL-C(mmol/L)2.56±0.90 2.50±0.83 1.503 0.64 FT3(pmol/L) 5.00±9.56 4.15±0.72 0.777 0.44 FT4(pmol/L) 14.75±2.75 14.47±2.53 2.264 0.47 TSH(mIU/L) 2.35±5.81 2.71±3.80 0.714 0.64 HCY(umol/L) 17.53±10.50 17.16±10.63 1.946 0.81 APTT(s) 28.82±6.97 29.14±3.42 0.459 0.72 FBI(g/L) 2.78±0.86 2.66±0.75 2.485 0.35 DD(mg/L FEU)1.24±1.98 1.16±1.52 0.549 0.78
表3 LAA组和SAO组患者Lp-PLA2及Crouse积分、最大斑块厚度和斑块数量比较(±s)
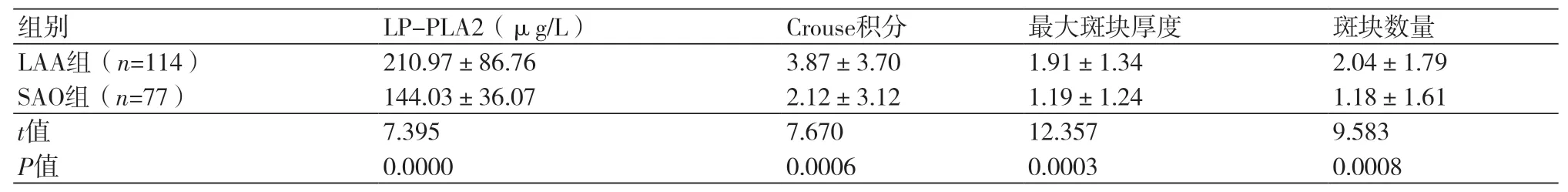
表3 LAA组和SAO组患者Lp-PLA2及Crouse积分、最大斑块厚度和斑块数量比较(±s)
组别 LP-PLA2(μg/L) Crouse积分 最大斑块厚度 斑块数量LAA组(n=114) 210.97±86.76 3.87±3.70 1.91±1.34 2.04±1.79 SAO组(n=77) 144.03±36.07 2.12±3.12 1.19±1.24 1.18±1.61 t值 7.395 7.670 12.357 9.583 P值 0.0000 0.0006 0.0003 0.0008
2.4 LAA组与SAO组Lp-PLA2与Crouse积分的相关性LAA组中,使用原始数据进行Spearman相关性分析,Lp-PLA2与Crouse积分正相关(r=0.385,P=0.000028,图1)。SAO组中,使用原始数据进行Spearman相关性分析,Lp-PLA2与Crouse积分无明显相关性(r=-1.00,P=0.389,图2)。
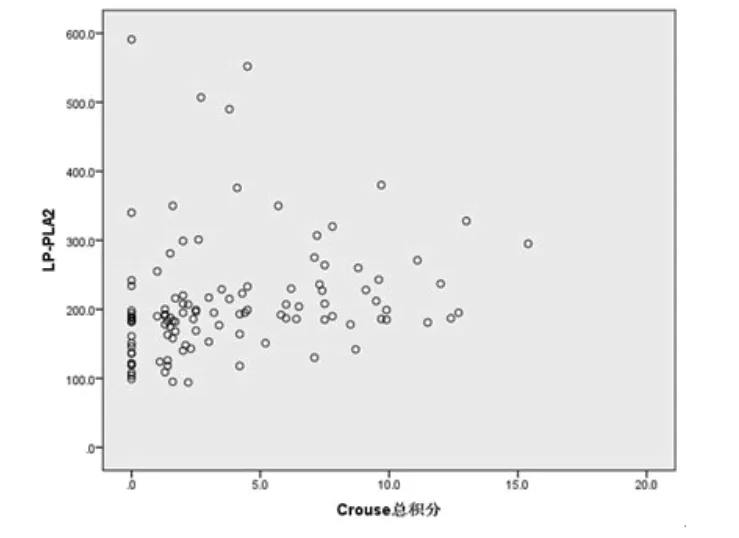
图1 LAA组Lp-PLA2水平与Crouse积分的相关性分析
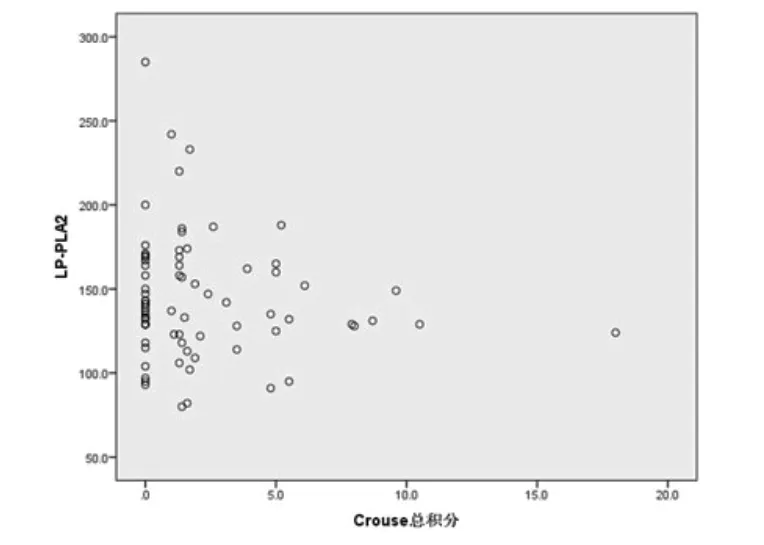
图2 SAO组Lp-PLA2水平与Crouse积分的相关性分析
3 讨论
大动脉粥样硬化型(LAA)和小动脉闭塞型(SAO)这两型占脑梗死的大多数[14,15],两者同属于脑血管病,虽然部分危险因素与现有的治疗方法上有相同点,但从临床表现和病理上还是有所差别,因此其病因上找寻不同点并进行针对性的治疗,可能会收到良好的治疗效果。从本研究上可以看出两型患者在年龄、性别比、病史、肝肾功、血脂、甲功、凝血功能上均无明显差异,但在基于斑块厚度和的Crouse积分、最大斑块厚度及斑块数量上LAA组和SAO组的差异具有统计学意义,LAA组明显高于SAO组。对于Lp-PLA2,LAA组明显高于SAO组,差异有统计学意义。Lp-PLA2是动脉炎症反应的重要参与者,有文献报道与心脏病[16,17]、脑血管病[18-20]、糖尿病肾病[21]、哮喘[22]等有关,其所介导的细胞因子可促进基质金属蛋白酶在颈动脉粥样硬化斑块中的表达,这种酶增加斑块的易损性,可将斑块中的纤维帽和胶原基质等成分降解,导致斑块破裂,内出血增加。这种易损性增加缺血性血管病的发生[23,24]。在本研究的相关性分析中,LAA组Lp-PLA2与Crouse积分有相关性,SAO组则无此相关性,进一步证明Lp-PLA2与大动脉粥样硬化斑块的关系。
从分型上入手研究缺血性脑卒中,有利于发现其不同病因及机制,为针对性的个体化治疗提供依据。从本研究中的数据上来看,对于LAA型患者如果使用Lp-PLA2抑制剂,可能会取得更好的疗效,当然还需要大量的药物临床研究试验证实包括对于梗死分型属于SAO型但伴有大动脉粥样硬化的患者是否需要Lp-PLA2抑制剂治疗的问题。目前葛兰素史克公司开发的Lp-PLA2抑制剂darapladib,虽然有2个大型Ⅲ期药物临床试验阴性,但并不意味着Lp-PLA2抑制剂的研究就此停止,研究者应当更多的关注药物有效性与病因分型、病理、药物敏感基因等问题[25]。希望更多的Lp-PLA2抑制剂逐渐研发进入临床试验走向市场,为脑血管病的个体治疗提供利器。
综上所述,LAA型患者的Lp-PLA2与颈动脉斑块之间有明显的相关性,为LAA型患者降低Lp-PLA2进行针对性的治疗提供临床依据。
