宁夏‘灵武长枣’采后病原真菌的分离与鉴定*
2020-12-15任苗苗闫思远李嘉泓顾沛雯
任苗苗,闫思远,李嘉泓,杜 娟,马 玲,顾沛雯
(宁夏大学农学院,银川 750021)
‘灵武长枣’(Ziziphus jujubecv.Lingwu)为鼠李科枣属植物,是宁夏回族自治区最具特色的地方枣品种。2006年被国家农业部批准为国家地理标志产品[1],2019年入选中国农业品牌目录产品[2]。近年来,随着宁夏种植业结构的调整,‘灵武长枣’产业规模迅速发展壮大,已取得良好的经济效益[3]。然而,由于‘灵武长枣’以鲜食为主,皮薄、多汁,鲜销期短,采后贮运不当,腐败现象严重。其中,由真菌侵染引起的果实腐烂可占采后损失的30%~40%[1],严重制约了宁夏‘灵武长枣’产业化发展。
病原真菌侵染是导致枣采后腐烂的重要因素,但不同地区、品种的枣采后病原真菌的种类有所不同。刘春琴等[4]报道河北地区‘金丝小枣’采后腐烂的主要病原真菌有性阶段是囊孢壳菌(Physalospora obtuse)、无性世代为梭壳孢菌(Fusicoccumsp.);孙蕾等[5]从山东地区‘冬枣’腐烂组织中主要分离出根菌索菌(RhizomorphaRoth.ex Fr.)和交链孢霉属(Alternariasp.)2种病原真菌;雷春军等[6]发现导致新疆阿克苏地区‘骏枣’采后腐烂的优势病原真菌为交链格孢(A.alternata)、细极链格孢(A.tenuissima)和根霉菌(Rhizopus stolonifer)。但是目前国内对宁夏地区‘灵武长枣’采后病原真菌的研究报道相对较少,2007年甘瑾等[7]采用形态学的方法鉴定‘灵武长枣’采后病原真菌为微孢毛霉(Mucor microsporus)、粉红聚端孢(Trichoderma roseum)、交链格孢(A.alternata)和青霉属(Penicilliumsp.);2012年,任玉锋等[8]证实皮落青霉(Penicillium crustosum)也是导致‘灵武长枣’采后腐烂的病原真菌。
本研究以宁夏地区‘灵武长枣’为研究对象,通过形态学与分子生物学相结合的方法,对‘灵武长枣’采后病原真菌进行了分离鉴定,明确了宁夏地区‘灵武长枣’采后病原真菌类型,以期为宁夏地区‘灵武长枣’的采后保鲜提供理论依据。
1 材料与方法
1.1 试验材料
2018年9—11月,从宁夏银川市和灵武市采摘大小均匀、无病虫害和机械损伤的‘灵武长枣’,样品共90份。当天用牛皮纸包好带回实验室,自然条件(25 ℃)下贮藏,待出现典型腐烂症状后进行病原真菌的分离鉴定。
1.2 主要仪器、试剂和培养基
正置荧光显微镜(Olympus BX53,日本),梯度PCR仪(Bio-Rad T100,美国),电泳仪(DYY-C6,北京),凝胶成像系统(Azure c200,美国),霉菌培养箱(MJX-100B-Z,上海),洁净工作台(SW-CJ-1F,苏州)。
真菌DNA提取试剂盒(BioFlux,美国),DL2000 DNA Marker、2×EasyTaq PCR Super Mix、RNaseA和GelStain染液(TIANGEN,北京),50×TAE缓冲液、RNase-Free Water(Solarbio,北京)。
马铃薯葡萄糖琼脂(Potato dextrose agar,PDA)培养基(陆桥,北京)。
1.3 病原真菌的分离和纯化
病原真菌分离采用组织分离法[9]。在‘灵武长枣’病果中病健交界处切取大约5 mm×5 mm×5 mm大小的组织块,置于75%(v/v)的酒精中30 s,消除表面起泡,迅速将组织块用无菌滤纸吸取表面酒精,移入5%(m/v)的次氯酸钠溶液中浸泡3 min,再用无菌水清洗3次后,用灭菌滤纸吸干组织块表面水分,用无菌刀切除组织块表面部分,取大约2 mm×2 mm×2 mm植入PDA培养基中,25 ℃黑暗培养。当菌落直径生长至1 cm时,用无菌接种针挑取不同菌丝尖端分别植入新的PDA培养基平皿内,继续培养。重复上述操作2~3次,分出单一菌落即可作为纯化菌种移入试管,纯化菌种4 ℃保存备用。
1.4 病原真菌的致病性检测
采用阳秀莲等[10]菌悬液有伤接种方法进行致病性检测,略作修改。病原真菌菌悬液的配制:将分离纯化的病原真菌接种至PDA培养基上,25 ℃黑暗培养5 d,进行菌种活化。加入2 mL无菌水冲洗PDA培养平板,收集菌丝和孢子混液,用双层无菌纱布过滤混液,得到病原真菌菌悬液。用血球板计数,将病原真菌菌悬液稀释至1×105cfu/mL,接种备用。有伤接种:取健康‘灵武长枣’果实,用无菌水冲洗数次后,用5%(m/v)次氯酸钠溶液消毒3 min,无菌水冲洗3次,无菌吸水纸吸干水分。用无菌接种针轻轻刺伤果皮制造伤口(伤口集中),取制备好的菌悬液20 μL滴加到刺伤部位。将接种后的‘灵武长枣’果实放入无菌培养皿内,置于智能人工气候箱25 ℃、相对湿度90%条件下培养7 d。每处理重复3次,设无菌水为对照。记录发病情况,通过致病性确认后的病原真菌进行再次分离,并与最初接种的病原真菌进行比较。
1.5 病原真菌的形态学鉴定
将具有致病性的病原真菌接种于PDA平板上,置于25 ℃霉菌培养箱培养4~10 d,观察记录菌落特征(菌落形状、颜色和质地等),待其产孢后,挑取少量菌丝进行镜检和拍照(分生孢子梗和分生孢子形态)。参考《真菌鉴定手册》[11]和《中国真菌志》[12],鉴定病原真菌种类。
1.6 病原真菌的分子生物学鉴定
1.6.1病原真菌DNA的提取
将纯化后的病原真菌在PDA培养基上活化培养4~10 d后,用无菌的载玻片轻轻在PDA培养基表面上刮取适量新鲜菌丝约0.05 g进行DNA的提取,其方法参照Biospin真菌基因组DNA提取试剂盒说明。
1.6.2病原真菌rDNA-ITS序列扩增
以纯化后的病原真菌总DNA为模板,利用真菌rDNA-ITS通用引物序列ITS1/ITS4 (5′-TCCGT AGGTGAACCTGCGC-3′)/(5′-TCCTCCGCTTATTG ATATGC-3′)进行扩增和测序。PCR扩增体系(25 μL):2×PCR buffer 12.5 μL,10 μmol/L引物各1 μL,DNA模板1 μL,ddH2O 9.5 μL。PCR扩增条件:94 ℃预变性5 min;94 ℃变性50 s,51 ℃退火50 s,72 ℃延伸2 min,34个循环;72 ℃再延伸10 min。4 ℃保存。扩增产物于1.0%琼脂糖凝胶电泳中检测,凝胶成像系统观察拍照。PCR扩增产物回收后送至北京六合华大基因科技有限公司测序。
1.6.3病原真菌系统发育树的构建
将病原真菌菌株测序所得序列在GenBank数据库中进行BLAST比对,筛选与病原真菌ITS序列同源性高的菌株序列,利用DNAMAN 6.0.3.48软件中邻接法(Neighbor-Joining methods,NJ)构建系统发育树,确定病原真菌菌株的分类地位。
2 结果与分析
2.1 ‘灵武长枣’贮藏期病害症状及病原真菌的分离结果
‘灵武长枣’贮藏期间表现出的病害症状主要有5种:①病果初期果面形成边缘明显、略凹陷的黑色斑点,随着侵染斑逐渐扩大,病斑上长出墨绿色或黑褐色霉状物,后期形成较大的腐烂区(图版2a-B)。②感病初期果面出现水渍状的斑点,果面轻微凹陷,后期病斑下果肉迅速软化腐烂,但无水渍溢出,且果实表皮无破损,不产生霉层(图版2a-C)。③果实发病部位初期形成暗褐色斑点,果实轻微凹陷,后期病斑扩展,长出白色霉层(图版2a-D)。④初期果面上出现不规则水渍斑,中后期病斑扩展迅速,果面密被灰褐色团粒状柔软霉层,严重时可导致整个果实腐烂(图版2a-E)。⑤初期果面上发病部位长有白色菌丝,后期蔓延呈白色棉絮状,其上密生黑色小颗粒,病果迅速软化散发出酒糟味(图版2a-F)。
对自然条件下贮藏的‘灵武长枣’腐烂组织进行分离纯化,共得到75株真菌菌株。根据其培养形状及菌落特征初步划分为9种类型。如表1所示,Ⅰ类真菌分离最多(31株),所占比率为分离菌株总数的41.3%;其次是Ⅵ类(11株)和Ⅸ类(8株)真菌,分别占总分离菌株的14.7%和10.7%。
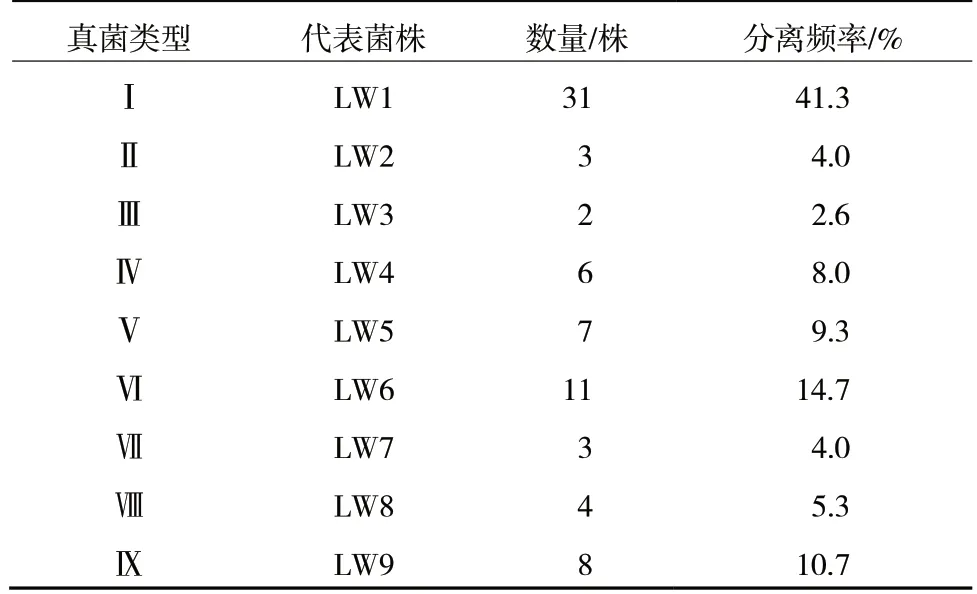
表1 从‘灵武长枣’腐烂果实中分离的真菌菌株
2.2 病原真菌的致病性检测
将从‘灵武长枣’腐烂组织中分离的9类纯化代表菌株(LW1~LW9)依照柯赫氏法则重新接种于健康‘灵武长枣’,从致病的‘灵武长枣’果实腐烂组织再次分离病原真菌,在PDA培养基上纯化培养后,与最初的接种菌进行比较。结果显示,菌株LW1、LW4、LW5、LW6和LW9均会引起‘灵武长枣’果实腐烂,与自然条件下引起的腐烂症状相似,再次分离得到的菌株与原接种的病原真菌菌落形态一致,而菌株LW2、LW3、LW7、LW8及对照接种后并未引起‘灵武长枣’果实腐烂,表明以LW1、LW4、LW5、LW6和LW9为代表的5类真菌是造成‘灵武长枣’果实腐烂的致病真菌。其中,LW1真菌菌丝附着处会造成果肉软化、凹陷和变褐,病果表面出现黑色霉状物产生大量分生孢子,致病较快且效果明显(图版2b-A);LW4真菌侵染后造成病斑处果肉凹陷腐烂,后期病斑蔓延,果肉出现一定程度的水渍化(图版2b-B);LW5真菌致病中心呈红褐色,其上着生白色菌丝,对‘灵武长枣’表皮的侵染性较强,造成果实凹陷(图版2b-C);LW6真菌接种后‘灵武长枣’表面出现水渍状斑点,随着病菌侵染,果皮呈灰白色,后期果面上形成厚厚的灰褐色霉层(图版2b-D);LW9真菌侵染后伤口处出现白色棉絮状菌丝,在菌落覆盖下方及菌落周围的果实组织腐坏严重,致病性较强(图版2b-E)。
2.3 病原真菌形态学鉴定
PDA培养基上生长的纯化菌株LW1菌落近似圆形,中央墨绿色,边缘白色,菌丝致密呈棉絮状(图版2b-F);分生孢子梗直立、分隔;分生孢子呈倒棍棒形或椭圆形,单孢 9.82~13.85 μm×19.77~28.80 μm,具有1~5个横膈膜,分隔处略有缢缩(图版2b-K)。
LW4菌落生长较慢,边缘不规则,初期污白色,后期颜色加深变黑,菌丝呈根状,黏稠,不易挑取,(图版2b-G);分生孢子椭圆形,显微镜下呈单细胞个体,9.25~12.05 μm×10.97~14.38 μm(图版2b-L)。
LW5菌落边缘不整齐,初期呈白色丝绒状,后变为褐色至黑褐色,约15 d后开始产生黑色菌核(图版2b-H);分生孢子呈球形或长椭圆形,无色,单细胞2.65~5.96 μm×7.86~11.30 μm(图版2b-M)。
LW6菌落生长较快,初期呈灰白色,产孢后呈灰褐色,菌丝体繁茂,绒毛状(图版2b-I);分生孢子梗丛生,顶端着生大量分生孢子,形似葡萄穗状;分生孢子呈球形或卵圆形,无隔,单孢7.18~9.54 μm×13.01~14.56 μm,透明或呈淡褐色(图版2b-N)。
LW9菌落无定形,气生菌丝,菌丝最初为白色棉絮状,后期顶端产生黑色小颗粒(图版2b-J);菌丝发达、有分枝和假根;孢子囊球形或近球形,深褐色,孢囊孢子呈球形或近似球形,大小不等(图版2b-O)。
依据病原菌培养形态特征及镜检观察结果,参考《真菌鉴定手册》和《中国真菌志》,初步鉴定结果为:菌株LW1为链格孢属(Alternaria),LW4为短梗霉属(Aureobasidium),LW5为派伦霉属(Peyronellaea),LW6为葡萄孢属(Botrytis),LW9为根霉属(Rhizopus)。
2.4 病原真菌的分子生物学鉴定
采用真菌rDNA-ITS序列通用引物(ITS1和ITS4)对菌株LW1、LW4、LW5、LW6和LW9进行分子生物学鉴定。以5株病原真菌的总DNA为模板进行PCR扩增检验,获得578、579、549、625、554 bp的基因片段(图1),将PCR产物测序结果与NCBI中相似性高的菌株rDNA-ITS基因序列进行同源性比对,构建系统发育树(图 2)。按rDNA-ITS基因序列相似性大于97%的菌株归于同一个种的规则,菌株LW1(登录号:MN073201)与链格孢属的A.alternata(登录号:MF167641)亲缘关系最近,同源率为99%,鉴定为交链格孢(A.alternata);菌株LW4(登录号:MN075511)与短梗霉属的Aureobasidium pullulans(登录号:MK772062)亲缘关系最近,同源率达100%,鉴定为出芽短梗霉(A.pullulans);菌株LW5(登录号:MN075513)与派伦霉属的Peyronellaea glomerata(登录号:KT192373)亲缘关系最近,同源率为99%,鉴定为球派伦霉(P.glomerata);菌株LW6(登录号:MN077159)与葡萄孢属的Botrytis cinerea(登录号:MF467899)和Botrytis fabae(登录号:KC213772)亲缘关系最近,同源率为98%,结合菌株LW6形态学特征鉴定为灰葡萄孢(B.cinerea);菌株LW9(登录号:MN075516)与根霉菌属的Rhizopus oryzae(登录号:MH865593、MH854585和MH854584)亲缘关系最近,同源率为99%,鉴定为米根霉(R.oryzae)。

图1 病原真菌rDNA-ITS基因序列的PCR扩增
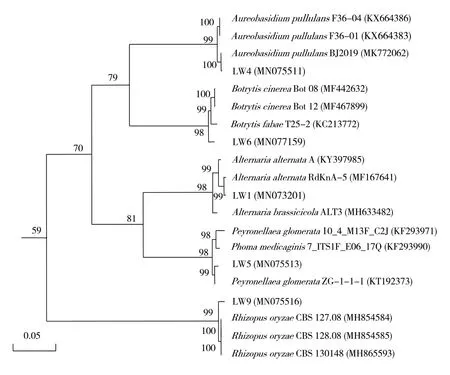
图2 病原真菌LW1、LW4、LW5、LW6和 LW9 rDNA-ITS序列系统发育树
3 结论与讨论
‘灵武长枣’属于呼吸跃变型果实[13],采后易失水皱缩、软化、褐变和腐烂,低温(15 ℃)环境下货架期仅10~15 d[14],保鲜期短成为‘灵武长枣’产业发展亟需解决的重要难题。本研究从‘灵武长枣’腐烂组织中共分离出9类真菌菌株,通过致病性测定,确定有5类真菌可以引起‘灵武长枣’腐烂,经形态学特征和分子生物学分析,分别鉴定为交链格孢(A.alternata)、出芽短梗霉(A.pullulans)、灰葡萄孢(B.cinerea)、米根霉(R.oryzae)和球派伦霉(P.glomerata)。
高芬等[15]认为山西‘赞皇大枣’黑腐病是由细极链格孢(A.tenuissima)引起的,何丽等[16]认为新疆红枣黑腐病是由交链格孢(A.alternata)引起的,甘瑾等[7]发现交链格孢(A.alternata)也可以导致‘灵武长枣’采后腐烂。本研究根据贮藏期‘灵武长枣’腐烂组织病原菌分离频率(41.3%)及致病性检验,发现交链格孢(A.alternata)是引起‘灵武长枣’黑腐病的主要病原真菌,可导致枣果面凹陷,果皮黑腐,密生黑褐色霉层,果肉软化、变褐等症状,造成果品腐烂变质。枣贮藏期黑腐病病原不一致,可能是由于枣果产地、品种、贮藏条件及病样采集时病害发展进程不同,造成黑腐病病原种类存在一定的差异。灰葡萄孢(B.cinerea)和米根霉(R.oryzae)是常见的果蔬致腐微生物,寄主范围广泛,在有伤和无伤条件下均可侵入果实组织,导致葡萄[17]、红枣[18]和番茄[19]等多种果蔬采后腐烂。李青云[20]研究发现灰葡萄孢(B.cinerea)是引起北疆‘冬枣’采后腐烂的主要病原真菌;白剑宇等[18]对新疆红枣软腐病病原菌进行鉴定,明确了致病真菌为米根霉(R.oryzae)。本研究得到了类似的结论,灰葡萄孢(B.cinerea)和米根霉(R.oryzae)也是导致‘灵武长枣’果实采后腐烂的重要致病真菌。
此外,本研究还首次发现出芽短梗霉(A.pullulans)和球派伦霉(P.glomerata)是‘灵武长枣’采后病原真菌,通过有伤接种,‘灵武长枣’被2种病原真菌感染后,果面出现凹陷病斑或产生白色霉层,最终导致全果腐烂,可见这2种病原真菌具有较强的致病性。Nallathambi等[21]发现出芽短梗霉(A.pullulans)是引起‘台湾青枣’腐烂的主要病原菌,侵染后可导致枣果面出现凹陷病斑并产生黑色霉层等症状;萨吉达木·艾则孜等[22]研究证明,新疆红枣出现畸果症状和果面出现褐色斑点现象是由球派伦霉(P.glomerata)侵染引起的。出芽短梗霉(A.pullulans)和球派伦霉(P.glomerata)对不同枣的侵染症状存在较大的差异,这可能也与枣果产地、品种和贮藏条件等相关,但有关2种病原真菌的侵染致腐过程及致腐机理等方面还尚不明确,仍需进一步研究。
本研究明确了引起‘灵武长枣’采后腐烂变质的主要病原真菌为交链格孢(A.alternata)、灰葡萄孢(B.cinerea)、米根霉(R.oryzae)、出芽短梗霉(A.pullulans)和球派伦霉(P.glomerata),这将为控制‘灵武长枣’采后腐烂和提出针对性的防腐贮藏手段提供借鉴和思路。已有研究发现,低温、减压和臭氧(-2 ℃、40.5 kPa和O3mg/m3)处理不仅能够减缓‘冬枣’淀粉和抗坏血酸降解速度,还具有抑制交链格孢孢子繁殖和降低枣果腐烂的作用[23]。此外,通过对长枣喷施不同浓度隐球酵母(Cryptococcussp.)菌悬液,能够诱导长枣抗病性,大大降低了由根霉菌引起的烂果率[24]。‘冬枣’采后,利用丁香精油和丁香精油-壳聚糖复合物处理枣果,可以降低‘冬枣’贮藏期灰霉病感染率[25]。因此,结合现有的广谱杀菌措施,针对‘灵武长枣’采后病原真菌筛选有效的选择性杀菌剂,可以为预防‘灵武长枣’采后致腐病害和延长货架期提供技术支撑。
