川陈皮素对人前列腺癌DU145 细胞生长的抑制作用及其机制
2020-12-15姜华茂
张 阳, 姜华茂
(锦州医科大学附属第一医院泌尿外科,辽宁 锦州 121000)
随着病情的发展,绝大多数前列腺癌患者,最终会进入 “去势抵抗” 阶段,严重影响患者的生存质量和生存时间。目前,对去势抵抗性前列腺癌(castrate-resistant prostate cancer, CRPC) 尚 缺 乏规范有效的治疗方法,因此迫切需要寻找有效的治疗方法和药物来延缓CRPC 的进展。 川陈皮素(5, 6, 7, 8, 3', 4'-hexameth-oxy flavone) 是一种多甲氧基黄酮类化合物,提取于陈皮[1],具有抗肿瘤[2]、抑制炎症介质产生[3]和抗神经退行性病变[4]等 多 种 药 理 作 用。已 有 研 究[5-7]表 明:川 陈皮素在神经胶质瘤、肺癌和肝癌等细胞中具有一定程度的抗肿瘤作用,但川陈皮素在雄激素非依赖性前列腺癌DU145 细胞中的作用及其机制尚未明确。在前列腺癌的发生发展过程中,MAPK 通路是非常关键的信号转导通路。MAPK 通路与细胞凋亡有密切关联[8], 其中磷酸化c-Jun 氨基末端激酶(phosphorylated c-Jun N-terminal kinase, p-JNK)和磷酸化P38 丝裂原活化蛋白酶(phosphorylated P38 mitogen activated protease, p-P38) 可以促进细胞凋亡[9], 而磷酸化细胞外调节蛋白激酶(phosphorylated extracellular regulated protein kinase,p-ERK) 可以抑制细胞凋亡[10]。本研究通过体外培养人前列腺癌DU145 细胞,并采用不同浓度川陈皮素处理DU145 细胞,研究其对前列腺癌DU145 细胞生长的抑制作用,并探讨其作用机制,为去势抵抗性前列腺癌寻找新的治疗药物并提供实验依据。
1 材料与方法
1.1细胞、药物、主要试剂和仪器人前列腺癌DU145 细胞购自沈阳百思生物有限公司。川陈皮素(纯度≥98%,批号H25A8K42328) 购自上海源叶生物科技有限公司。RPMI-1640 培养基和胰酶购自美国Gibco 公司,胎牛血清、超敏ECL 化学发光试剂盒、BCA 蛋白定量试剂盒和凝胶快速制备试剂盒均购自上海碧云天生物科技有限公司,MTT 粉末和脱脂牛奶购自北京索莱宝科技有限公司, DMSO 购 自 美 国Sigma 公 司, 一 抗JNK 、p-JNK、P38、p-P38、ERK、p-ERK 和GAPDH 及其对应的二抗均购自北京博奥森生物科技有限公司,Transwell 小室和凋亡试剂盒购自沈阳万类生物科技有限公司,Matrigel 基质胶购自美国BD 公司, 全蛋白提取试剂盒购自上海BestBio 公司。CO2培养箱购自上海Blue Pard 仪器有限公司,蛋白电泳及转膜装置购自美国Bio-Rad 公司,全波长酶标仪购自瑞士Tecan 贸易股份有限公司,流式细胞仪购自赛默飞世尔科技(中国) 有限公司。
1.2细胞培养采用含10% 胎牛血清的RPMI-1640 完全培养基,于细胞培养箱(37 ℃、5% CO2)中培养人前列腺癌DU145 细胞。
1.3 MTT法检测各组人前列腺癌DU145细胞增殖活性取对数生长期人前列腺癌DU145 细胞100 μL (5×103μL-1) 接种于96 板孔中在细胞培养箱中(37 ℃、5% CO2) 培养24 h,待细胞完全贴壁后, 分别加入含有不同浓度(0、 0.8、 1.6、3.2、 6.4、 12.8、 25.6 和51.2 μmol·L-1) 川 陈 皮素的完全培养基作为不同浓度川陈皮素组,并设置对照组,对照组为含10% 胎牛血清的RPMI-1640完全培养基。在培养箱中继续孵育24、48 和72 h,向培养基中加入MTT 溶液, 至MTT 终浓度为5 g·L-1,37 ℃继续培养4 h,待MTT 被细胞摄取后,弃去MTT 液,向各孔加入150 μL DMSO,在酶联反应检测仪上检测各组细胞在570 nm 波长处的吸光度(A) 值,以细胞增殖活性表示川陈皮素对人前列腺癌DU145 细胞增殖的影响。细胞增殖活性=药物组A 值/对照组A 值×100%。
1.4划痕实验检测各组人前列腺癌DU145细胞迁移能力取对数生长期人前列腺癌DU145 细胞接种于6 孔板中,每孔加入1.0×105个细胞,待细胞完全贴壁后,在孔中央横轴方向采用200 μL 枪头划出1 条划痕后分别加入不同浓度(0、 12.8 和25.6 μmol·L-1) 川陈皮素,倒置显微镜观察划痕状态拍照后放入培养箱中继续培养, 分别于6、12、24 和48 h 取样,倒置显微镜观察各组细胞的划痕状态。以细胞划痕愈合率代表川陈皮素对人前列腺癌DU145 细胞迁移能力的影响。细胞划痕愈合率= (初始细胞划痕宽度- 实际细胞划痕宽度) /初始细胞划痕宽度×100%。
1.5 Transwell法检测各组人前列腺癌DU145细胞侵袭能力在24-Transwell 小室的上室均匀涂布1 g·L-1Matrigel 基质胶,37℃下放置4 h,取对数生长期DU145 细胞, 消化后稀释密度为1×105mL-1细 胞 悬 液 加 入24-Transwell 小 室 的 上室,随机分为对照组、12.8 μmol·L-1川陈皮素组和25.6 μmol·L-1川 陈 皮 素 组, 24-Transwell 小 室的下室加入含10% 胎牛血清的完全培养基作为趋化因子,置于37 ℃和5% CO2培养箱孵育48 h。取出上室,采用0.1% 结晶紫染色并清除未侵袭的细胞,然后对侵袭的细胞进行拍照,采用ImageJ 软件进行图像分析。以相对侵袭细胞数表示川陈皮素对人前列腺癌DU145 细胞侵袭能力的影响。
1.6流式细胞术检测各组人前列腺癌DU145细胞凋亡率对照组、 12.8 μmol·L-1川陈皮素组和25.6 μmol·L-1川陈皮素组人前列腺癌DU145 细胞培养48 h 后采用胰蛋白酶消化后PBS 漂洗2 次,并进行细胞计数, 离心收集5×105个细胞, 加入500 μL Binding buffer 重悬细胞,加入5 μL APC 混匀后,加入10 μL Propidium Iodide 混匀,室温避光反应5~15 min,1 h 内采用流式细胞术检测细胞凋亡率。细胞凋亡率= (早期凋亡细胞数+晚期凋亡细胞数) /细胞总数×100%。
1.7 Western blotting法检测各组细胞中p-JNK、p-P38和p-ERK蛋白表达水平人前列腺癌DU145 细胞经川陈皮素作用48 h 后,采用胰酶消化收集细胞,PBS 洗涤2 次,加入细胞裂解液,冰上裂解30 min,BCA 法测定蛋白质浓度。每孔按10 μg 蛋白样品上样, 12% SDS-PAGE 分离蛋白,80 V 恒压湿转30 min 后转110 V 恒压湿转60 min,300 mA 恒流转膜90 min,5% 脱脂牛奶封闭2 h , 然 后 分 别 用p-JNK (1 ∶500)、 p-P38(1 ∶500)、p-ERK (1∶500) 一抗4℃摇床孵育过夜12 h, HRP 标 记 的 二 抗(1 ∶5 000) 室 温 孵育2 h,ECL 显影液显影,凝胶成像系统拍照并采用Image J 软件进行图像分析,以目的蛋白条带灰度值与内参蛋白(GAPDH) 条带灰度值的比值作为目的蛋白表达水平。
1.8统计学分析采用GraphPad Prism 6.0 统计软件进行统计学分析。各组细胞增殖活性、划痕愈合率、侵袭细胞数、细胞凋亡率和细胞中p-JNK、p-P38 及p-ERK 蛋白表达水平均符合正态分布,以x±s表示,多组间样本均数比较采用单因素方差分析,两组间比较采用SNK-q检验。 检验水准α =0.05。
2 结 果
2.1各组人前列腺癌DU145细胞增殖活性0.8、1.6、 3.2、 6.4、 12.8、 25.6 和51.2 μmol·L-1川陈皮素处理人前列腺癌DU145 细胞24、48 和72 h后,人前列腺癌DU145 细胞增殖活性随着药物浓度的加大而降低,呈现时间和浓度依赖性。作用48 h 后,川陈皮素对人前列腺癌DU145 细胞的半数抑制浓度(inhibitory concentration 50, IC50) 约为51.2 μmol·L-1,因此以下实验用药浓度不超过51.2 μmol·L-1, 后 续 实 验 用 药 浓 度 选 择25.6 和12.8 μmol·L-1。见图1。
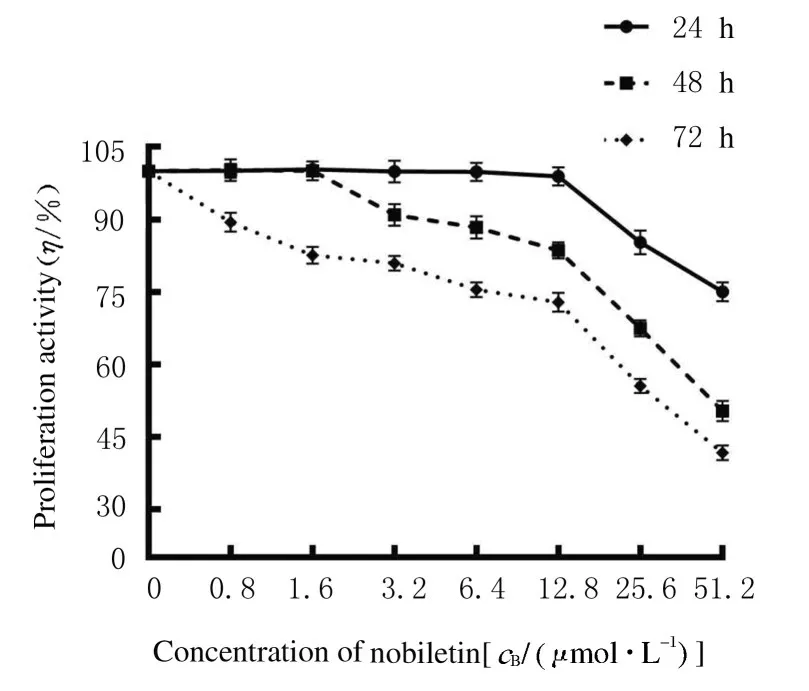
图1 MTT 法检测各组人前列腺癌DU145 细胞增殖活性Fig.1 Proliferation activities of human prostate cancer DU145 cells in various groups detected by MTT method
2.2各组人前列腺癌DU145细胞迁移形态表现和划痕愈合率处理人前列腺癌DU145 细胞6、12、24 和48 h 后,12.8 和25.6 μmol·L-1川陈皮素组人前列腺癌DU145 细胞划痕愈合率较对照组明显降低(P<0.01),并且细胞划痕愈合率随着药物浓度的增多而降低,呈现浓度依赖性。各组人前列腺癌DU145 细胞迁移形态表现见图2 (插页八),各组胞划痕愈合率见图3。
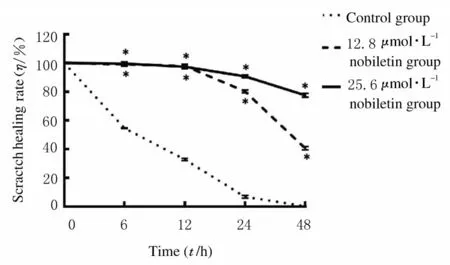
图3 各组人前列腺癌DU145 细胞划痕愈合率Fig.3 Scratch healing rates of human prostate cancer DU145 cells in various groups
2.3各组人前列腺癌DU145细胞侵袭细胞数处理48 h 后, 12.8 和25.6 μmol·L-1川陈皮素组人前列腺癌DU145 细胞的侵袭细胞数较对照组明显降低(P<0.01),且其侵袭细胞数随着药物浓度的增加而降低。见图4 (插页八) 和图5。
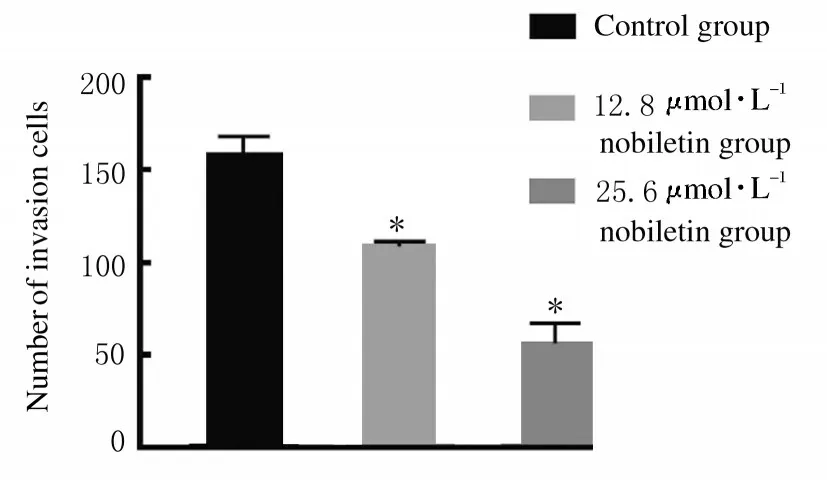
图5 各组人前列腺癌DU145 细胞的侵袭细胞数Fig.5 Number of invasion cells of human prostate cancer DU145 cells in various groups
2.4各组人前列腺癌DU145细胞凋亡率处理48 h 后,12.8 和25.6 μmol·L-1川陈皮素组人前列腺癌DU145 细胞凋亡率较对照组明显升高(P<0.01),并且细胞凋亡率随着药物浓度的增加而增加。见图6 和图7。
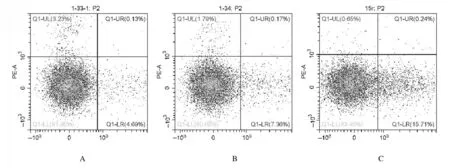
图6 流式细胞术检测各组人前列腺癌DU145 细胞凋亡率Fig.6 Apoptotic rates of human prostate cancer DU145 cells in various groups detected by flow cytometry
2.5各组人前列腺癌DU145细胞中p-JNK、p-P38和p-ERK蛋白表达水平作用48 h 后,与对照组比较,12.8 和25.6 μmol·L-1川陈皮素组人前腺癌DU145 细胞中p-JNK 和p-P38 蛋白表达水平明显升高(P<0.01), p-ERK 蛋白表达水平明显降低(P<0.01)。见图8 和图9。
3 讨 论
前列腺癌是美国男性中最常见的恶性肿瘤[11]。但是在发展中国家,这类癌症的发病率也呈逐年升高[12]。这可能与人均寿命的延长、饮食结构的改变和诊断技术的不断提高有密切关联。目前,早期前列腺癌应用根治性手术或根治性放疗均可以有效控制其发展[13-14]。大部分局部进展期前列腺癌和转移性前列腺癌一般选择雄激素去势治疗为主的姑息性治疗[15]。绝大多数前列腺癌患者经过手术或者药物去势治疗之后,在一定时间内,肿瘤生长均能得到一定程度的抑制。但是随着病情的进展,最终会进入 “去势抵抗” 阶段[16]。而目前针对去势抵抗性前列腺癌, 尚缺少统一规范的治疗方法[17]。一般可选择的方法有化疗、 免疫治疗和靶向治疗[18]。这3 种治疗方式价格昂贵,但是疗效却不是十分明显,而且化疗的不良反应也较多,患者依从性差。因此,迫切需要寻找针对去势抵抗性前列腺癌治疗的新方法。
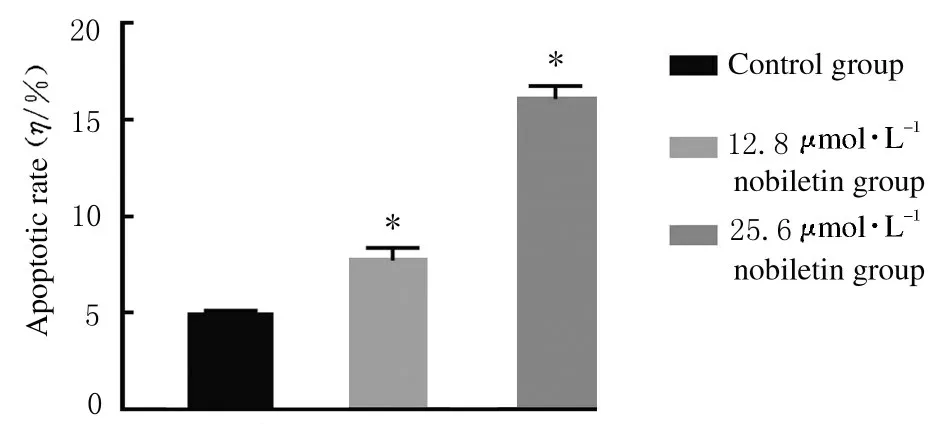
图7 各组人前列腺癌DU145 细胞凋亡率Fig.7 Apoptotic rates of human prostate cancer DU145 cells in various groups
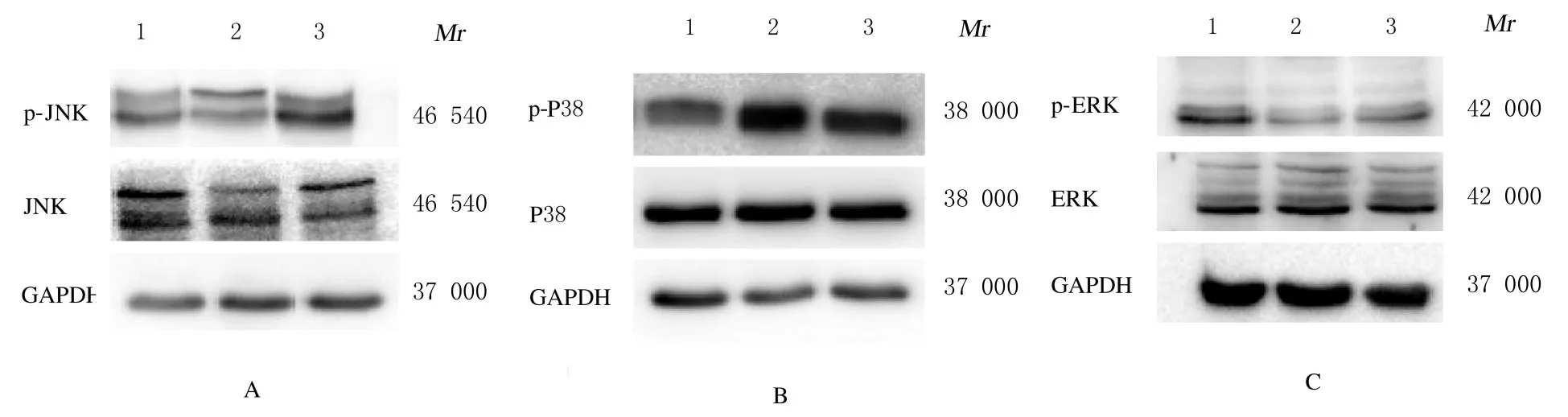
图8 Western blotting 法检测各组人前列腺癌DU145 细胞中p-JNK、p-P38 和p-ERK 蛋白表达电泳图Fig.8 Electrophoregram of expressions of p-JNK,p-P38, and p-ERK proteins in human prostate cancer DU145 cells in various groups detected by Western blotting method
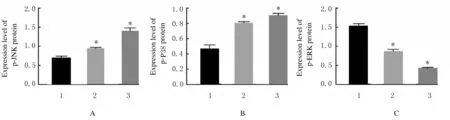
图9 各组人前列腺癌DU145 细胞中p-JNK、p-P38 和p-ERK 蛋白表达水平Fig.9 Expression levels of p-JNK, p-P38, and p-ERK proteins in human prostate cancer DU145 cells in various groups
天然产物或植物来源的生物活性化合物已经在癌症化疗中获得了越来越多的关注,因为其被认为具有更高的生物反应性和与靶点的协同进化性,对正常细胞的毒性也较小[19]。陈皮是从柑橘属植物中培育出来的一种成熟的果皮,其中主要生理活性成分——川陈皮素,具有多种药理作用,主要包括抑制肿瘤生长、抑制炎症介质产生、抑制氧化应激、抗糖尿病胰岛素抵抗、保护骨骼、减少骨吸收、抗过敏、抗心血管功能紊乱和抗神经退行性病变等作用。已证实其在甲状腺癌[20]、肺癌[21]、膀胱 癌[22]、 肾 癌[23]、 鼻 咽 癌[24]和 口 腔 鳞 状 细 胞癌[25]等组织中均有明显的抑癌作用。在人前列腺癌细胞中,较常用于研究的有LNCaP 细胞(激素依赖性)、PC3 细胞(雄激素非依赖性) 和DU145细胞(雄激素非依赖性),其中DU145 细胞的恶性程度和转移潜能最高,同时是一种不含雄激素受体的细胞株,主要用于晚期去势抵抗性前列腺癌研究[26]。本课题组通过体外实验证实了川陈皮素对人前列腺癌DU145 细胞具有抗肿瘤作用。川陈皮素不仅可以抑制前列腺癌DU145 细胞的生长,降低其迁移能力和侵袭能力,并且可以促进DU145细胞凋亡。前列腺癌发生发展的机制与多种信号转导通路有关联,其中MAPK 就是非常关键的一条通路。MAPK 中ERK 是目前研究最深入的信号通路,其与细胞增殖和分化密切相关,而JNK 和P38主要与细胞凋亡有关联。
经过不同浓度(0、12.8 和25.6 μmol·L-1) 川陈皮素处理人前列腺癌DU145 细胞48 h 后,细胞中p-JNK 和p-P38 的表达水平明显升高,而P-ERK的表达水平降低, 提示川陈皮素在人前列腺癌DU145 细胞中发挥抗肿瘤作用,其抑制细胞生长、促进细胞凋亡的作用可能与MAPK 途径上相关蛋白表达的改变有密切关系,但是这一机制需要通过抑制剂进行进一步实验证实。
综上所述,川陈皮素在人前列腺癌DU145 细胞中有良好的抗癌活性,是潜在的治疗前列腺癌的药物,但未来需要对川陈皮素用于动物实验作用进行进一步研究。
