基于核磁共振和气质联用技术对花生发芽及其风味的分析
2020-12-15樊艳
樊 艳
(南京财经大学食品科学与工程学院;江苏省现代粮食流通与安全协同创新中心;江苏省高校粮油质量安全控制及深加工重点实验室,南京 210046)
我国是花生最大的生产国之一,花生资源丰富,品种繁多,按种皮颜色大致可分为红皮花生和黑皮花生[1]。花生仁发芽长出嫩苗的过程称为花生发芽,研究表明芽菜含有多种有益人体健康的营养素[2],种子在萌发期间会使大分子物质降解为小分子物质从而更容易被人体吸收,且加工简单、食用安全,深受市场喜爱。目前,对花生发芽过程的研究多数聚焦在其营养成分及功能性化合物含量的变化上[3-5],而采用低场核磁共振仪分析花生浸种时间对发芽率影响的研究文献不多,对发芽花生的气味研究也鲜有报道。因此,本实验以红皮和黑皮花生种子为材料,研究浸种期间水分在种子内部的相态及其分布状态,以及浸种时间和发芽率的关系和发芽花生的气味,为其资源的充分利用提供实验数据,对开展花生发芽及其营养物质的变化和深加工具有很大的意义。
低场核磁共振及其成像技术作为一种检测手段,相较于传统的水分测定方法具有操作简单,无试剂污染,且对样品无损等优势,近年来被越来越多应用于食品加工处理过程水分的迁移研究[6-9],使用该技术以氢核为研究对象可以充分了解水分子在样品中的分布迁移情况和实际存在状态。为更进一步了解花生发芽期间可食用部分的香味组成及其含量,本实验采用气质联用仪来分析,并用保留指数进行定性,增加结果准确性。
1 材料与方法
1.1 材料
实验材料为2019年新上市的带壳鲜花生,包含红皮花生和黑皮花生。
1.2 仪器与设备
MGC-450HP智能人工气候箱,NMI20低场核磁共振仪,7890A-5875C气质联用仪,多功能样品处理平台(MPS),含固相微萃取(SPME)装置,50/30 μm DVB/CAR/PDMS萃取头。
1.3 实验方法
1.3.1 样品制备
参考杨天等[10]的方法,花生剥壳后筛选出颗粒饱满且无坏损的种子,经超纯水清洗后浸泡在1%(V∶V)浓度的次氯酸钠溶液中,30 min后用超纯水冲洗3次,再放入装有超纯水的玻璃杯中避光浸泡,浸泡时间参照茹万飞[11]的实验方法,分别在5、6、7、8 h后取出进行核磁共振检测和发芽培养。浸泡后的花生种子单层均匀平放于底部有小孔的育苗盘里,表面覆盖浸润的纱布,放入智能人工气候箱(30±2) ℃,(85±5)%RH中发芽,每隔8 h喷湿1次,发芽时长为6 d。
1.3.2 核磁共振检测
线圈直径为15 mm,磁体温度为32 ℃,共振频率为21.960 MHz,磁体强度为0.52 T;利用低场核磁共振仪分析软件中的FID(free induction decay)脉冲序列寻找磁场的中心频率及硬脉冲宽,利用硬脉冲回波序列CPMG(carr-purcell-meiboom-gillsequence)采集花生的横向弛豫时间T2图谱, CPMG参数为SF=19 MHz,P1=13 μs,TD=300 090,SW=200 kHz,RFD=0.5 ms,RG1=20 db,TW=1 500 ms,P2=26 μs,TE=0.2 ms,NECH=7 500,NS=32。每个样品测5次,将采集生成的自旋回波信号导入核磁共振反演拟合软件各自反演,反演方法为SIRT。
发芽率测定参照GB/T 5520—2011《粮油检验 发芽试验》,Y=M2/M,式中:Y为籽粒发芽率/%,M2为发芽率天数内的全部正常发芽粒数,M为一组试样籽粒数。
1.3.3 挥发性组分测定
在林茂等[12]方法上稍作改变,称取3.00 g样品于20 mL顶空瓶中,MPS保温箱温度为60 ℃,平衡20 min,萃取30 min(萃取头进样前260 ℃老化30 min),解析240 s,进行GC-MS分析;色谱柱采用DB-5 MS(30 m×250 um×0.25 um),载气为氦气(纯度≥99.999%),流速1.0 mL/min,进样口温度250 ℃,不分流进样,柱温60 ℃,保持2 min,3 ℃/min升到85 ℃,保持3 min,4 ℃/min升到230 ℃, 保持5 min,后运行温度260 ℃,运行2 min,传输线温度280 ℃,离子源为EI,离子源温度230 ℃,四极杆温度150 ℃,电子能量是70 eV,采集模式为全扫描(Scan),扫描质量范围是45~450 amu。

1.4 数据处理
核磁共振仪采集的信号导入仪器自带的反演拟合软件进行反演,剔除离散性较大的数据,取平均值作为样本的弛豫时间和信号幅度;发芽花生经GC-MS分析,对产生的总离子流图对照标准谱库NIST08.L进行检索,匹配度≥80,并在与样品色谱相同的条件,按烷烃标准品数据信息计算保留指数[14,15],与其他文献测定的RI值进行对比确认和人工解析,对样品的挥发性组分进行定性;采用峰面积归一化法进行定量,计算得到各组分的相对含量。数据采用Origin Pro2018C制表绘图。
2 结果与分析
2.1 花生浸种期间种子水分的存在状态
图1为花生浸种过程弛豫时间T2和信号幅度的关系图,根据核磁共振原理可知,通过测量T2及其幅值能够获得水分在花生中的相态分布信息和含量情况,水分的自由度随T2的大小不同而不同,T2越小说明水和物质的结合程度越高,反之越低,所以T2能够间接表明水分在样品中的存在状态[16]。本实验中花生吸水后每个反演谱曲线上有3个波峰,弛豫时间从小到大T21(0.6~2.7 ms)、T22(7.1~65.8 ms) 和T23(86.9~705.5 ms)分别对应结合水、自由水、油脂的弛豫峰[21]。
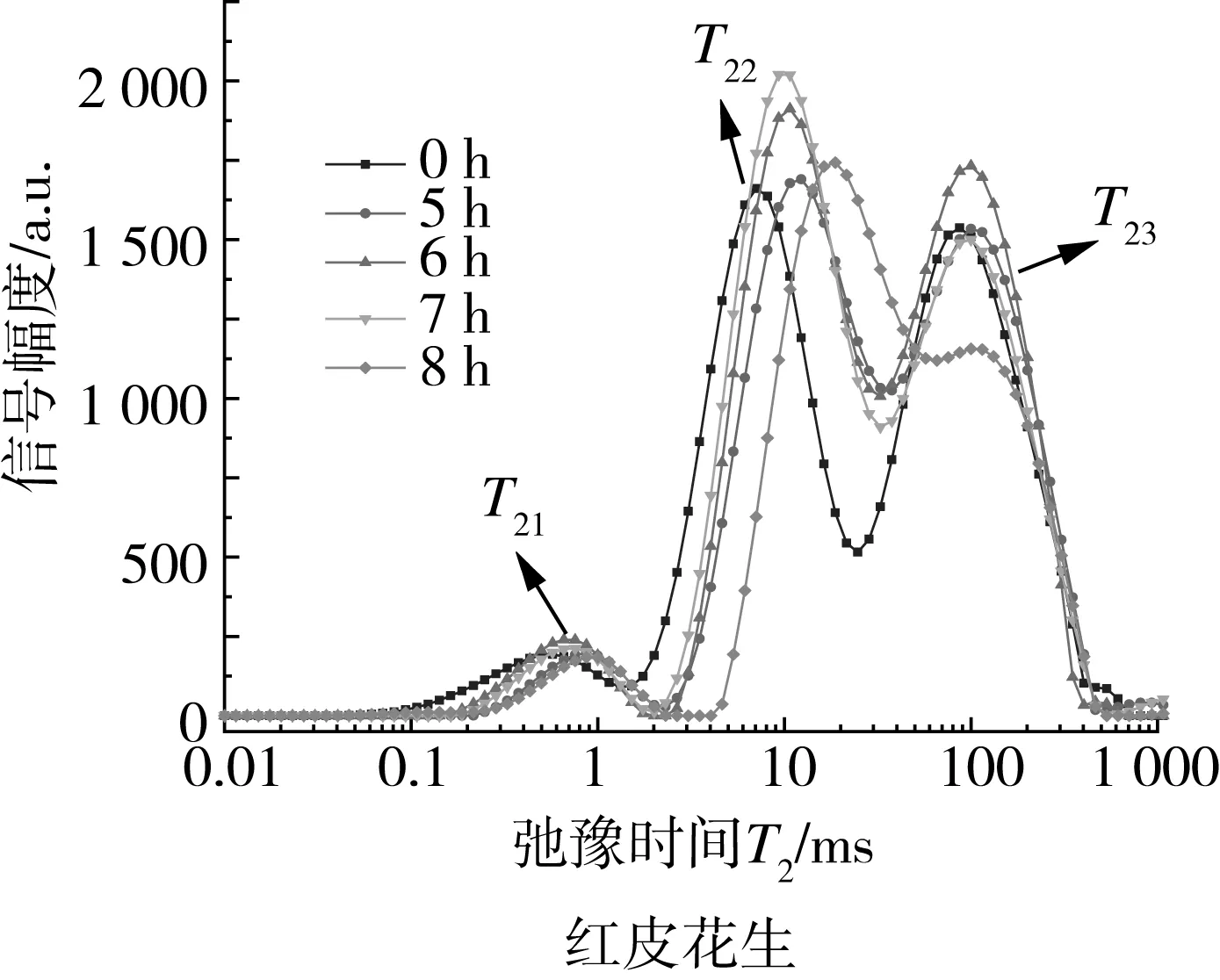
图2可见浸种过程T21峰面积变化幅度不大,表明在此期间种子中的结合水牢牢吸附在内部有机物上,没有发生明显变化;T22峰面积从浸种开始便急速吸水,表明种子内部的自由水含量不断增加,细胞活性增强,流动性和可迁移性均增强,7 h后趋于平稳;浸种期间油脂和水分相互作用,T23峰面积变化有增有减,后期逐渐下降,这与付晓记等[17]的研究结果相似。实验结果表明浸种时间会影响花生的水分迁移。
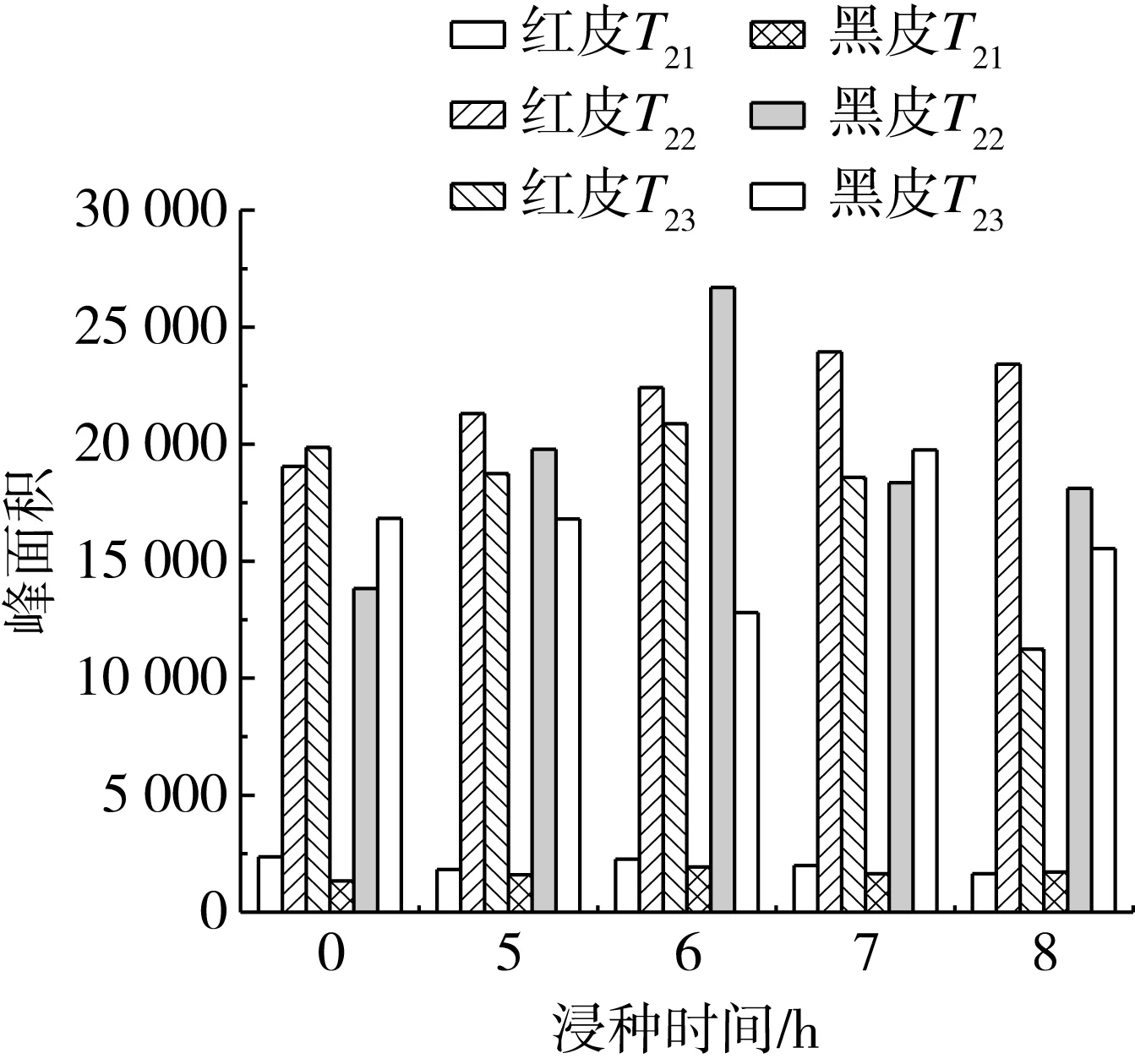
图2 T21、T22、T23随浸种时间变化曲线
由图1和图2可见,两个品种花生T21和对应的弛豫谱信号幅值(峰面积)变化均不大,说明花生种子在浸种期间,与种子结合的水分含量整体稳定;红皮花生T22横向弛豫时间向右移动,对应的弛豫谱信号幅值不断增加,表明该品种花生在浸种期间种子内部的自由水流动性增强,含量增加,黑皮花生T22横向弛豫时间变化不大,对应的弛豫谱信号幅值迅速增加,浸种6 h达到峰值。
图3显示浸种时间为0、5、6、7、8 h五个不同时间点的伪彩图。MRI成像能反映样品中氢质子的分布,氢质子越密集区域质子密度加权像越明亮[18]。图像显示,浸种过程中水最先从花生胚端进入种子,之后种子快速吸水,水分逐渐向内部和外部迁移扩散,8 h后内部水分逐渐向外扩散。
水分是种子萌发的首要条件,自由水的存在是种子生命活跃度提升的必要条件[8]。一般花生种子需要吸收相当于种子风干质量的40%~60%的水分才开始萌动[18]。
2.2 花生发芽期间芽长和芽粗的生长规律
发芽培育的第6天,根据GB/T 5520—2011测不同品种花生在浸种时间分别为5、6、7、8 h的发芽率。实验结果表明两个品种花生的发芽率都在90%以上。花生种子的浸泡时间不同,发芽率不同,并且花生品种不同发芽率也各异。随着浸泡时间的加长,发芽率逐渐增加,红皮花生种子浸泡7 h的花生种子发芽率可以达到95%以上,浸种8 h的发芽率有所下降;黑皮花生种子在浸泡6 h时发芽率达到98%,浸种7 h和8 h的发芽率略有下降。所以,本实验选择的红皮和黑皮花生浸种时间分别为7 h和6 h。
由图4可知,花生种子发芽培养第1天生长缓慢,从第2天开始变化显著,芽长在第3~5天迅速增长,在第5天黑皮花生平均芽长最大,达到了58 mm,第6天趋势平缓;芽粗在第3~4天增长迅速,第5天趋势平缓,红皮花生和黑皮花生的平均芽粗分别为5.7 mm和5.8 mm。于丽娜等[19]检测了5个不同品种花生在6 d的发芽期内芽长和芽粗的生长情况,发现芽长和芽粗的增长态势均呈现先缓后长再平的一个整体趋势,本研究的实验结果与之相似。

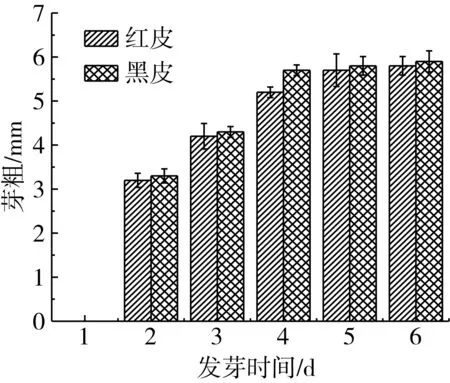
图4 不同品种花生发芽时间和芽长/芽粗的关系
2.3 发芽花生可食用部分的主要挥发性组分分析
由于花生发芽第1天的芽苗平均芽长不到2.5 mm,所以从发芽第2天开始取样进行GC-MS的检测,结果如表1和图5所示。
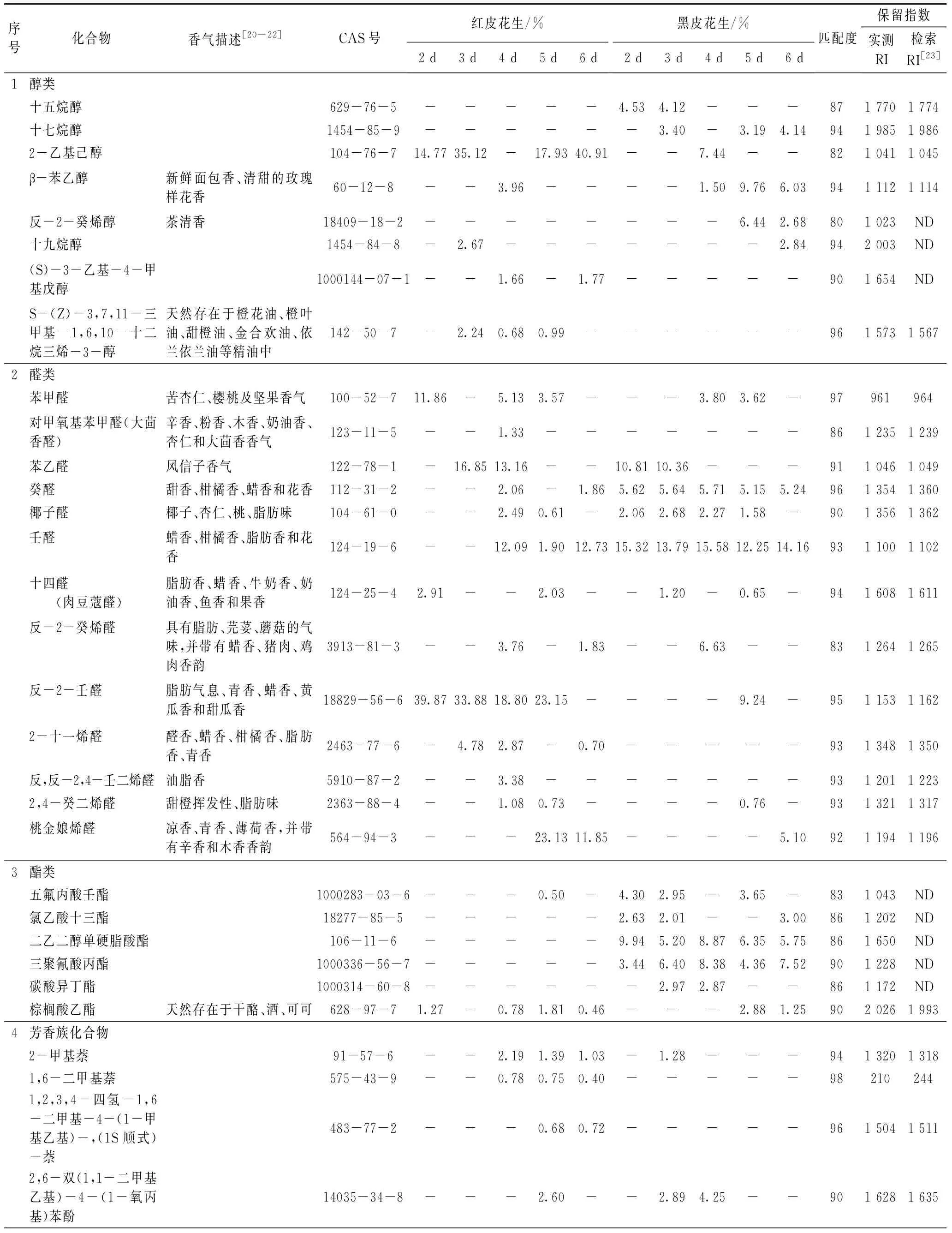
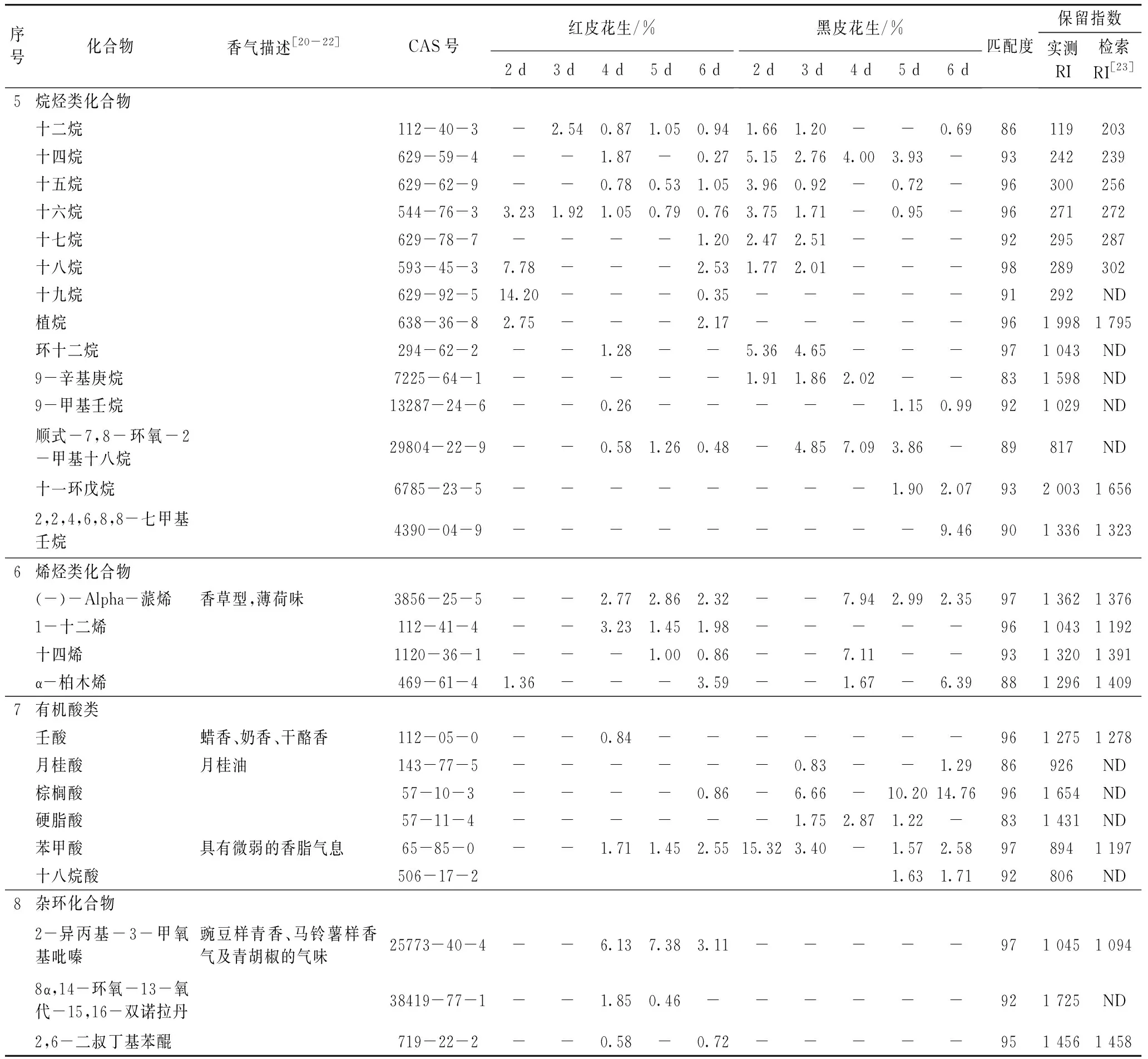
表1 不同品种花生发芽期间可食用部分主要挥发性组分的相对含量/%
续表1

图5 不同品种花生发芽期间挥发性化合物总量的变化
检测结果显示,不同品种花生在发芽期间芽苗可食部分的挥发性成分及其相对含量有所差异,其主要成分有8种,包含醇、醛、烷烃、酯、芳香族、烯烃、有机酸和杂环类化合物,前三类化合物在不同品种的花生发芽期间均有检出,其中,烷烃类化合物由于感觉阈值很高[24],一般无明显嗅感;醛类化合物的相对含量明显高于其他两类化合物,红皮花生在发芽前5天的醛类化合物质量分数均超过了50%,第6天下降到29%,黑皮花生在发芽前5天的质量分数在33%以上,第6天下降到25%,可见,不同品种花生发芽前5天醛类化合物的总量都具有一定的稳定性;反-2-壬醛和壬醛分别是红皮和黑皮花生芽苗中含量最高的醛类化合物。研究表明,醛类化合物的产生可能与氨基酸代谢有关,花生发芽后苯丙氨酸的含量明显增加[25],苯丙氨酸经脱氨脱羧后形成苯乙醛,红皮和黑皮花生芽苗中的苯乙醛质量分数分别在13%和10%以上;醛类化合物阈值很低[26],对发芽花生风味贡献较大,是发芽花生风味成分中最重要的一类化合物,一般认为普通醛类化合物可带来清新的味道[27]。醇类化合物有支链醇2种,芳香醇1种,不饱和醇2种和脂肪醇3种,它们在红皮花生芽苗中质量分数是黑皮花生芽苗中的0.70~5.32倍,一般认为醇类化合物是脂类氧化作用的产物[28];从化合物嗅感特征分析,直链饱和醇的感觉阈值在500~20 000 μg/kg之间,相对其他羰基化合物较高,其香气对花生芽苗的风味贡献很小,但随着碳链的增长,香味增加,会产生清香、木香、脂肪香的特征,含苯环的化合物会产生良好的风味[29],不饱和醇阈值较低[30],从表1中可以看出,具有橘皮香的S-(Z)-3,7,11-三甲基-1,6,10-十二烷三烯-3-醇在红皮花生发芽的第3、4、5天均有被检测到,具有茶清香的反-2-癸烯醇只在黑皮花生发芽的最后2天被检测到,具有玫瑰花样清香的β-苯乙醇在红皮和黑皮花生芽苗中都有检出,后者的含量略高于前者;红皮花生芽苗中的短链饱和醇2-乙基己醇质量分数较高,占醇类总量的88%以上(第4天除外),但由于其阈值极高[20]因此对整体风味的贡献并不大。酯类化合物在黑皮花生芽苗中的质量分数都在17%以上,其中,二乙二醇单硬脂酸酯和三聚氰酸丙酯在黑皮花生芽苗中的含量相对稳定,在红皮花生芽苗中未被检测到,二乙二醇单硬脂酸酯属于分子量较大的烷基酯,它的出现可能与脂肪的降解有关[31],王小燕等[32]的研究发现花生发芽期间脂肪水解为发芽提供营养物质,脂肪含量下降。
分析结果表明,挥发性醇类和醛类化合物是花生发芽期间的关键性嗅感物质,从图6中可以更直观地看出这两类挥发性物质中某些化合物的变化趋势。醇类化合物中,红皮花生芽苗中的2-乙基己醇的含量显著高于黑皮花生芽苗中的含量以及同品种花生芽苗中其他醇的含量,发芽期间其含量呈先升后降再升的波动变化趋势,黑皮花生芽苗中含量较高的物质是β-苯乙醇,呈先升后降的变化趋势;醛类化合物中,红皮花生芽苗的反-2-壬醛含量相对较高,发芽过程中整体呈下降趋势,黑皮花生芽苗中壬醛的质量分数高于其他醛的含量,在12.25%~15.58%范围内呈小幅度的波动变化趋势。


图6 不同品种花生发芽期间醛类化合物的含量变化
3 结论
采用低场核磁共振仪测定弛豫时间和核磁成像技术研究花生浸种期间不同相态水分的分布变化及其含量变化,发现红皮花生在浸种期间种子内部的自由水流动性增强,含量增加,黑皮花生浸种6 h达到峰值;浸种过程中水最先从花生胚端进入种子,之后种子快速吸水,水分逐渐向内部和外部迁移扩散,8 h后内部水分逐渐向外扩散。
采用气质联用技术对花生发芽期间可食部分的香气成分进行检测分析,发现不同品种花生在发芽期间芽苗可食部分的挥发性成分及其相对含量有所差异,各挥发性化合物在发芽期间的总量变化有增有减,无显著规律。醇、醛、烷烃类化合物在不同品种的花生发芽期间均有检出。
