麦冬多糖对大米淀粉凝胶化及凝胶特性的影响
2020-12-15豁银强刘松继陈江平汤尚文
豁银强 刘松继 陈江平 何 萌 汤尚文
(湖北文理学院,襄阳 441053)
大米是世界上一半以上人口的主食。淀粉是大米的主要组分,占干物质的80%以上[1]。大米淀粉具有致敏性低、易消化、清淡无味、颗粒小、白色、淀粉糊冻融稳定性好、支链/直链淀粉比例差异大、消费者易接受等特征[2,3],这些特性使大米淀粉受到了人们的广泛关注。然而,易回生、热不稳定及pH敏感等一些内在缺陷限制了天然大米淀粉在某些领域的应用[4]。添加非淀粉多糖等天然添加剂改善淀粉基凝胶类食品的质构、流变特性等受到人们越来越多的重视[4,5]。
不同来源的天然多糖结构差异比较大,单体组成、糖苷键及分子量不同多糖的生物活性及作为添加物对淀粉质凝胶食品品质的影响不同。麦冬为常用滋阴中药,具有缓解糖尿病和心血管疾病等广泛的药效,近年来也作为功能性成分在食品中应用[6]。麦冬多糖作为麦冬的主要有效成分之一,有降血糖、抗氧化、调节机体免疫系统和保护心血管系统等作用[7]。麦冬分为麦冬和山麦冬,目前已报道19种以上的麦冬多糖,其一级结构主要是由果糖组成,含少量的葡萄糖。麦冬和山麦冬多糖的平均分子质量为4 742 u和4 925 u,多分散性指数分别为1.1和1.2。麦冬和山麦冬多糖的主链是果糖-(2→, →2)-果糖-(6→, →6)-葡萄糖-(1→, →1,2)-果糖-(6→,摩尔比分别为5.0∶18.2∶1.0∶5.3 和6.8∶15.8∶1.0∶5.8[6]。
目前鲜有麦冬多糖-淀粉相互作用的研究报道。本实验研究麦冬多糖对大米淀粉糊化、流变特性及凝胶特性的影响规律,并探究麦冬多糖与大米淀粉凝胶的质构及水分子状态。以期为麦冬多糖在大米淀粉基凝胶类食品中的应用提供借鉴。
1 材料与方法
1.1 材料与试剂
襄麦冬(山麦冬),2019年7月初收集于湖北襄阳市东津镇农户;籼米:市售。
1.2 仪器与设备
AR-2000动态流变仪,TechMaster快速黏度仪,NMI20-025V-I核磁共振成像仪, TA.XT. Plus质构仪。
1.3 方法
1.3.1 大米淀粉和麦冬多糖的制备
大米淀粉的制备:大米样品经粉碎过80目筛,用10倍0.3%的NaOH溶液搅拌提取1 h,3 200× g离心15 min,弃上清,此操作重复2次。加10倍蒸馏水分散沉淀,用0.6 mol/L的HCl调pH至中性,3 200× g离心10 min,弃上清,5倍水洗沉淀、离心后弃上清,水洗3次。每次碱液提取离心后,刮去表层黄棕色胶状物。所得淀粉置于45 ℃烘箱干燥24 h,粉碎过80目筛得米淀粉(以干基计,淀粉和含水量分别为90%和7%),置于干燥器中室温保存备用。
麦冬多糖的制备:麦冬清洗除杂后加入2倍95%乙醇,经植物组织捣碎机粉碎后浸泡2 h以去除色素及脂溶性物质。残渣用10倍蒸馏水90 ℃水提3 h,重复上述提取3次,合并水提物,过D101大孔树脂纯化,滤液经旋转蒸发浓缩至近干,加4倍溶液体积的纯乙醇,4 ℃过夜沉淀。经3 200× g离心15 min得沉淀,沉淀经Sevag法去除蛋白后冻干,得麦冬多糖(经硫酸-蒽酮比色法检测多糖含量为87%)。
1.3.2 糊化特性的测定
分别向大米淀粉中添加0%、2%、4%、6%和8%的麦冬多糖,混合均匀,精确称取每份样品3.5 g置于RVA测量铝桶内,加25 g蒸馏水,用搅拌器上下搅拌均匀样品后,迅速上机测试。测试程序如下: 960 r/min快速搅拌10 s,之后维持转速160 r/min至实验结束,在50 ℃保持10 s,随后以0.2 ℃/s的升温速度匀速升温至95 ℃,并保持150 s,然后以0.2 ℃ /s匀速降温至50 ℃,在50 ℃保持90 s。通过自带软件获得糊化温度、峰值黏度、崩解值、回生值、最终黏度等糊化特性参数。
1.3.3 流变行为分析
按1.3.2相同的方式向大米淀粉中添加麦冬多糖。取0.6 g样品于密封瓶内,加5 mL蒸馏水,磁力搅拌2 h,45 ℃搅拌30 min,90 ℃糊化30 min,所得凝胶样品用于流变测试。测试夹具:40 mm平行板,间距1 000 μm。
静态流变:在37 ℃条件下观察体系的剪切黏度与剪切速率的关系, 剪切速率范围0.1~100 s-1。采用幂律方程模型对数据进行分析。
τ=K(γ)n
式中:τ为剪切应力;K为稠度系数;γ为剪切速率;n为流变行为指数。
动态流变:37 ℃条件下观察体系的弹性模量G′、黏性模量G″及损耗因子tanδ与频率的关系, 频率扫描范围0.1~100 rad/s。
1.3.4 凝胶水分状态分析
以1.3.2方式向大米淀粉中添加麦冬多糖。分别称取混合均匀的样品12.5 g,加入37.5 g蒸馏水,磁力搅拌1 h, 45 ℃搅拌30 min,90 ℃糊化30 min,所得凝胶样品4 ℃冷藏4 d后用于低场核磁分析。将冷藏好的样品取出后室温放置30 min, 取适当样品上机测试。测试参数为:进行校正用Q-FID程序,利用CPMG序列采集样品信号, TD为139 994,RFD为0.002,RG1为10.0,DRG为3,PRG为1,NS为4。对指数衰减曲线进行反演后得到T2(横向)弛豫图谱,获得T21、T22和T23不同松弛时间及表征不同状态水分子比例的参数A21、A22和A23。
1.3.5 凝胶质构分析
按1.3.4同样的方法制备凝胶样品。取出冷藏好的样品使其温度回复至室温后上机测试。测试参数如下:测前速度2.0 mm/s,测试速度1.0 mm/s,测试后速度2.0 mm/s,试样压缩比50%,两次压缩停顿时间为5.0 s,探头类型为P 100。获得硬度、弹性、黏聚性、咀嚼性、回复性等指标。
1.4 数据处理
所有实验均至少重复3次,采用SAS 8.0的Duncan进行方差中的多重比较分析样品间差异显著性(P<0.05)。利用Origin 9.0和Excel进行图表绘制。
2 结果与分析
2.1 糊化特性
糊化行为测试过程中,当温度达到糊化温度(PT)时,淀粉颗粒开始膨胀,黏度迅速增加至峰值黏度(FV),进一步加热,淀粉颗粒破裂引起黏度降至谷值黏度(TV),冷却过程中,直链和支链淀粉分子间发生重排引起黏度升高至达到最终黏度值(FV)[8]。

图1 麦冬多糖-大米淀粉的RVA曲线
添加麦冬多糖对大米淀粉糊化行为和糊化参数的影响分别如图1和表1所示。从图1可以看出,所有样品的RVA曲线变化趋势类似,但添加麦冬多糖使大米淀粉糊化曲线整体下移,降低幅度随麦冬多糖添加量增加而加剧。由于多糖与淀粉分子竞争性吸收水分子,大米淀粉的糊化温度随麦冬多糖添加量增加而逐渐升高,其他研究也得到类似的结果[9]。
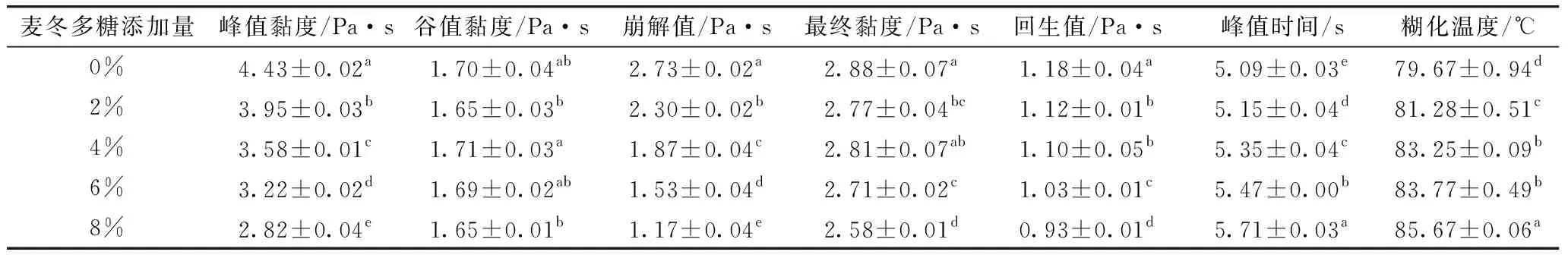
表1 麦冬多糖对大米淀粉糊化特性参数的影响
由于抑制了淀粉颗粒的膨胀,添加麦冬多糖使大米淀粉的峰值黏度降低,添加8%的麦冬多糖使大米淀粉的峰值黏度由4.43 Pa·s降至2.82 Pa·s。Liu等[10]研究也表明,小麦淀粉峰值黏度随凉粉草多糖添加量增加而降低。由于减弱了淀粉颗粒和水的结合力,普鲁兰多糖等亲水胶体引起淀粉糊峰值黏度减小[11]。而添加凉粉草多糖却增加了木薯淀粉的峰值黏度[8]。以上研究表明,多糖对淀粉糊峰值黏度的影响受多糖及淀粉结构和特征的影响。
由于抑制了大米淀粉颗粒发生膨胀和崩解,麦冬多糖以浓度依赖的方式显著降低了大米淀粉的崩解值,表明添加麦冬多糖增强了大米淀粉对热和机械剪切力的耐受性。因与渗出的直链淀粉分子相互作用抑制了淀粉分子在冷却过程中再聚集的能力,麦冬多糖降低了大米淀粉糊的回生值。短期回生对大多数食品是不利的,因而添加麦冬多糖可有效改善糊化大米淀粉质食品的品质。
2.2 流变特性
2.2.1 静态流变
图2是添加不同量麦冬多糖大米淀粉糊剪切应力随剪切速率的变化曲线。所有样品糊的剪切应力均随剪切速率增加而增大,表现为剪切稀释的非牛顿流体。

图2 麦冬多糖对大米淀粉静态流变曲线
为了更好地探究不同体系在整个剪切速率范围内黏度的变化规律,采用幂律模型对结果进行拟合,相关参数如表2所示。不同体系的回归系数R2为0.83~0.89,表明方程的拟合度比较高。不同样品的流体行为指数n为0.27~0.34(均小于1),表明样品为剪切稀释型假塑性流体,添加麦冬多糖使大米淀粉糊的n值降低,表明体系的假塑性增强。造成这种结果的原因可能是,麦冬多糖抑制了淀粉分子间氢键的形成,淀粉分子呈现一种较为伸展的状态,表现为明显的假塑性[12]。稠度指数K可表征体系黏度大小[13],由于抑制了直链淀粉的渗出及麦冬多糖与渗出的直连淀粉作用抑制了三维网络结构的形成,体系黏度减小,添加麦冬多糖使大米淀粉糊的K值降低。在葛根淀粉和莲子淀粉中添加大豆可溶性多糖也出现类似的现象[14]。
2.2.2 动态流变
添加不同量麦冬多糖大米淀粉糊的储能模量(G′)、耗能模量 (G″)和损耗因子(tanδ)在频率0.1~100 rad/s范围内的变化曲线如图3所示。
所有体系的G′和G″均随频率增加而加大,表现出较强的频率依赖性;由于米淀粉和麦冬多糖间发生较强的相互作用,相同频率下淀粉凝胶的G′和G″随多糖添加量增加而减小,大豆可溶性多糖-淀粉复合体系凝胶及凉粉草多糖-玉米淀粉复合凝胶体系也出现类似的结果[14,15]。因具有较多的羟基等极性基团,多糖通过氢键与渗出的直连淀粉分子缔合[16],阻碍了直链淀粉分子间聚集形成网络结构,降低了混合物样品的黏弹性。所有样品的tanδ均小于1且随角频率增加而加大,表明样品均以黏性特征为主。随麦冬多糖添加量增加,tanδ随角频率的变化曲线整体下移,表明添加麦冬多糖使大米淀粉凝胶由液态向固态转变,在一些其他多糖-淀粉体系研究中也得到类似的结果[17]。

2.3 水分子状态
食品基质中的水根据运动能力大小分为结合水、束缚水及自由水3大类。T2能很好地表征水分子的运动情况,T2越小表明水分子与基质结合越紧密而运动能力越弱。图4为样品T2松弛时间谱,所有凝胶样品的T2经反演拟合后均呈现4个峰,前两个峰定义为T21,往后依次为T22、T23,位于0~1 ms之间的T21代表紧密结合水,位于1~10 ms之间的T22主要代表位于凝胶网络结构孔洞中的束缚水,而位于10~1 000 ms信号较强的T23代表自由水。从图4可以看出,所有样品中的水大部分以游离态自由水形式存在,结合水和束缚水的量相对较少。
松弛谱的相对峰面积与相应含水量成正比[18]。不同麦冬多糖添加量大米淀粉凝胶不同状态水的百分比含量如表3所示。相对于纯大米淀粉凝胶样品,添加2%的麦冬多糖引起大米淀粉凝胶中自由水含量降低,而结合水含量显著增加;进一步加大麦冬多糖添加量,大米淀粉凝胶中的束缚水含量也显著降低。该结果表明添加麦冬多糖引起凝胶中的水分子自由度降低。产生这种结果可能是因为麦冬多糖具有较高的亲水性。此外,其竞争结合了与淀粉分子结合的水分子而抑制了淀粉颗粒的膨胀和凝胶化,部分凝胶化使能够发生可逆膨胀淀粉颗粒内的部分水分子被保留。天然淀粉颗粒中存在三种类型的水分子,即无定型生长环中的水、半结晶片层中的水及β支链淀粉形成的六元环腔中的水[18]。添加多糖限制了淀粉颗粒的凝胶化,进而降低了水分子在颗粒内和颗粒间的重新分配,而使淀粉颗粒的持水力增强[19]。
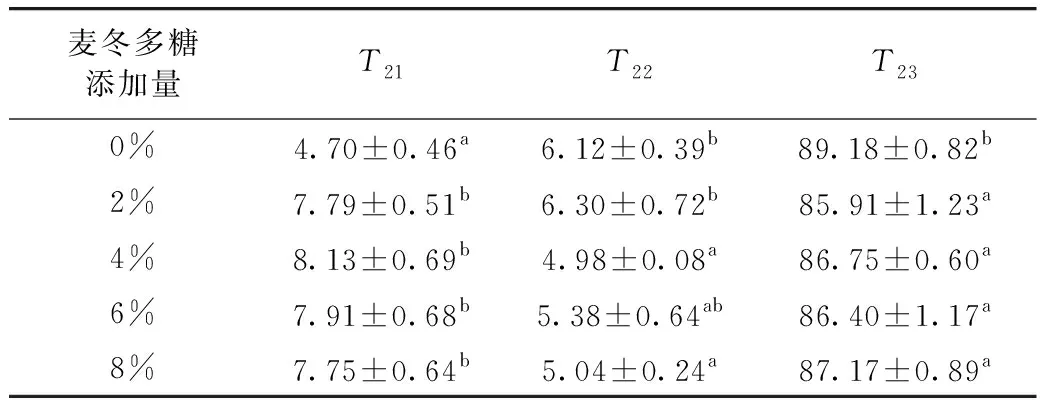
表3 麦冬多糖对大米淀粉凝胶A21、A22、A23的影响
2.4 质构特征
由于大米淀粉凝胶较弱,本研究制备的凝胶于4 ℃储存4 d以促进凝胶稳定。添加不同量麦冬多糖大米淀粉凝胶的质构特性参数如表4所示。麦冬多糖对大米淀粉凝胶质构特征有明显的影响。
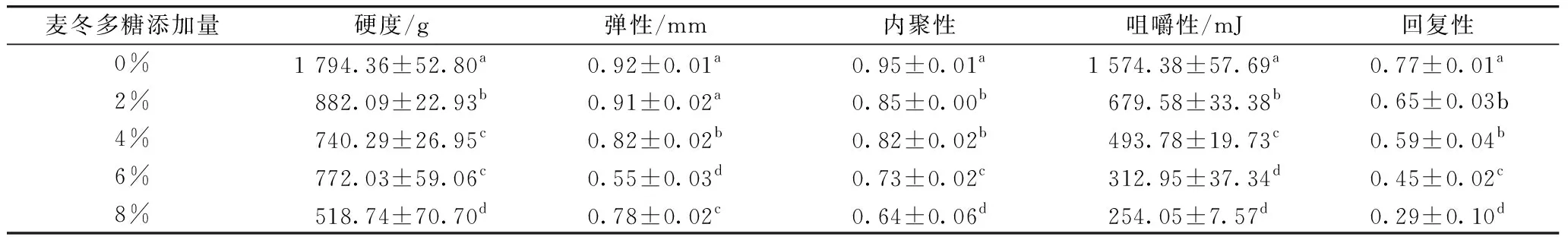
表4 大米淀粉-麦冬多糖凝胶的质构特征参数
所研究的样品中,对照大米淀粉凝胶的硬度最高,随着麦冬多糖添加量增加,硬度值呈逐渐降低的趋势。产生这种结果的原因可能是,麦冬多糖与渗出直链淀粉分子作用抑制了凝胶网络的形成,使凝胶结构的强度降低。此外,利用麦冬多糖替代部分大米淀粉,相对于对照组样品来说,添加麦冬多糖样品体系中的直链淀粉含量降低也影响凝胶网络的形成。凉粉草多糖-红薯淀粉复合体系也出现类似的趋势,凝胶硬度随凉粉草多糖替代量增加而降低[4]。
随麦冬多糖添加量增加,大米淀粉凝胶的咀嚼性显著降低。咀嚼性模拟人咀嚼食物至可吞咽状态所需要的能量,咀嚼性值越低表明样品的口感越好,该结果表明麦冬多糖能够改善大米淀粉质凝胶食品的感官特征。大豆可溶性多糖对葛根和莲子淀粉凝胶产生类似的效果,即淀粉凝胶咀嚼性随大豆可溶性多糖添加量增加而降低[15]。
添加麦冬多糖大米淀粉凝胶的内聚性显著降低,表明添加麦冬多糖使大米淀粉凝胶的内部结构更易被破坏。随着麦冬多糖添加量增加,大米淀粉凝胶的回复性显著降低,表明添加麦冬多糖降低了大米淀粉凝胶的弹性。
结果表明,添加麦冬多糖能够使淀粉凝胶从较硬的质构变得柔软,这将对预测和调控大米淀粉基食品的质构具有较好的借鉴作用。
3 结论
用麦冬多糖替代大米淀粉能够显著改变大米淀粉糊化、流变及凝胶质构特征。麦冬多糖对淀粉颗粒膨胀产生一定的抑制作用,进而随着麦冬多糖添加量增加,大米淀粉糊的峰值黏度、谷值黏度、崩解值、最终黏度等黏度参数均降低,而峰值时间和糊化温度不断增加。大米淀粉及大米淀粉-麦冬多糖复合体系凝胶均是剪切稀释的假塑性流体,添加麦冬多糖以浓度依赖的方式使大米淀粉糊的假塑性增强,而稠度指数、黏弹性、硬度、内聚性、咀嚼性和回复性均降低。大米淀粉及大米淀粉-麦冬多糖复合体系凝胶中的水分子均以结合水、束缚水及自由水3种状态存在,由于限制了淀粉颗粒受热膨胀性及与水分子结合,麦冬多糖使淀粉凝胶中的水分子运动性降低,表现为束缚水和结合水含量增加而自由水相对比例降低。
