茶树CsCIPK12与CsKIN10的互作鉴定及其表达分析
2020-12-15冯霞邸太妹彭靖李娜娜姚利娜杨亚军王新超王璐
冯霞,邸太妹,彭靖,李娜娜,姚利娜,杨亚军,王新超,王璐
茶树CsCIPK12与CsKIN10的互作鉴定及其表达分析
冯霞,邸太妹,彭靖,李娜娜,姚利娜,杨亚军,王新超*,王璐*
中国农业科学院茶叶研究所/国家茶树改良中心/农业农村部茶树生物学与资源利用重点实验室,浙江 杭州 310008
蔗糖非酵解-1相关蛋白激酶(Sucrose non-fermenting 1-related protein kinase,SnRK)在代谢调控和胁迫信号传递中发挥重要的作用。本文以茶树SnRK3亚家族的基因和SnRK1亚家族的基因为研究对象,通过序列比对和进化分析,发现CsCIPK12和CsKIN10都具有N端激酶结构域和C端调节域;CsCIPK12具有与CBLs结合的NAF/FISL结构域,与拟南芥AtCIPK12,杨树PtCIPK17、18、19同源关系最近;而CsKIN10具有泛素相关的UBA结构域,与杨树PtSnRK1同源关系最近。通过酵母双杂交系统,证实了CsCIPK12和CsKIN10蛋白存在相互作用。表达分析发现,在自然冷驯化过程中,的表达模式与前期对的研究结果一致,在龙井43、浙农12、大面白3个茶树品种中受低温不同程度地诱导;4℃短时低温处理发现,和在成熟叶中受低温显著诱导(最高诱导水平分别为4倍和2.3倍),而在新梢中,二者对低温的响应并不显著;ABA、葡萄糖以及蔗糖处理发现,和在成熟叶中受这3种处理的显著诱导。结果表明,CsCIPK12与CsKIN10蛋白相互作用,参与ABA和糖信号途径,在茶树低温胁迫响应中可能发挥重要作用。
茶树;CIPK12/SnRK3.9;KIN10/SnRK1.1;低温胁迫;酵母双杂交
蔗糖非酵解-1相关蛋白激酶(Sucrose non-fermenting 1-related protein kinase,SnRK)在代谢调控和胁迫信号传递中发挥重要作用。SnRK是一类丝氨酸/苏氨酸蛋白激酶,亚家族为SnRK1,SnRK2和SnRK3。其中,SnRK3是植物特有的一类蛋白激酶,由于其与钙调磷酸酶B类似蛋白CBL(Calcineurin B-like)结合,也被称为CIPK(CBL-interacting kinase)蛋白激酶[1]。作为钙离子信号受体蛋白的CBL通过结合SnRK3/CIPK蛋白的NAF/FISL结构域并激活SnRK3/CIPK,进而磷酸化下游靶蛋白,传递钙信号[2]。CIPK主要参与调控植物的非生物胁迫响应,其最先在拟南芥的盐过度敏感(Salt overly sensitive,SOS)通路中被发现。盐胁迫下,钙离子与AtSOS3/CBL4结合,使AtCBL4与AtSOS2/CIPK24形成复合体,通过调节质膜Na+/H+反向转运体AtSOS1,增强植物的耐盐性[3-4],随后SOS2/CIPK24调节耐盐性的作用在杨树中也得到证实[5]。其次,研究发现AtCBL9-AtCIPK3可以调控ABA响应信号途径,的缺失改变了ABA、低温和盐胁迫响应基因的表达[6-7],表明了CIPK在植物应对低温等非生物胁迫中的重要作用。Yan等[8]发现,能够响应低温、ABA、高盐、干旱等非生物胁迫,同时AtCIPK14蛋白可与AtCBL2/3/9以及AtSnRK1.1和AtSnRK1.2互作,参与葡萄糖信号途径。苹果中MdCIPK22与bZIP家族转录因子MdAREB2互作,并且磷酸化MdAREB2蛋白,以此调控ABA响应信号途径[9]。此外,MdCIPK13与MdCBL3互作,磷酸化蔗糖转运蛋白MdSUT2.2,通过调控糖代谢途径来增强苹果的耐盐性[10]。总之,CIPK与钙离子感受器CBL结合,磷酸化下游靶标,参与ABA和糖等信号途径,调控植物的非生物胁迫响应。
SnRK1蛋白激酶参与调控细胞对能量胁迫的反应,调节植物的生长发育,在植物抗逆生理上也发挥重要作用。Jossier等[11]通过对过表达植株的生理生化分析,发现在糖信号及ABA信号通路中发挥功能,转基因株系中淀粉和可溶性糖的浓度发生改变。Lee等[12]发现水稻OsSnRK1A受OsCIPK15调节,将缺氧胁迫信号与糖感应信号级联,调节糖和能量的产生,使水稻抵御淹水胁迫。最近的研究发现ShSnRK1能够与冷诱导蛋白ShCIGT相互作用,降低转基因番茄对ABA的敏感性,增强番茄的耐寒性和抗旱性[13]。
茶树是我国重要的经济作物之一,喜温畏寒,极易遭受低温胁迫危害,我国主要产茶地区多发“倒春寒”现象,严重影响茶叶的产量和品质。因此,解析茶树抗寒分子机制成为茶学研究的热点之一。Ca2+、ABA和糖等作为信号分子,均参与低温信号的转导,从而激发植物的抗寒响应[14, 15]。SnRK家族激酶参与Ca2+、ABA和糖信号途径,在调控低温等非生物胁迫中发挥重要作用。茶树中关于SnRK3/CIPK和SnRK1在逆境方面的报道较少,Liu等[16]在茶树中鉴定出18个s,分析了6个在高温、低温、盐和干旱处理下的表达模式,但未对其基因功能进行深入研究。本课题组前期通过转录组分析发现,受冷驯化强烈诱导,但该基因在Liu等[16]的报道中并未提及,并且在冷驯化过程中,该基因在抗寒品种和敏感品种中差异表达[17],暗示该基因在调控茶树的低温响应中发挥重要作用。为明确CsSnRK3.9/CIPK12的调控机制,课题组前期以CsSnRK3.9/CIPK12为诱饵筛选了茶树低温处理叶片cDNA的酵母文库,得到其候选互作蛋白CsSnRK1.1/KIN10。本研究在此基础上,对CsSnRK3.9/CIPK12和CsSnRK1.1/KIN10进行了生物信息学分析以及低温等处理下的表达模式分析,同时进一步明确了两个蛋白的互作关系,这为深入研究CsSnRK3.9/CIPK12和CsSnRK1.1/KIN10在茶树抗逆中的作用机制提供参考。
1 材料与方法
1.1 材料与试剂
试验所用茶树为国家级茶树品种龙井43、大面白和浙农12。试验所需Yeastmaker™ Yeast Transformation System 2和Matchmaker Gold Yeast Two-Hybrid System试剂盒,pGADT7和pGBKT7载体购自Clontech公司;PrimeScript RT Reagent试剂盒购自TaKaRa公司;LightCycler®480 SYBR®Green I Master试剂盒购自Roche公司;克隆载体pEASY-bluntzero载体购自TransGen公司;KOD酶购于ThermoFisher公司;RNA prep Pure多糖多酚植物总 RNA提取试剂盒购自TIANGEN公司;大肠杆菌()菌株DH5,酵母菌株Y2H和Y187为实验室保存的菌株。
1.2 处理方法
自然冷驯化的样品为采取的龙井43、大面白和浙农12叶片,采摘时间为2016年10月至2017年3月期间,样品处理方法参考文献[17]。低温(4℃)处理:将6年生的茶树龙井43盆栽植株移入人工气候室(光周期:12 h光照/12 h黑暗;恒温:22℃;相对湿度:75%)适应性生长30 d,随后将温度降至4℃进行低温处理,在处理0 h、3 h、6 h、1 d、3 d、5 d、7 d以及将温度升回22℃恢复生长2 d时分别采集一芽一叶新梢和第三片成熟叶。试验设置3个生物学重复,每2株茶树作为1个生物学重复。采集的样品经液氮速冻后于–80℃冰箱中保存备用。
ABA处理:参考Cao等[18]的处理方法,选取大小一致,健康的龙井43一年生扦插苗,于人工气候室中进行水培适应培养30 d,营养液配方参照Ruan等[19]的方法,pH值为5.0,水培槽中24 h不间断通氧。适应培养后,将茶苗置于含100 μmol·L-1ABA的营养液中处理,在处理0 h,3 h,9 h,1 d,3 d和5 d时采集第二、三片成熟叶。试验设置3个生物学重复,每2株茶苗作为1个生物学重复。采集的样品经液氮速冻后于–80℃冰箱中保存备用。
蔗糖和葡萄糖处理:以一年生龙井43扦插苗为材料,经过30 d水培适应培养后进行糖处理(光周期:12 h光照/12 h黑暗;恒温:22℃;相对湿度:75%)。设置3种处理,分别为不加糖对照,3%蔗糖和3%葡萄糖。在处理3 h、9 h、12 h、1 d和2 d时,分别采集3种处理下的茶树的第二、三片成熟叶。试验设置3个生物学重复,每2株茶苗作为1个生物学重复。采集的样品经液氮速冻后于–80℃冰箱中保存备用。
1.3 RNA提取以及cDNA合成
总RNA提取使用RNA prep Pure多糖多酚植物总RNA提取试剂盒。取1 µg RNA,使用PrimeScript RT Reagent Kit with gDNA Eraser试剂盒,反转录成cDNA,储存于–20℃冰箱备用。
1.4 基因克隆与载体构建
参照已发表的舒茶早基因组序列信息[20],利用Oligo 7.0设计引物,以龙井43的cDNA为模板,使用KOD酶进行PCR扩增。PCR产物经琼脂糖凝胶电泳,回收目的条带,连接至pEASY-bluntzero载体,转化至DH5后进行鉴定并测序,阳性克隆提取质粒,经双酶切连接法分别构建pGBKT7-CsCIPK12和pGADT7-CsKIN10终载体。PCR所用引物信息见表1(下划线为酶切位点)。

表1 RT-PCR和qRT-PCR引物
注:下划线表示相应的酶切位点,GGAATTC表示EcoRⅠ酶切位点,CGGGATCC表示BamHⅠ酶切位点
Note: Underline indicates the corresponding restriction sites, GGAATTC and CGGGATCC indicates EcoR Ⅰ and BamH Ⅰ restriction site, respectively
1.5 生物信息学分析
从植物基因组数据库中下载拟南芥(http://www.arabidopsis.org/index.jsp),水稻(http://rice.plantbiology.msu.edu),和杨树(http://www.phytozome.net/poplar)的CIPK家族和SnRK1家族的蛋白序列信息,利用ClustalX和DNAMAN进行序列同源比对,用MEGA 7.0中的邻接法(Neighbor-Joining)构建系统发育进化树。预测蛋白分子量、等电点、氨基酸组分、亚细胞定位、蛋白结构域和蛋白磷酸化位点参考钱文俊等[21]的方法。
1.6 酵母双杂交实验
酵母感受态的制备以及酵母转化方法按照Clontech的Yeast Protocols Handbook中的方法进行操作。将构建好的pGADT7-CsKIN10载体转入Y187菌株,将构建好的pGBKT7-CsCIPK12载体转入Y2H菌株,于30℃倒置暗培养。待菌落长出后,将转化到Y2H和Y187菌株中的阳性单克隆挑出,加入500 μL 2×YPDA培养液中,在30℃、200 r·min-1条件下振荡培养8~12 h,并稀释至OD600=0.2,再依次稀释10倍、100倍,取10 μL点到SD/-Leu/-Trp,SD/-Leu/-Trp/-Ade/-His,SD/-Leu/-Trp/-Ade/-His /X-α-Gal/AbA筛选培养基上,30℃暗培养3 d后拍照记录。
1.7 CsCIPK12和CsKIN10的表达分析
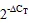
2 结果与分析
2.1 序列结构与进化分析
2.1.1的序列分析
从茶树品种龙井43中克隆得到的目的基因(TEA016252.1)的开放阅读框为1 578 bp,编码526个氨基酸。与拟南芥,水稻和杨树中亲缘关系较近的CIPK氨基酸序列进行同源比对发现,CsCIPK12的氨基酸序列与其他3种植物的氨基酸序列有较高的保守性,具有两个重要的结构域,分别是N端苏氨酸/丝氨酸激酶结构域和C端调控域,C端调控域中还有与CBLs结合所必需的NAF/FISL结构域(图1)。
2.1.2的序列分析
从茶树品种龙井43中克隆得到的目的基因(TEA007220.1)的开放阅读框为1 545 bp,编码515个氨基酸。与拟南芥,水稻和杨树中亲缘关系较近的SnRK氨基酸序列进行同源比对发现,CsKIN10蛋白与其他3种植物的蛋白一样,具有3个重要的结构域,分别是N端苏氨酸/丝氨酸激酶结构域和C端调控域,以及1个与泛素结合相关的UBA结构域(图2)。
2.1.3 进化分析
查找拟南芥,水稻和杨树中的CIPK和SnRK1家族的蛋白序列,与目的蛋白一起,使用邻接法构建系统发育树,发现CsCIPK12与杨树的PtCIPK17、18、19以及拟南芥AtCIPK12亲缘关系最近,CsKIN10与杨树的两个SnRK1亲缘关系最近(图3)。
2.2 蛋白质理化性质分析与预测
用ProtParam预测CsCIPK12蛋白分子量为130.1 kD,理论等电点pI为5.01,用Cell-Ploc 2.0对该蛋白进行亚细胞定位预测,预测其定位于细胞质中,用NetPhos 3.1预测蛋白的磷酸化位点,发现该蛋白可能存在50个苏氨酸Thr磷酸化位点。CsKIN10蛋白分子量为58.9 kD,理论等电点pI为8.43,利用Cell-PLoc 2.0对该蛋白进行亚细胞定位分析,预测该蛋白定位于细胞核内。用NetPhos 3.1对该蛋白的磷酸化位点进行预测显示,该蛋白可能存在33个磷酸化位点,其中包含15个丝氨酸Ser位点,11个苏氨酸Thr位点和7个络氨酸Tyr位点。

注:黑线之间的氨基酸序列为N端蛋白激酶结构域;蓝色线条为C端调控结构域;红色方框为NAF/FISL结构域,可以结合CBLs

注:黑线之间的氨基酸序列为N端蛋白激酶结构域;蓝色线条为C端调控结构域;橘色线条为UBA结构域,与泛素相关

注:使用全长的氨基酸序列构建拟南芥、水稻、杨树和CsCIPK12及CsKIN10蛋白的系统进化树。AtCIPKs:拟南芥;OsCIPKs:水稻;PtCIPKs:杨树;AtSnRK1s:拟南芥;OSKs:水稻;(Pt):杨树
2.3 酵母双杂明确CsCIPK12与CsKIN10的蛋白互作
按照1.6章节中的方法进行共培养转化点板后,SD/-Leu/-Trp培养基上长出白色菌落,可见,阳性对照、阴性对照、(pGADT7空载体+pGBKT7-CsCIPK12)和(pGADT7-CsKIN10+pGBKT7-CsCIPK12)在酵母中成功表达且菌株活力一致。pGBKT7-CsCIPK12与pGADT7载体的共培养酵母不能在SD/-Leu/-Trp/-Ade/-His和SD/-Leu/-Trp/-Ade/-His/X--Gal/AbA上生长,说明pGBKT7-CsCIPK12不具有自激活活性。而pGBKT7-CsCIPK12与pGADT7- CsKIN10的共培养酵母能够在SD/-Leu/-Trp/-Ade/-His和SD/-Leu/-Trp/-Ade/-His/X--Gal/AbA长出与正对照一样的正常的菌落,且在SD/-Leu/-Trp/-Ade/-His/X-α-Gal/AbA上呈现蓝色,表明pGADT7-CsKIN10与pGBKT7-CsCIPK12存在互作,并能激活下游报告基因和的表达(图4)。
2.4 表达分析
2.4.1和受低温诱导
检测在自然冷驯化过程中3个不同抗寒性品种龙井43、大面白和浙农12[17]叶片中的表达,qRT-PCR结果显示,随着温度的降低,的表达水平显著上升,且在抗性品种龙井43、敏感品种大面白和浙农12中的诱导倍数不同。温度较低的12月16日,在龙井43、大面白和浙农12中的诱导倍数分别约为2.3、2.4倍和2.8倍,在1月17日,在3个品种中的诱导倍数分别约为2.0、2.7倍和2.2倍。随着温度的回升,的表达水平在2、3月份回落,说明参与了茶树冷驯化过程(图5-A)。本课题组前期在此样品中检测了的表达,发现受到低温诱导[17],且在这3个品种中的表达趋势与较为一致。

注:将CsCIPK12和CsKIN10的CDS分别克隆到pGADT7和pGBKT7载体中。pGADT7-T+pGBKT7-p53为阳性对照,pGADT7-T+pGBKT7-lam为阴性对照,pGADT7 +pGBKT7-CsCIPK12为自激活验证
为了进一步研究这两个基因在低温下的表达情况,我们在人工气候室内对龙井43盆栽苗进行了4℃短时低温处理,qRT-PCR结果显示,随着处理时间的增加,在成熟叶中的表达在处理1 d及以后显著提高,在5 d和7 d时达到最高,约为0 h的4.0倍,恢复22℃常温处理2 d后,其表达量又下调到处理前水平。然而在新梢中,的表达对低温并无显著响应(图5-B)。与不同,处理7 d时,在新梢中的表达显著上调,但诱导倍数只为处理前的1.5倍左右。在成熟叶中,的表达在处理3 h和7 d的时候显著上调,分别为处理前的2.3倍左右和2.1倍左右(图5-C)。此结果表明,在成熟叶中,和的表达都能迅速地响应低温且受低温诱导,而在新梢中,和在短时间内对低温的响应并不显著。
2.4.2和受ABA诱导
ABA处理的qRT-PCR结果显示,的表达受ABA处理诱导,且在处理3 h、1 d和5 d时的表达量显著提高,分别约为处理前相应数值的3.4、6.9倍和4.1倍。的表达也受ABA处理诱导,在处理1 h、9 h和1 d时的表达量显著提高,分别约为处理前的3.8、3.5倍和3.5倍。此结果表明,和的表达均受ABA诱导,可能与ABA依赖的抗逆调节有关(图6)。

注:*和**分别表示与Oct.14相比,差异显著(P<0.05)和极显著(P<0.01);新梢和成熟叶的统计分析独立进行,不同小写字母表示在0.05水平上差异达显著;re2 d指恢复22℃常温处理2 d
2.4.3和受葡萄糖和蔗糖诱导
葡萄糖和蔗糖处理的qRT-PCR结果显示,与每个时间点未施加处理的对照相比,在葡萄糖处理1 d时的表达量显著提高,为对照的2.0倍左右;在蔗糖处理9 h及以后的时间内表达量均显著提高,处理1 d后的诱导倍数最高,约为对照的2.3倍(图7)。的表达在葡萄糖处理1 d后显著上调,为对照的3.6倍左右;在蔗糖处理12 h和1 d时表达量显著上调,分别约为对照的2.1倍和2.9倍。这些结果说明与都不同程度地受葡萄糖和蔗糖的诱导,这两个基因可能参与调控植物的糖代谢途径或糖信号途径。
3 讨论
3.1 CsCIPK12与CsKIN10互作
SnRK家族基因在代谢和胁迫信号传递中发挥重要作用,调控植物对逆境胁迫的响应[1]。目前,关于SnRK1亚家族成员与SnRK3亚家族成员互作关系的研究,仅在拟南芥和水稻中有报道。AtCIPK14与AtSnRK1.1/1.2互作[8],调控糖响应。OsCIPK15与OsSnRK1A互作并正调控OsSnRK1A,提高水稻对淹水胁迫的耐受性[12]。本研究通过酵母双杂交试验,证实了茶树SnRK蛋白家族中的CsCIPK12与CsKIN10互作(图4),这丰富了SnRK1蛋白亚家族和SnRK3蛋白亚家族成员间的互作关系网络,为深入研究两个SnRK蛋白亚家族成员的功能提供了理论依据和研究思路。关于CsCIPK12和CsKIN10具体的调控关系,磷酸化作用位点以及下游的磷酸化靶标蛋白等问题,值得进一步深入研究。

注:不同小写字母表示在0.05水平上差异达显著
注:图中不同的小写字母表示与每个时间点的对照相比,在0.05水平上差异达显著
3.2 CsCIPK12与CsKIN10受低温诱导
冷驯化过程中,[17]与均受低温诱导,且在抗寒品种龙井43中的表达均低于两个敏感品种浙农12和大面白,表明和在低温胁迫下可能存在协同作用的关系(图5-A)。短时低温处理下,成熟叶中对低温的响应先于,且的表达量在处理3 h后诱导至最高水平,说明在茶树早期响应低温中发挥作用(图5-B,图5-C)。和基因在成熟叶中受低温强烈诱导,而在新梢中,不受低温调控,仅在处理7 d时表达有所提高,但也未达到2倍。先前研究表明,茶树成熟叶和新梢的耐冷机制存在差异,低温条件下,成熟叶中与细胞膜、氧化还原过程、谷胱甘肽代谢和光合作用途径有关的基因表达上调,而新梢中与细胞膜、类胡萝卜素代谢、光合作用和ROS解毒有关的基因表达受到抑制[24]。在茶树新梢中不响应低温,但在成熟叶中,和受低温显著诱导,作者认为可能是茶树新梢较成熟叶可积累更多的茶多酚,而茶多酚可以清除细胞中的ROS,由此造成了部分基因(如依赖ROS信号途径基因)在成熟叶和新梢中对低温的差异响应[25]。因此,我们推测冷胁迫下,茶树新梢中较高的茶多酚含量影响了和的低温响应表达,和可能在茶树新梢和成熟叶对低温的差异响应机制中发挥作用(图5-B,图5-C)。
目前,已有研究证实了部分参与调控植物的低温响应。受低温诱导,AtCIPK7与AtCBL1互作调控拟南芥的低温响应[26];受低温诱导,正调控水稻的抗寒性[27];受低温诱导,超表达的水稻抗寒性增加[28]。但它们的具体调控机制,除CBL以外的互作蛋白的鉴定及下游目标基因都尚不明确。本研究鉴定的,其表达受低温强烈诱导,而且CsCIPK12能与CsKIN10激酶互作,这为研究CIPK和KIN参与调控植物的低温响应机制提供了新的思路。
3.3 CsCIPK12与CsKIN10响应低温的途径
ABA是重要的信号化合物,参与多种非生物胁迫的信号转导,进而调节植物的胁迫耐受性[29]。先于对ABA做出响应(图6),这与低温处理结果相一致,说明可能在茶树响应非生物胁迫的早期发挥重要作用。ABA在低温胁迫下发挥重要作用,其中,冷处理使拟南芥中ABA含量短暂增加[30];冷驯化使番茄中ABA的生物合成显著提高[31];外源ABA的施加可以改变冷相关基因和的表达,通过维持细胞膜稳定性、改善光系统Ⅱ过程、增加冷胁迫下碳同位素分馏等途径增强百慕达草的抗寒性[32]。同时,在拟南芥和其他植物中,有研究证明参与ABA信号通路[11,33-34]。因此,我们推测和可能通过ABA信号途径调控茶树的低温胁迫。
在非生物胁迫下,植物体内的可溶性糖含量增加,糖不仅作为渗透调节物质来维持细胞渗透势,而且作为信号分子来调控胁迫相关基因的转录,从而调控植物的抗逆性。本课题组前期研究发现,糖代谢途径和钙离子信号途径是茶树响应冷驯化获得抗寒性的主要途径[14],而后明确了可溶性糖如蔗糖和葡萄糖等在茶树冷驯化过程中显著积累,糖信号和糖代谢相关基因的表达也发生了显著变化[35]。过表达的拟南芥抗寒性增强,具有较低的蔗糖和果糖含量、较高的淀粉含量和较强的蔗糖代谢关键酶活性,表达水平也显著提高[36],这表明参与糖信号及低温胁迫信号途径。与均能响应葡萄糖和蔗糖处理(图7),暗示这两个基因通过糖代谢或糖信号途径参与植物的低温胁迫响应。此外,SnRK1在糖信号传导和代谢调控中的报道屡见不鲜,而CIPK的相关研究较少。本研究挖掘到了一个新的CIPK基因,受葡萄糖和蔗糖的诱导(图7-A),这为研究CIPK家族基因在糖信号通路以及代谢调控的分子机制提供了借鉴。
植物对非生物逆境表现出各种各样的反应,其体内必然存在着不同信号通路之间的串扰,但是也存在特定的非生物应激信号反应[37]。本研究表明,和可能参与ABA和糖等信号途径,调控茶树的低温胁迫响应。
[1] Coello P, Hey S J, Halford N G. The sucrose non-fermenting-1-related (SnRK) family of protein kinases: potential for manipulation to improve stress tolerance and increase yield [J]. Journal of Experimental Botany, 2011, 62(3): 883-893.
[2] Luan S. The CBL-CIPK network in plant calcium signaling [J]. Trends in Plant Science, 2009, 14(1): 37-42.
[3] Liu J. A calcium sensor homolog required for plant salt tolerance [J]. Science, 1998, 280(5371): 1943-1945.
[4] Qiu Q S, Guo Y, Dietrich M A, et al. Regulation of SOS1, a plasma membrane Na+/H+exchanger in, by SOS2 and SOS3 [J]. Proceedings of the National Academy of Sciences of the United States of America, 2002, 99(12): 8436-8441.
[5] Zhou J, Wang J, Bi Y, et al. Overexpression ofenhances salt tolerance in transgenic poplars [J]. Plant Molecular Biology Reporter, 2014, 32(1): 185-197.
[6] Kim K N, Cheong Y H, Grant J J, et al. CIPK3, a calcium sensor-associated protein kinase that regulates abscisic acid and cold signal transduction in[J]. Plant Cell, 2003, 15(2): 411-423.
[7] Pandey G K, Grant J J, Cheong Y H, et al. Calcineurin-B-like protein CBL9 interacts with target kinase CIPK3 in the regulation of ABA response in seed germination [J]. Molecular Plant, 2008, 1(2): 238-248.
[8] Yan J, Niu F, Liu W Z, et al.positively regulates glucose response [J]. Biochemical and Biophysical Research Communications, 2014, 450(4): 1679-1683.
[9] Ma Q J, Sun M H, Lu J, et al. An apple CIPK protein kinase targets a novel residue of AREB transcription factor for ABA-dependent phosphorylation [J]. Plant Cell & Environment, 2017, 40(10): 2207-2219.
[10] Ma Q J, Sun M H, Kang H, et al. A CIPK protein kinase targets sucrose transporter MdSUT2.2 at Ser(254) for phosphorylation to enhance salt tolerance [J]. Plant Cell & Environment, 2019, 42(3): 918-930.
[11] Jossier M, Bouly J P, Meimoun P, et al. SnRK1 (SNF1-related kinase 1) has a central role in sugar and ABA signalling in[J]. The Plant Journal, 2009, 59(2): 316-328.
[12] Lee K W, Chen P W, Lu C A, et al. Coordinated responses to oxygen and sugar deficiency allow rice seedlings to tolerate flooding [J]. Science Signaling, 2009, 2(91): ra61. doi: 10.1126/scisignal.2000333.
[13] Yu C, Song L, Song J, et al., a Trihelix family gene, mediates cold and drought tolerance by interacting with SnRK1 in tomato [J]. Plant Science, 2018, 270: 140-149.
[14] Wang X C, Zhao Q Y, Ma C L, et al. Global transcriptome profiles ofduring cold acclimation [J]. BMC Genomics, 2013, 14: 415. doi: 10.1186/1471-2164-14-415.
[15] Roychoudhury A, Paul S, Basu S. Cross-talk between abscisic acid-dependent and abscisic acid-independent pathways during abiotic stress [J]. Plant Cell Reports, 2013, 32(7): 985-1006.
[16] Liu H, Wang Y, Li H, et al. Genome-wide identification and expression analysis of calcineurin B-like protein and calcineurin B-like protein-interacting protein kinase family genes in tea plant [J]. DNA and Cell Biology, 2019, 38(8): 824-839.
[17] Wang L, Yao L, Hao X, et al. Transcriptional and physiological analyses reveal the association of ROS metabolism with cold tolerance in tea plant [J]. Environmental and Experimental Botany, 2019, 160: 45-58.
[18] Cao H, Wang L, Yue C, et al. Isolation and expression analysis of 18genes implicated in abiotic stress responses in the tea plant () [J]. Plant Physiology and Biochemistry, 2015, 97: 432-442.
[19] Ruan J, Gerendas J, Hardter R, et al. Effect of nitrogen form and root-zone pH on growth and nitrogen uptake of tea () plants [J]. Annals of Botany, 2006, 99(2): 301-310.
[20] Wei C, Yang H, Wang S, et al. Draft genome sequence ofvar.provides insights into the evolution of the tea genome and tea quality [J]. Proceedings of National Academy of Sciences, 2018, 115(18): E4151-E4158.
[21] 钱文俊, 岳川, 曹红利, 等. 茶树中性/碱性转化酶基因的克隆与表达分析 [J]. 作物学报, 2016, 42(3): 376-388. Qian W J, Yue C, Cao H L, et al. Cloning and expression analysis of a neutral/alkaline invertase gene () in tea plant (L. O.) [J]. Acta Agronomica Sinica, 2016, 42(3): 376-388.
[22] Hao X, Horvath D, Chao W, et al. Identification and evaluation of reliable reference genes for quantitative real-time PCR analysis in tea plant ((L)O. Kuntze) [J]. International Journal of Molecular Sciences, 2014, 15: 22155-22172.
[24] Li N N, Yue C, Cao H L, et al. Transcriptome sequencing dissection of the mechanisms underlying differential cold sensitivity in young and mature leaves of the tea plant () [J]. Journal of Plant Physiology, 2018, 224/225: 144-155.
[25] Ding C Q, Ng S, Wang L, et al. Genome-wide identification and characterization of ALTERNATIVE OXIDASE genes and their response under abiotic stresses in(L.)O.Kuntze [J]. Planta, 2018, 248(5): 1231-1247.
[26] Huang C, Ding S, Zhang H, et al. CIPK7 is involved in cold response by interacting with CBL1 in[J]. Plant Science, 2011, 181(1): 57-64.
[27] Zhang D, Guo X, Xu Y, et al.point-mutation leads to conformation and kinase-activity change for sensing cold responsew [J]. Journal of Integrative Plant Biology, 2019, 61(12): 1194-1200.
[28] Xiang Y, Huang Y, Xiong L. Characterization of stress-responsivegenes in rice for stress tolerance improvement [J]. Plant Physiology, 2007, 144(3): 1416-1428.
[29] Vishwakarma K, Upadhyay N, Kumar N, et al. Abscisic acid signaling and abiotic stress tolerance in plants: a review on current knowledge and future prospects [J]. Frontiers in Plant Science, 2017, 8: 161. doi: 10.3389/fpls.2017.00161.
[30] Lang V, Mantyla E, Welin B, et al. Alterations in water status, endogenous abscisic acid content, and expression of rab78 gene during the development of freezing tolerance in' [J]. Plant Physiology, 1994, 104: 1341-1349.
[31] Lv X, Li H, Chen X, et al. The role of calcium-dependent protein kinase in hydrogen peroxide, nitric oxide and ABA-dependent cold acclimation [J]. Journal of Experimental Botany, 2018, 69(16): 4127-4139.
[32] Huang X, Shi H, Hu Z, et al. ABA is involved in regulation of cold stress response in Bermudagrass [J]. Frontiers in Plant Science, 2017, 8: 1613. doi: 10.1105/tpc.105.035568.
[33] Radchuk R, Emery R J, Weier D, et al. Sucrose non-fermenting kinase 1 (SnRK1) coordinates metabolic and hormonal signals during pea cotyledon growth and differentiation [J]. Plant Journal, 2010, 61(2): 324-338.
[34] Greco M, Chiappetta A, Bruno L, et al. In Posidonia oceanica cadmium induces changes in DNA methylation and chromatin patterning [J]. Journal of Experimental Botany, 2012, 63(2): 695-709.
[35] Yue C, Cao H L, Wang L, et al. Effects of cold acclimation on sugar metabolism and sugar-related gene expression in tea plant during the winter season [J]. Plant Molecular Biology, 2015, 88(6): 591-608.
[36] Liu X, Fu L, Qin P, et al. Overexpression of the wheat trehalose 6-phosphate synthase 11 gene enhances cold tolerance in[J]. Gene, 2019, 710: 210-217.
[37] Knight H, Knight M R. Abiotic stress signalling pathways: specificity and cross-talk [J]. Trends in Plant Science, 2001, 6(6): 262-267.
Interaction Identification and Expression Analysis of CsCIPK12 and CsKIN10 in Tea Plant
FENG Xia, DI Taimei, PENG Jing, LI Nana, YAO Lina, YANG Yajun, WANG Xinchao*, WANG Lu*
Tea Research Institute, Chinese Academy of Agricultural Sciences / National Center for Tea Improvement/Key Laboratory of Tea Biology and Resource Utilization, Ministry of Agriculture and Rural Affairs, Hangzhou 310008, China
Sucrose non-fermenting 1-related protein kinase (SnRK) plays important roles in metabolic regulation and stress signal transduction. In this study,gene of the SnRK3 subfamily andgene of the SnRK1 subfamily in tea plant were used as research objects. Protein sequence alignment and phylogenetic tree analysis showed that both CsCIPK12 and CsKIN10 have an N-terminal kinase domain and a C-terminal regulatory domain; CsCIPK12 has a NAF/FISL domain that binds to CBLs, and is homologous with AtCIPK12 inand PtCIPK17, 18, and 19 in poplar; CsKIN10 has the ubiquitin-related UBA domain and is homologous with PtSnRK1 in poplar. Yeast two-hybrid analysis showed that CsCIPK12 could interact with CsKIN10. Expression analysis found that the expression ofwas induced by natural cold acclimation to varying degrees in the three tea cultivars ‘Longjing 43’, ‘Zhenong 12’ and ‘Damianbai’, which was consistent with the results of the previous study on. Under 4℃ cold stress, the expressions ofandwere significantly up-regulated in mature leaves (the highest induction levels were 4-fold and 2.3-fold, respectively), while in the shoots, the responses ofandto the cold stress were not significant. Under ABA, glucose and sucrose treatments, the expression levels ofandwere significantly up-regulated in mature leaves. These results suggest that CsCIPK12 interacts with CsKIN10, which are involved in ABA and sugar signaling pathways and may play an important role in cold response in tea plants.
tea plant, CIPK12/SnRK3.9, KIN10/SnRK1.1, cold stress, yeast two-hybrid
S571.1;Q946.84+1;Q939.1
A
1000-369X(2020)06-739-12
2020-04-20
2020-05-13
国家自然科学基金项目(31870685)、中央级科研院所基本科研业务费专项(1610212018007)、现代农业(茶叶)产业技术体系(CARS-19)
冯霞,女,硕士研究生,主要从事茶树遗传育种与抗逆机理研究。*通信作者:xcw75@tricaas.com;wanglu317@tricaas.com
